Содержание
- 2. Современная формулировка Периодического закона После того, как было доказано ядерное строение атома и равенство порядкового номера
- 3. Периодическая система и ее структура. S,p,d,f-элементы. Главный принцип построения Периодической системы – выделение в ней периодов
- 4. Группы и подгруппы. Номер группы в Периодической системе определяет число валентных электронов в атомах элементов главных
- 5. Периоды Номер периода = Число энергетических уровней (слоёв) , заполняемых электронами = номеру последнего энергетического уровня
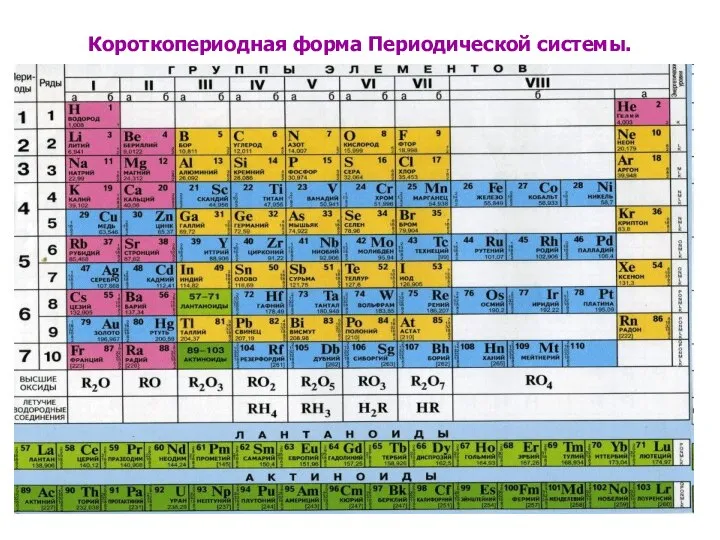
- 6. Короткопериодная форма Периодической системы.
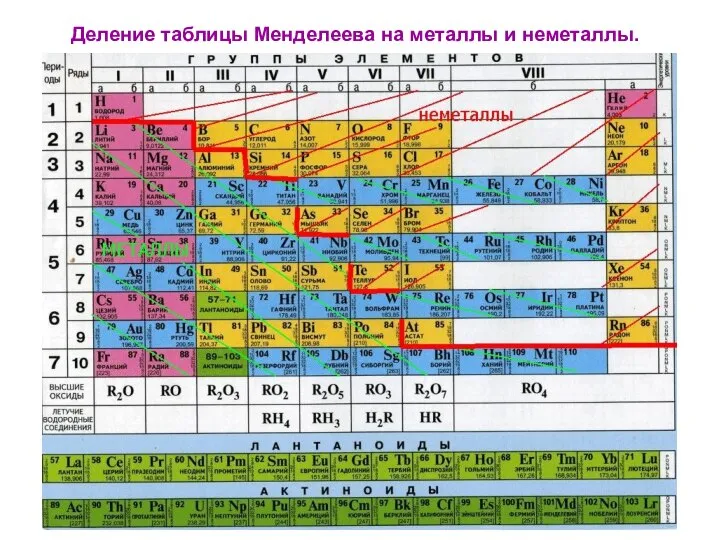
- 7. Деление таблицы Менделеева на металлы и неметаллы.
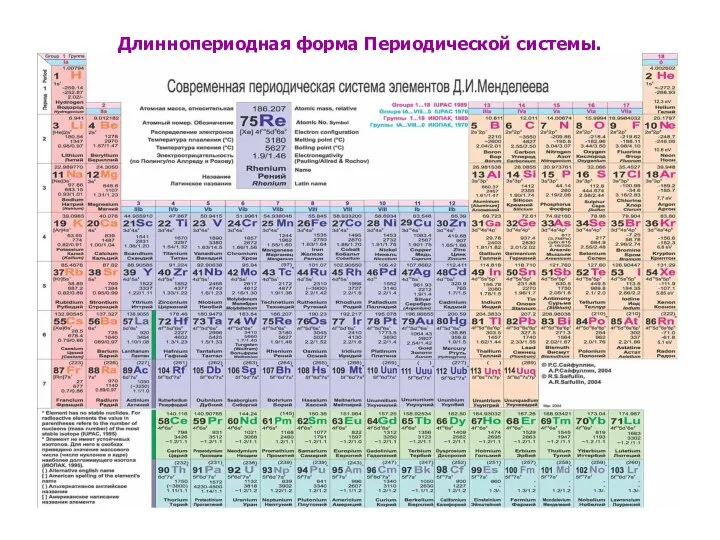
- 8. Длиннопериодная форма Периодической системы.
- 9. Закономерности изменения свойств элементов в Периодической системе.
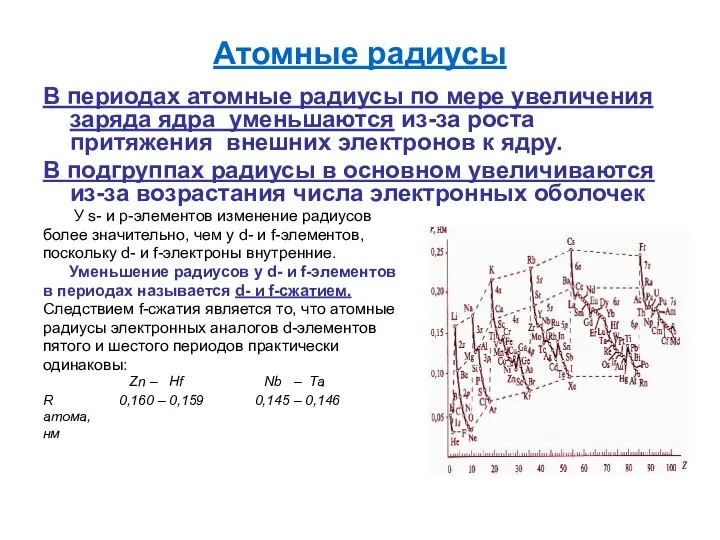
- 10. Атомные радиусы В периодах атомные радиусы по мере увеличения заряда ядра уменьшаются из-за роста притяжения внешних
- 11. Ионные радиусы Образование ионов приводит к изменению ионных радиусов по сравнению с атомными. При этом радиусы
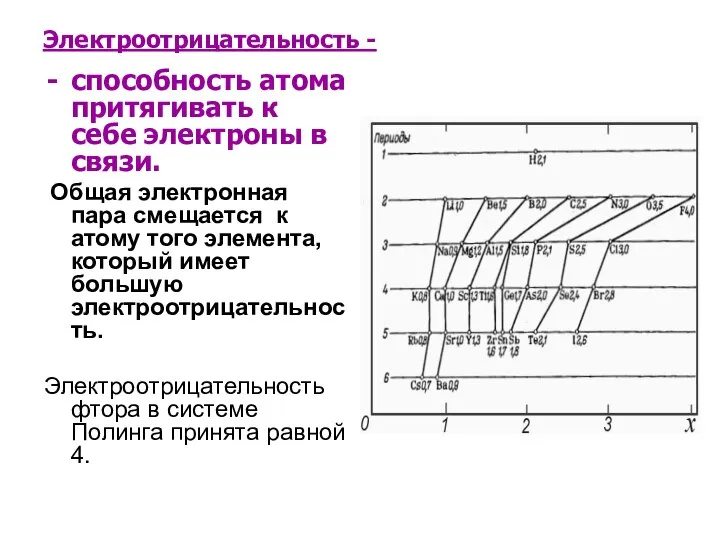
- 12. Электроотрицательность - способность атома притягивать к себе электроны в связи. Общая электронная пара смещается к атому
- 13. Изменение электроотрицательности Сверху вниз по подгруппе электроотрицательность уменьшается, т.к. радиус атомов растёт и притяжение внешнего члоя
- 14. Металлы- все элементы побочных подгрупп; лантаноиды, актиноиды; все s- элементы, кроме водорода и гелия, а также
- 15. Валентность - – число связей, которые образует атом в молекуле. Число электронов на внешнем слое –
- 16. Степень окисления- – условный заряд у атома в молекуле. Высшая положительная степень окисления определяется числом внешних
- 17. Слева направо по периоду: уменьшается радиус атома - засчёт увеличения заряда ядра и роста притяжения внешней
- 18. появляется отрицательная степень окисления у неметаллов, т.к. элемент-неметалл стремится приниать электроны до 8 (оболочка инертного газа).
- 19. Сверху вниз по подгруппе: Возрастает радиус атома, т.к. растёт число электронных слоёв. Усиливаются металлические свойства и
- 21. Скачать презентацию













 Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов
Разработка водно-парафиновых эмульсий для антикоррозийной обработки металлов «РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА
«РАЗВИТИЕ ТВОРЧЕСКИХ СПОСОБНОСТЕЙ УЧАЩИХСЯ ПРИ ИЗУЧЕНИИ ХИМИИ» учитель химии МОУ «СОШ №4» СМЫВИНА ЕЛЕНА ЮРЬЕВНА Белки, протеины, полипептиды
Белки, протеины, полипептиды Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко
Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочко Углеводы. Сукралоза
Углеводы. Сукралоза Кремний
Кремний Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21)
Кровь. Клеточный состав, функции, физико-химические константы и свойства. (Лекция 21) Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Кремний и его соединения
Кремний и его соединения Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Химия и физика полимеров. Курс лекций
Химия и физика полимеров. Курс лекций Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа
Теоретическая кинетика. Влияние температуры на скорость реакции. Правило Вант-Гоффа Состояние и свойства воды
Состояние и свойства воды Лекция №4. Строение металлических сплавов
Лекция №4. Строение металлических сплавов Метиловый спирт
Метиловый спирт Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно
Презентация по Химии "НИТРАТЫ. ИХ ВЛИЯНИЕ НА ЗДОРОВЬЕ ЛЮДЕЙ" - скачать смотреть бесплатно Пневматолито-гидротермальный процесс
Пневматолито-гидротермальный процесс Строение и свойства материалов
Строение и свойства материалов Азот в природе
Азот в природе Обменный и донорно-акцепторный механизм образования связи
Обменный и донорно-акцепторный механизм образования связи Кислоты: классификация, реакции, применение
Кислоты: классификация, реакции, применение Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Развитие российской нефтепереработки и нефтехимии
Развитие российской нефтепереработки и нефтехимии Нуклеиновые кислоты
Нуклеиновые кислоты Эксперимент. Выращивание солевых кристаллов
Эксперимент. Выращивание солевых кристаллов Оксид серы IV. Сернистая кислота
Оксид серы IV. Сернистая кислота Липиды. Составные части липидов
Липиды. Составные части липидов Радиофармацевтическая химия
Радиофармацевтическая химия