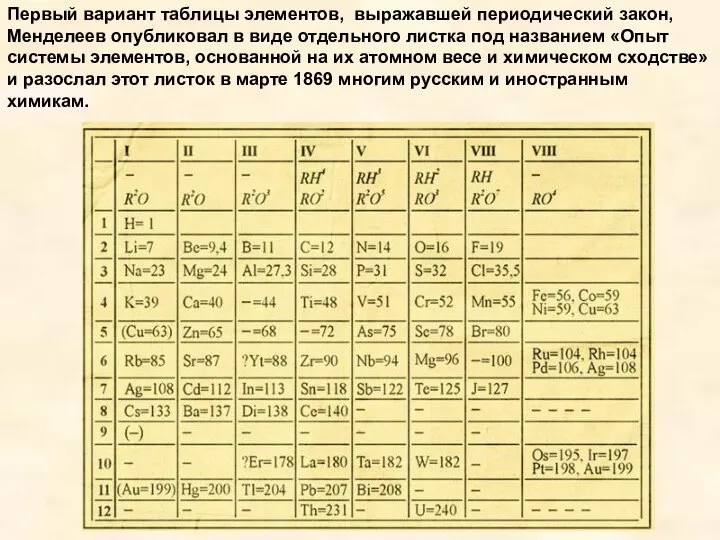
Развернутую форму таблицы получают, когда последовательные периоды элементов разместить в виде
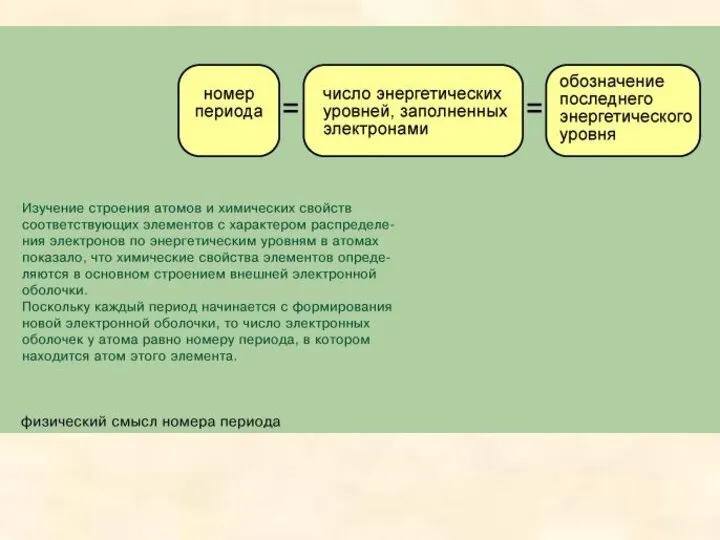
горизонтальных рядов, так чтобы сходные по свойствам элементы оказались строго друг под другом. В такой таблице короткие периоды оказываются разделенными - по 2 элемента в начале и по 6 в конце таблицы, а между ними в четвертом и пятом периодах по 10 элементов, в шестом- 32 элемента (14 лантаноидов вместе с лантаном размещаются в одной клетке); всего 10 столбцов.
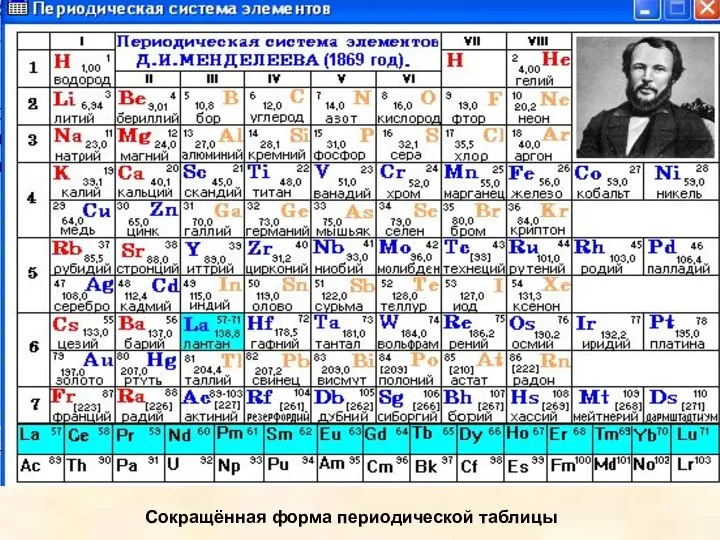
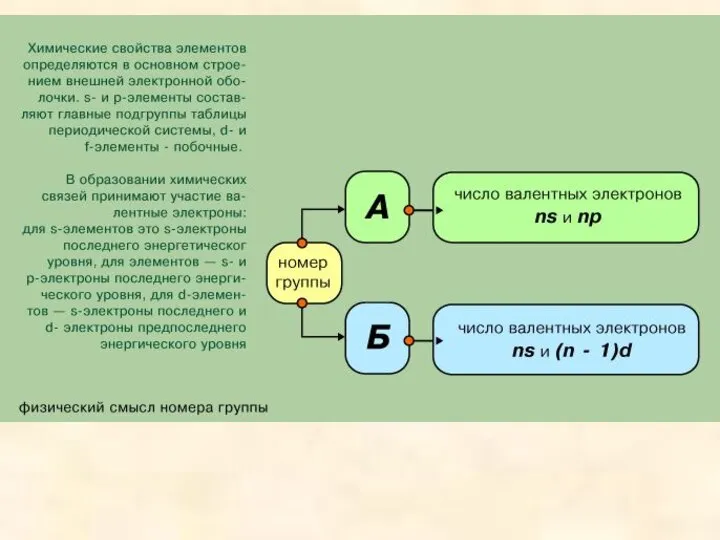
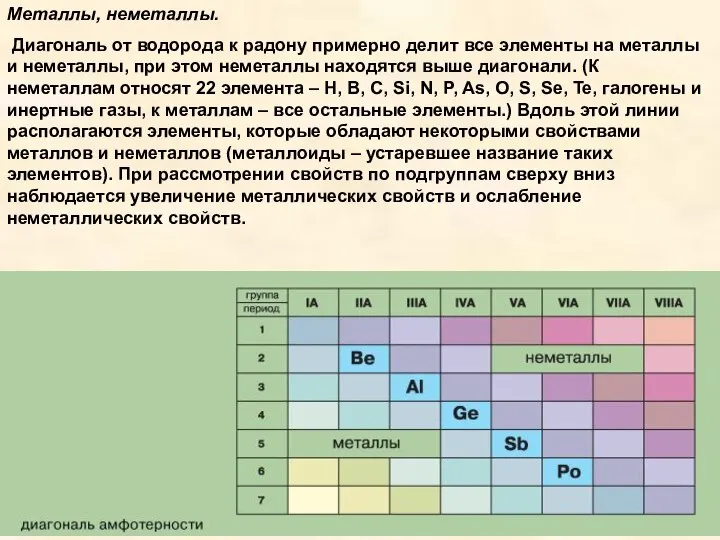
Элементы с похожими свойствами в вертикальных столбцах этой таблицы образуют подгруппы. Подгруппы с элементами второго и третьего коротких периодов называются главными, а остальные - побочными. Всего в таблице 8 главных и 8 побочных подгрупп: всего 16. Главные подгруппы обозначаются индексом “а” - Iа, IIа. Побочные подгруппы обозначаются индексом “б” - Iб, IIб и т. д.














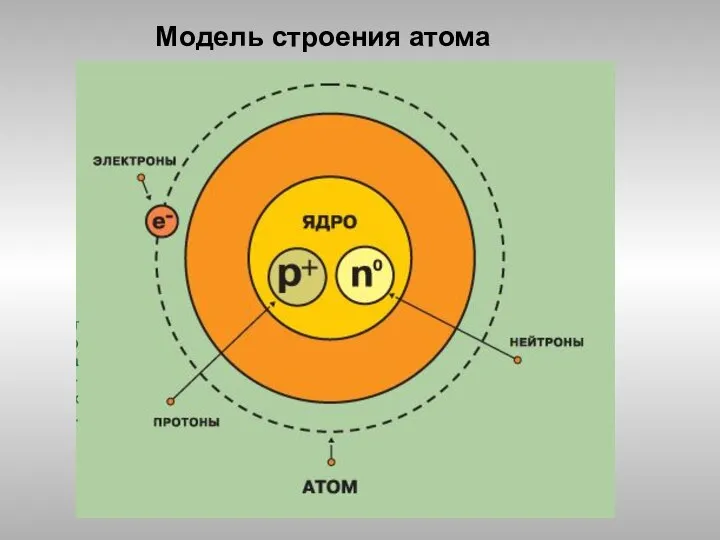





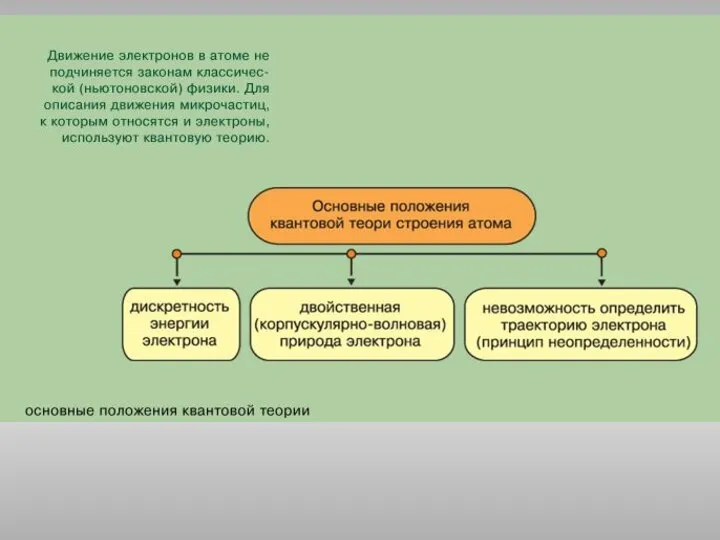



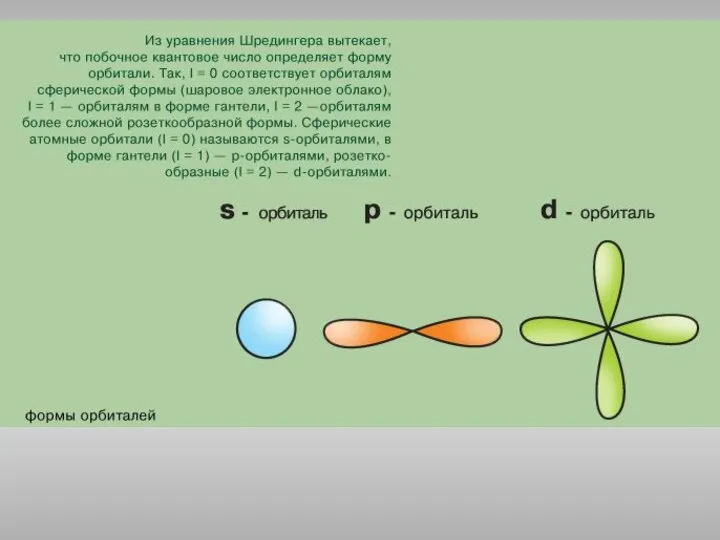



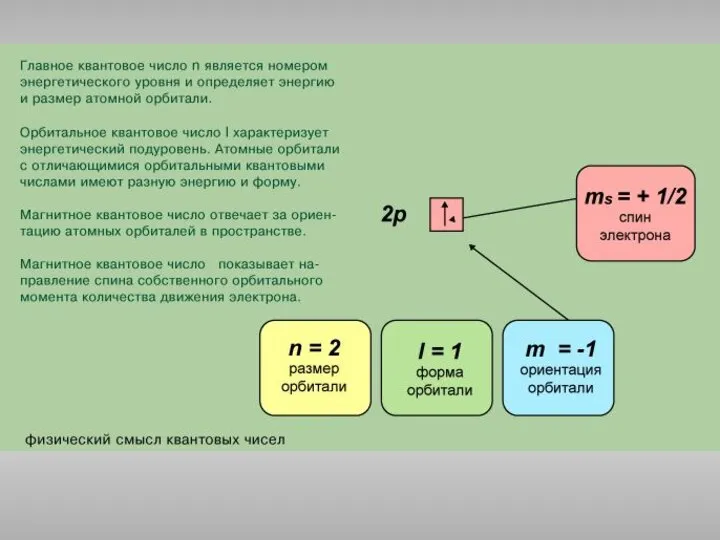








 Липидтер. Сабынданатын және сабынданбайтын липидтер
Липидтер. Сабынданатын және сабынданбайтын липидтер Нефть. Состав и свойства
Нефть. Состав и свойства Классификация химических реакций
Классификация химических реакций Атоми і хімічні елементи. Молекули, їх рух. Дифузія
Атоми і хімічні елементи. Молекули, їх рух. Дифузія Игра - викторина
Игра - викторина Алкины
Алкины II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид
II группа периодической системы Д. И. Менделеева. Магния сульфат. Кальция хлорид Кислоты
Кислоты Нуклеиновые кислоты
Нуклеиновые кислоты Основные характеристики химического равновесия:
Основные характеристики химического равновесия: Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа
Термодинамика химического равновесия. Уравнения изотермы, изобары, изохоры Вант-Гоффа Решение задач на вывод формул органических веществ относительно плотности
Решение задач на вывод формул органических веществ относительно плотности Электролиз раствора CuSO4.
Электролиз раствора CuSO4. Ацетилен
Ацетилен Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ
Полимеры: польза или вред? Выполнила: Ученица 10 «А» класса Архипова Аятэ Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Презентация Строение атомного ядра
Презентация Строение атомного ядра  Липиды: функции и обмен
Липиды: функции и обмен Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23)
Функциональная биохимия. Биохимия крови. (Раздел 11. Лекции 22-23) Оксиды углерода
Оксиды углерода Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари
Роль хімії у розв`язанні екологічної проблеми Підготувала: учениця 11-А класу Житомирського міського колегіму Рачинська Мари Химическая кинетика, химическое равновесие и катализ
Химическая кинетика, химическое равновесие и катализ Презентация по Химии "Аминокислоты белки аминокислоты" - скачать смотреть
Презентация по Химии "Аминокислоты белки аминокислоты" - скачать смотреть  Ковалентная химическая связь. 11 класс
Ковалентная химическая связь. 11 класс Биохимия соединительной ткани
Биохимия соединительной ткани Мышьяк (лат. аrsenicum)
Мышьяк (лат. аrsenicum) Петрография
Петрография Презентация по Химии "Соли в медицине" - скачать смотреть
Презентация по Химии "Соли в медицине" - скачать смотреть