Содержание
- 2. ПС элементов была предложена выдающимся русским химиком Д.И. Менделеевым в 1869 году
- 3. ПЕРИОДИЧЕСКИЙ ЗАКОН Свойства простых веществ и соединений, которые они образуют, находятся в периодической зависимости от величины
- 4. ПЕРИОДИЧЕСКИЙ ЗАКОН Периодический закон был сформулирован почти за полстолетия до открытия электрона! Сформулированный закон позволил: уточнить
- 5. ПС ЭЛЕМЕНТОВ ЧАСТО ИСПОЛЬЗУЕМАЯ В РОССИИ (короткопериодный вариант)
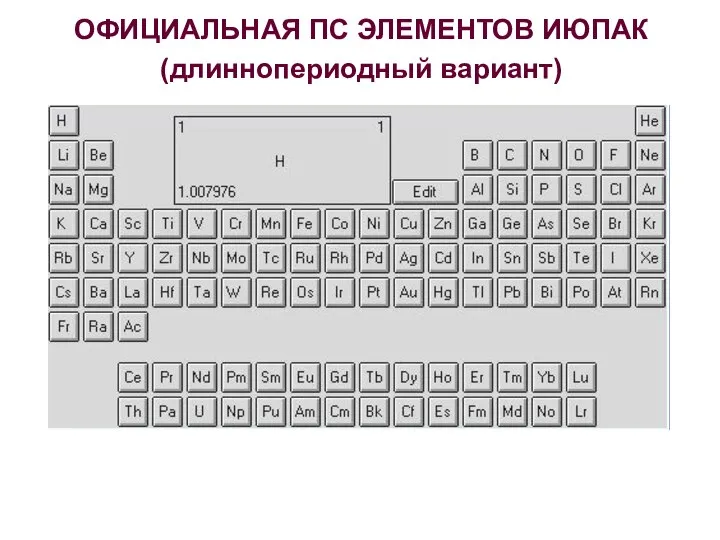
- 6. ОФИЦИАЛЬНАЯ ПС ЭЛЕМЕНТОВ ИЮПАК (длиннопериодный вариант)
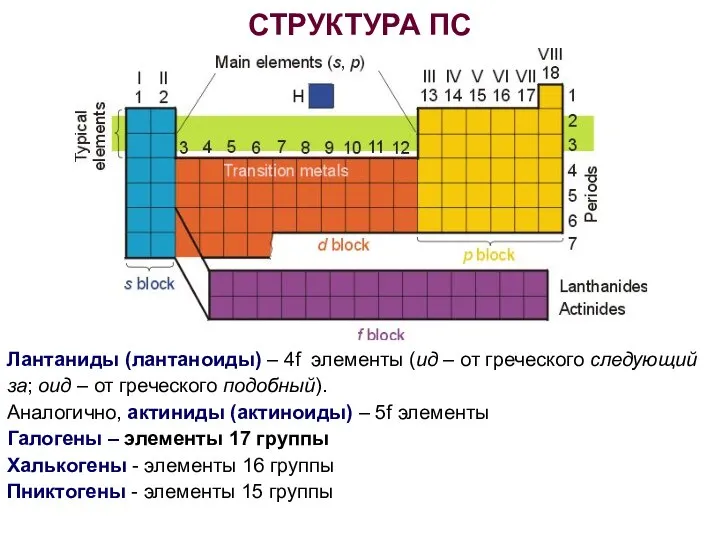
- 7. СТРУКТУРА ПС Лантаниды (лантаноиды) – 4f элементы (ид – от греческого следующий за; оид – от
- 8. Закономерности изменения свойств атомов и ионов К числу важнейших свойств элементов, определяемых электронным строением, относятся: радиусы;
- 9. Закономерности изменения свойств атомов и ионов Одна из основных характеристик атомов и ионов – их размеры.
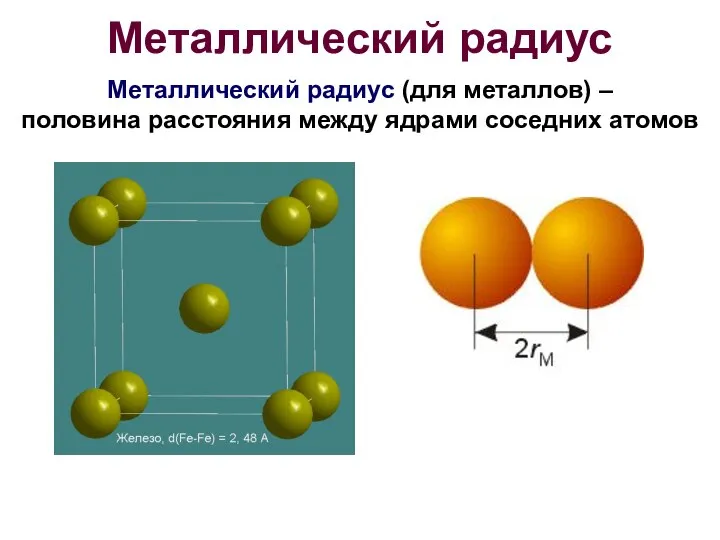
- 10. Металлический радиус Металлический радиус (для металлов) – половина расстояния между ядрами соседних атомов
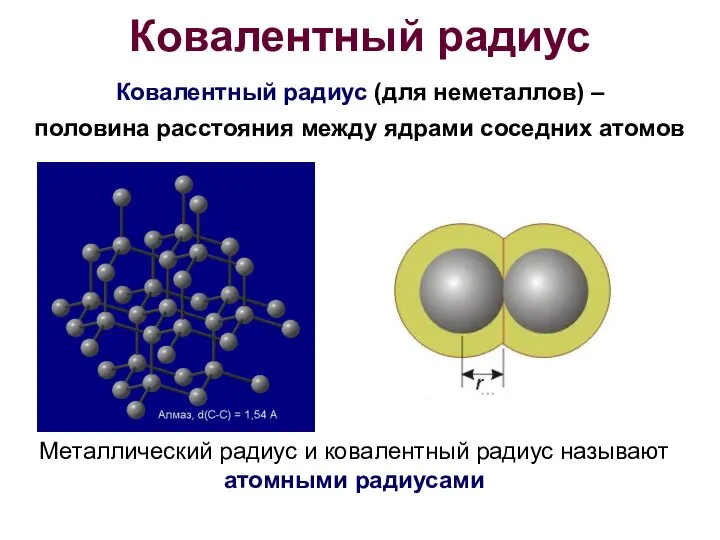
- 11. Ковалентный радиус Ковалентный радиус (для неметаллов) – половина расстояния между ядрами соседних атомов Металлический радиус и
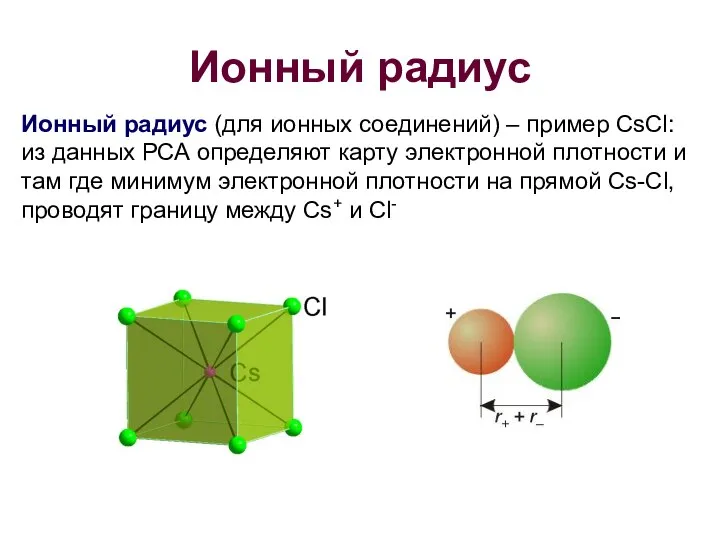
- 12. Ионный радиус Ионный радиус (для ионных соединений) – пример CsCl: из данных РСА определяют карту электронной
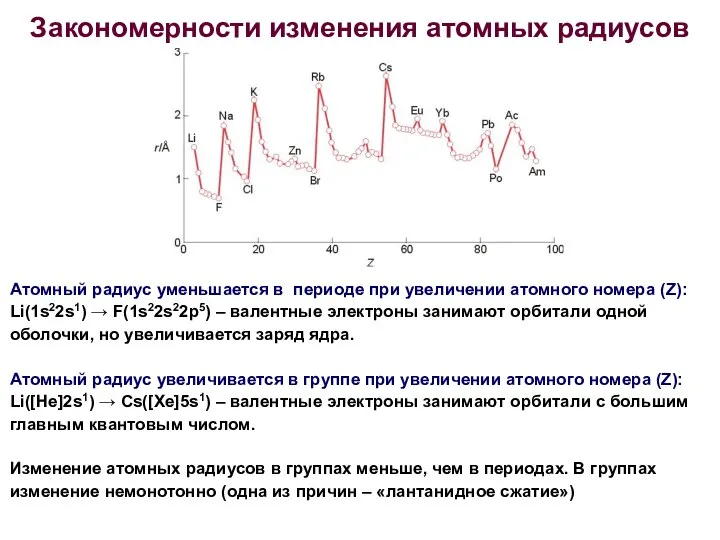
- 13. Закономерности изменения атомных радиусов Атомный радиус уменьшается в периоде при увеличении атомного номера (Z): Li(1s22s1) →
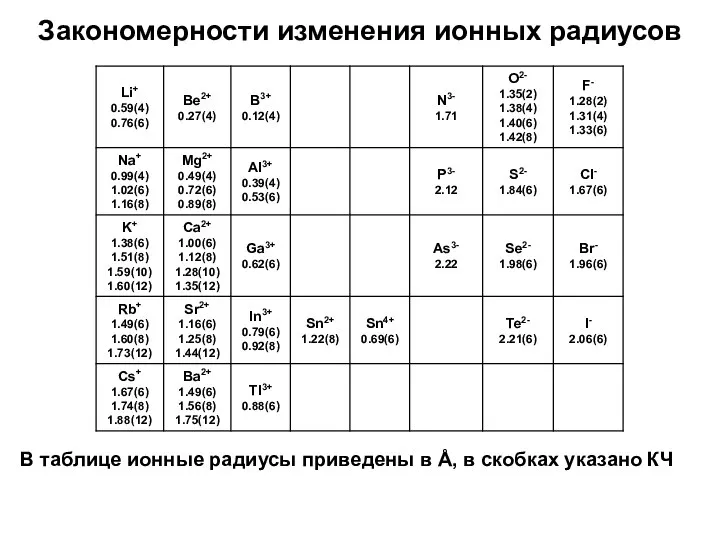
- 14. Закономерности изменения ионных радиусов В таблице ионные радиусы приведены в Å, в скобках указано КЧ
- 15. Закономерности изменения ионных радиусов Ионный радиус зависит от координационного окружения (КЧ) – чем больше КЧ, тем
- 16. Закономерности изменения ионных радиусов для переходных металлов В периоде: Ti2+ (1,00 Å) → Ni2+ (0,83 Å)
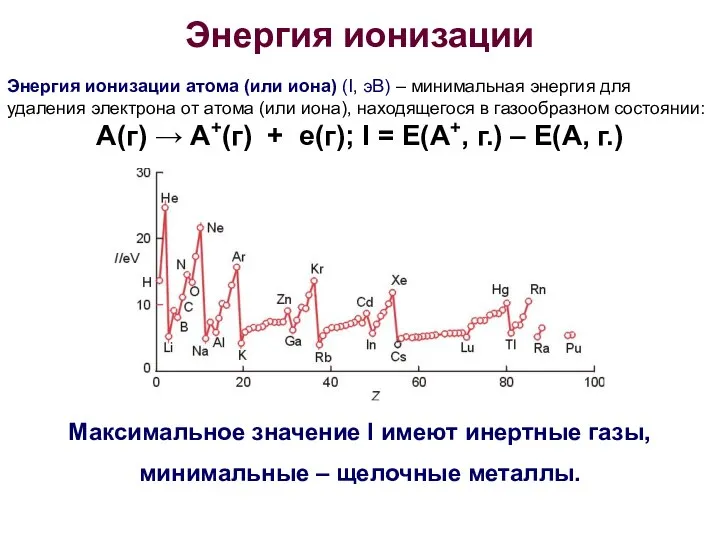
- 17. Энергия ионизации Энергия ионизации атома (или иона) (I, эВ) – минимальная энергия для удаления электрона от
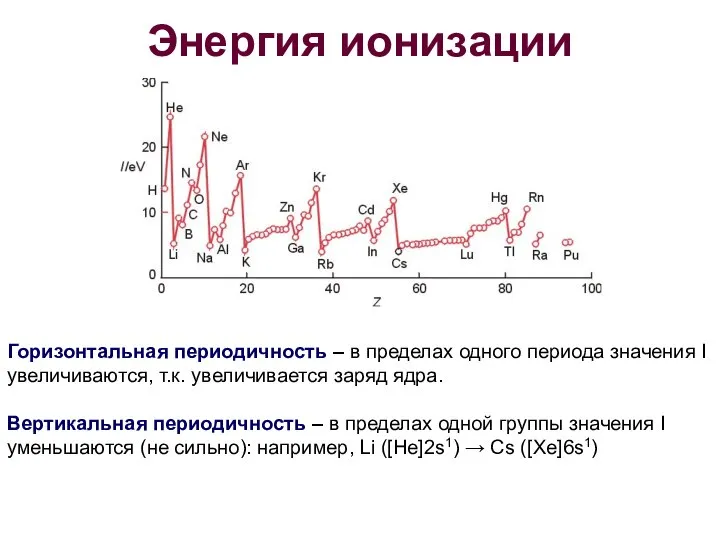
- 18. Энергия ионизации Горизонтальная периодичность – в пределах одного периода значения I увеличиваются, т.к. увеличивается заряд ядра.
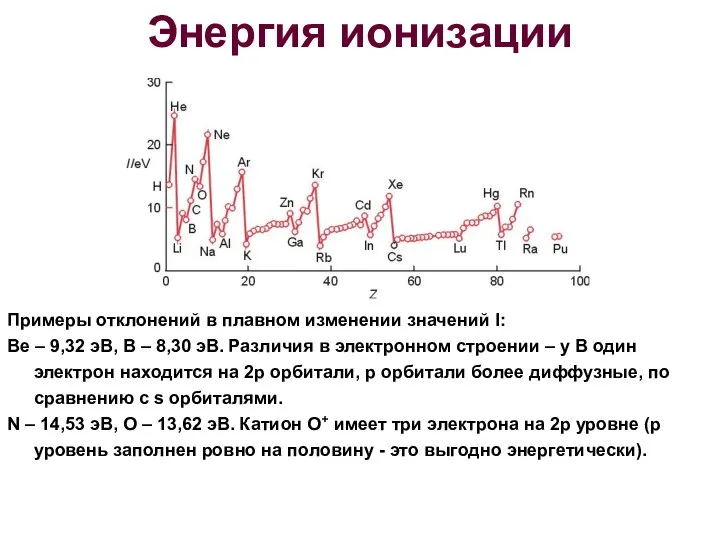
- 19. Энергия ионизации Примеры отклонений в плавном изменении значений I: Be – 9,32 эВ, В – 8,30
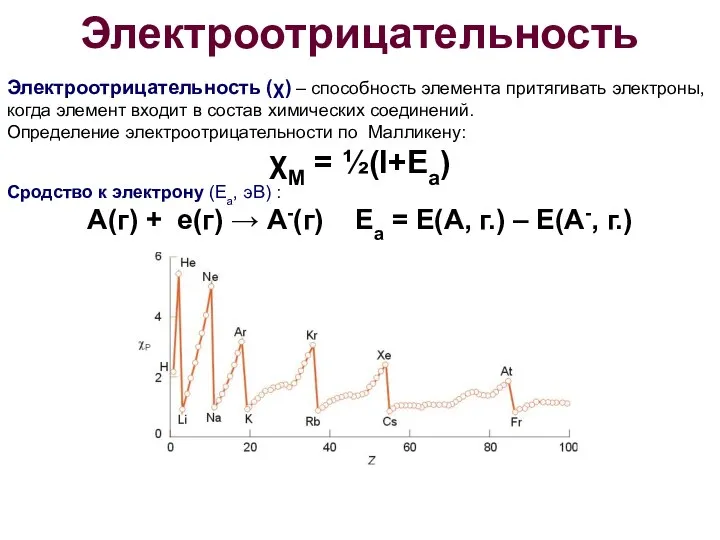
- 20. Электроотрицательность Электроотрицательность (χ) – способность элемента притягивать электроны, когда элемент входит в состав химических соединений. Определение
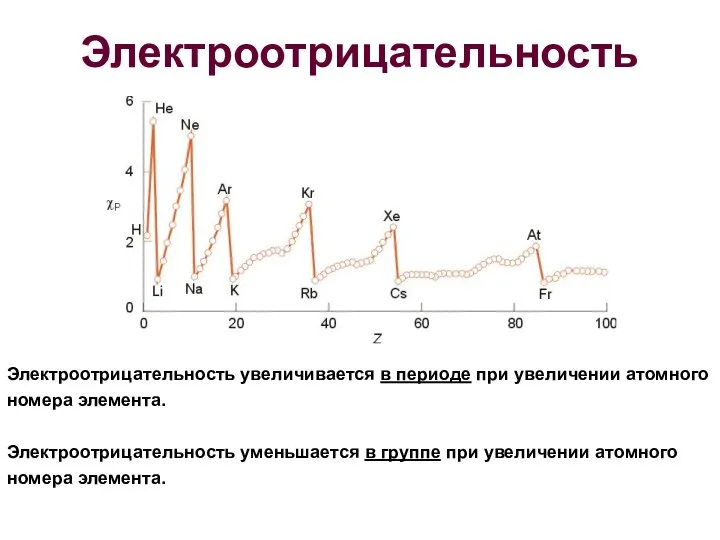
- 21. Электроотрицательность Электроотрицательность увеличивается в периоде при увеличении атомного номера элемента. Электроотрицательность уменьшается в группе при увеличении
- 22. Закономерности изменения кислотно-основных свойств гидроксидов элементов Основные свойства: ЭОН → Э+ + ОН- Кислотные свойства: ЭОН
- 23. Закономерности изменения кислотно-основных свойств гидроксидов элементов Уменьшение основных свойств коррелирует с увеличением заряда катиона и уменьшением
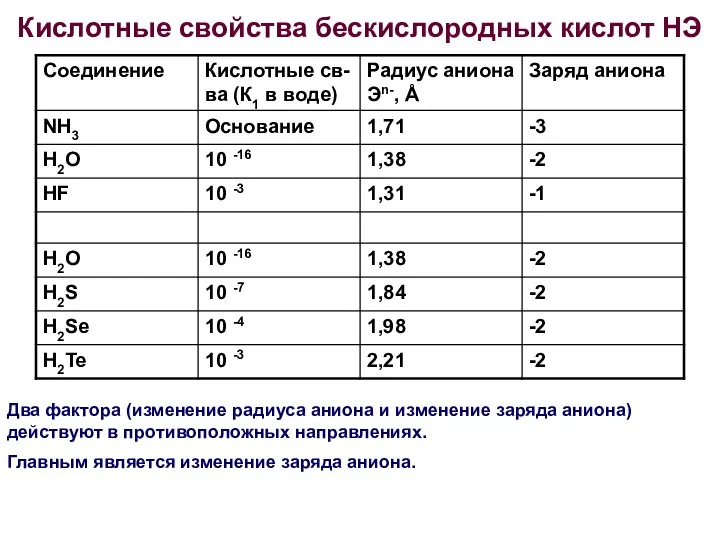
- 24. Кислотные свойства бескислородных кислот НЭ Два фактора (изменение радиуса аниона и изменение заряда аниона) действуют в
- 25. Эмпирическая корреляция между строением и силой кислоты (правила Полинга) Можно предсказать относительную силу кислот: для кислородсодержащих
- 26. Некоторые закономерности изменения окислительно-восстановительных свойств Э + 2е + 2Н+ → Н2Э (Э – халькоген) Окислительные
- 27. Окислительно-восстановительные свойства соединений элементов в высших степенях окисления Главные элементы – s и p: 14 группа:
- 29. Скачать презентацию













 Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот What is enthalpy?
What is enthalpy? Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Магнитные свойства твердых тел
Магнитные свойства твердых тел Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Гормоны щитовидной и поджелудочной желез. (Лекция 13)
Гормоны щитовидной и поджелудочной желез. (Лекция 13) Особенности строения, реакционной способности и методы синтеза алкенов
Особенности строения, реакционной способности и методы синтеза алкенов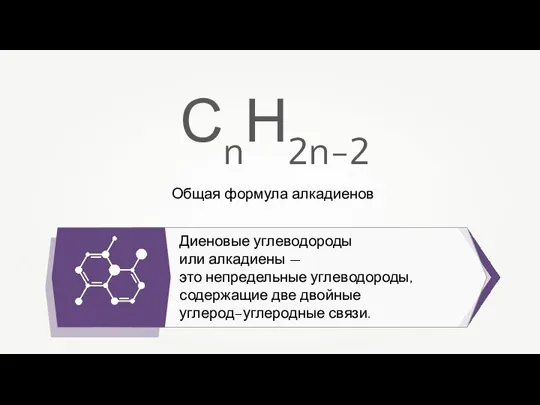 Общая формула алкадиенов
Общая формула алкадиенов Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Углеводороды: номенклатура
Углеводороды: номенклатура Алканы. Пропан
Алканы. Пропан Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение
Строение, изомерия, физические и химические свойства алкенов. Способы получения алкенов. Применение Методы выделения, очистки, идентификации и изучения мембранных структур
Методы выделения, очистки, идентификации и изучения мембранных структур Реакции ионного обмена
Реакции ионного обмена Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі
Металдар мен бейметалдар, олардың қосылыстарының қасиеттерінің период және топ бойынша өзгеруі Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов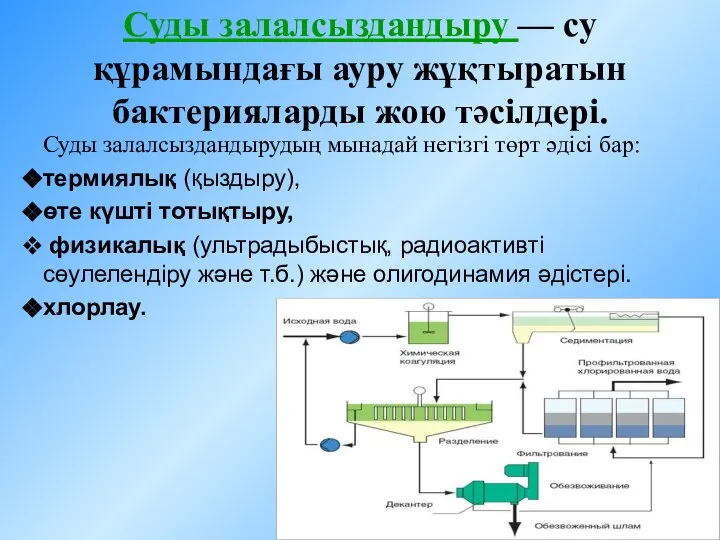 Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері
Суды залалсыздандыру - су құрамындағы ауру жұқтыратын бактерияларды жою тәсілдері Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов
Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов Химические свойства многоатомных спиртов
Химические свойства многоатомных спиртов Химическая термодинамика
Химическая термодинамика Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.
Любовь, что движет Солнце и Светила Интегрированный урок по химии и литературе Подготовили: учитель химии Акимова О.В.  Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии
Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ
Химический состав клетки. Нуклеиновые кислоты. ДНК. РНК, АТФ Пятичленные гетероциклические соединения. Профильный уровень
Пятичленные гетероциклические соединения. Профильный уровень