Содержание
- 2. УМК «ХИМИЯ» Тема лекции: Электролиз Лектор – Иванов М.Г.
- 3. Цель лекции: изложение основных понятий электролиза водных растворов и расплав электролитовий в рамках современной химической теории
- 4. СОДЕРЖАНИЕ Основные понятия Электролиз расплавов электролитов Электролиз водных растворов электролитов Катодные процессы Поведение ионов металлов Перенапряжение
- 5. Основные понятия Электролиз – это совокупность окислительно-восстановительных процессов, которые протекают на электродах, помещенных в раствор или
- 6. содержание Е = -nF/ΔG Если ЭДС будет отрицательной, то самопроизвольное протекание ОВР становится невозможным. Основные понятия
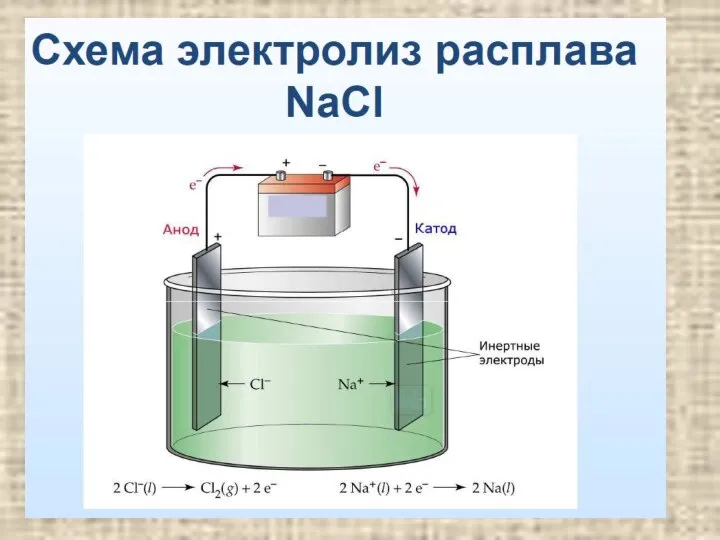
- 7. Электролиз расплавов электролитов содержание В простейших бинарных электролитах типа MeHal , MeHal2 (Me – металл IA
- 10. Электролиз расплавов электролитов содержание При электролизе расплава гидродифторида калия (анод – угольный, катод – никелевый) протекает
- 14. Катодные процессы На катоде идет процесс восстановления окислителя: содержание Ox + ne = Red Men+ +
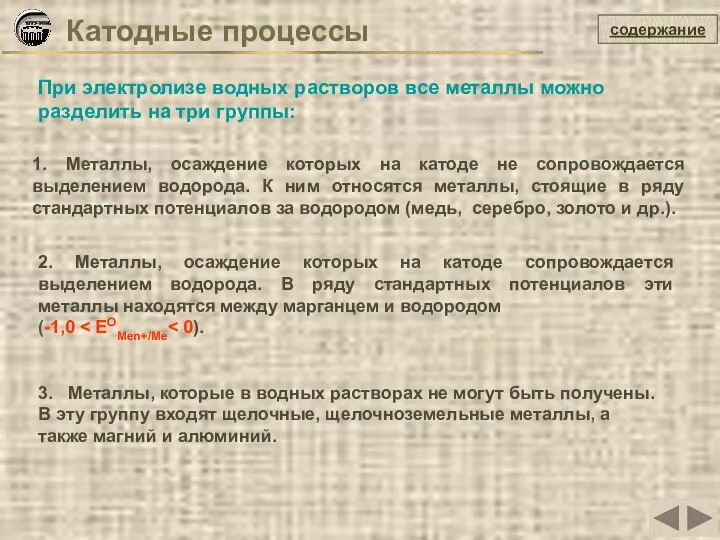
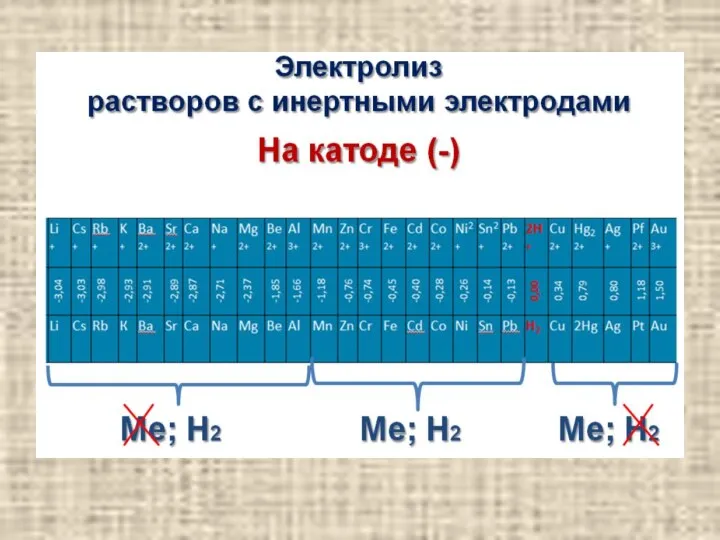
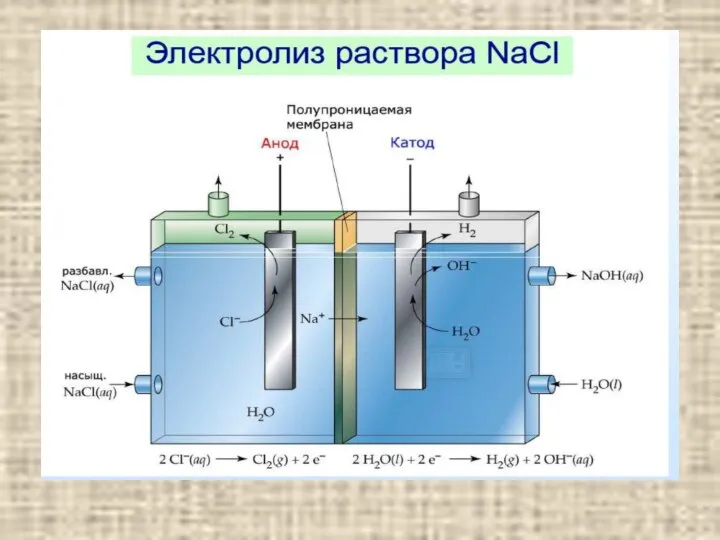
- 16. Катодные процессы содержание При электролизе водных растворов все металлы можно разделить на три группы: 1. Металлы,
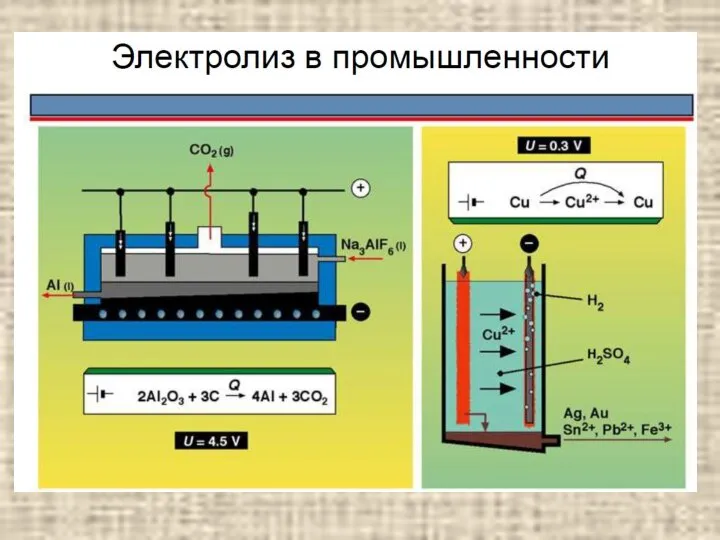
- 19. Электролиз с растворимым анодом содержание Электролиз с растворимым анодом используют для рафинирования некоторых металлов – меди,
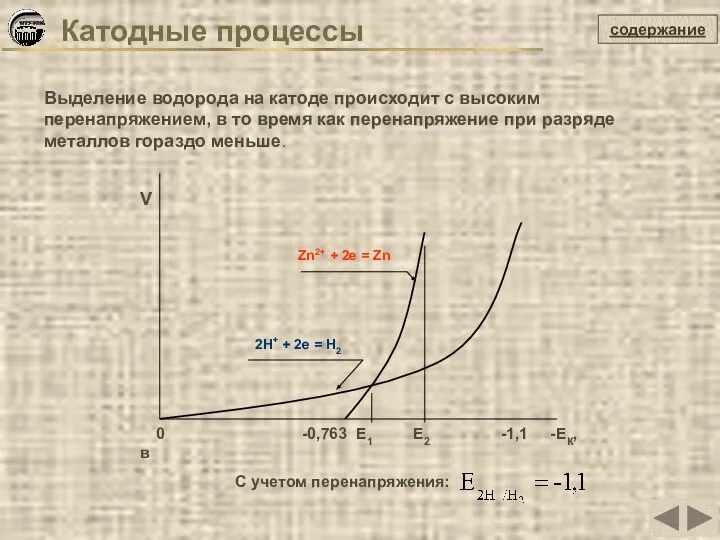
- 20. Катодные процессы содержание Выделение водорода на катоде происходит с высоким перенапряжением, в то время как перенапряжение
- 21. Анодные процессы содержание Red – ne = Ох На аноде идет процесс окисления восстановителя: 2Н2О –
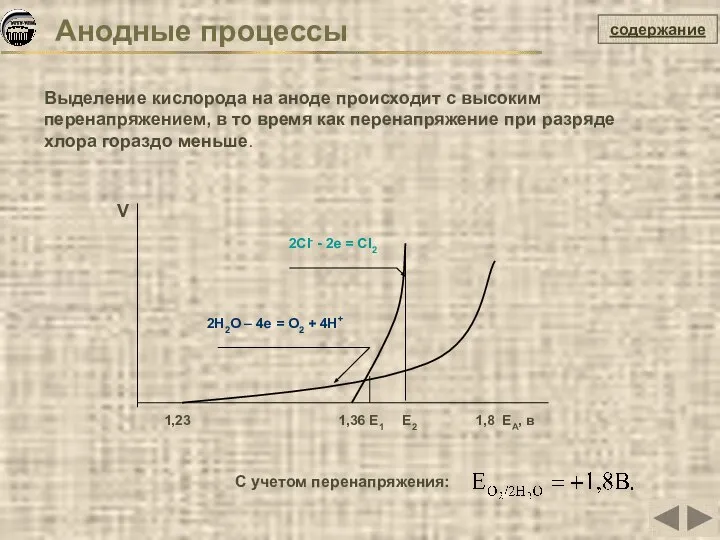
- 22. содержание С учетом перенапряжения: Выделение кислорода на аноде происходит с высоким перенапряжением, в то время как
- 23. содержание Анионы кислородсодержащих кислот SO42-, PO43-, NO3- и др., в которых центральный атом имеет высшую степень
- 24. содержание Пpи высоких анодных плотностях тока некотоpые анионы могут окисляться до пеpоксоанионов, напpимеp: 2SO42− − 2e
- 26. Законы электролиза содержание Установил (1833-1834) законы электролиза, названные его именем. Фарадей (Faraday) Майкл (1791-1867).
- 28. Законы электролиза содержание I закон. Масса вещества, окисленного на аноде или восстановленного на катоде, пропорциональна количеству
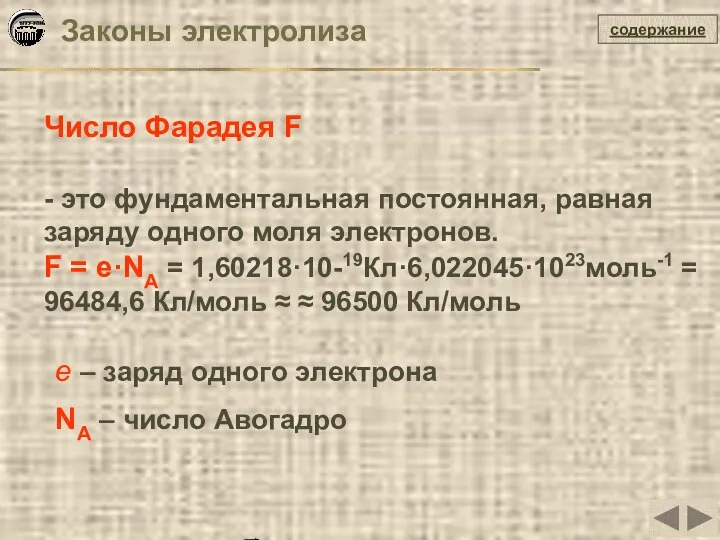
- 29. содержание Число Фарадея F - это фундаментальная постоянная, равная заряду одного моля электронов. F = e·NA
- 34. Скачать презентацию





















 Электролитическая диссоциация
Электролитическая диссоциация Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Теоретическая электрохимия, часть 1
Теоретическая электрохимия, часть 1 Презентация по Химии "Метан" - скачать смотреть бесплатно
Презентация по Химии "Метан" - скачать смотреть бесплатно Көміртек
Көміртек Как сделать петуха из бумаги
Как сделать петуха из бумаги  Катализ.Лекция
Катализ.Лекция Презентация по Химии "Ацетилен" - скачать смотреть
Презентация по Химии "Ацетилен" - скачать смотреть  Что Вы ожидаете от занятия? Отметьте своё настроение.
Что Вы ожидаете от занятия? Отметьте своё настроение.  Е-числа Підготували учні 11-І класу Черкаської спеціалізованої школи №13 Білокінь Анастасія Левченко Таміла
Е-числа Підготували учні 11-І класу Черкаської спеціалізованої школи №13 Білокінь Анастасія Левченко Таміла  Энергетика и направление химических реакций
Энергетика и направление химических реакций Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония Металлы. Разнообразие металлов
Металлы. Разнообразие металлов Мембранний транспорт. Рівняння Теорела. Рівняння проникності мембран
Мембранний транспорт. Рівняння Теорела. Рівняння проникності мембран Достижения КГАСУ в области изучения эпоксидных смол
Достижения КГАСУ в области изучения эпоксидных смол Химический диктант. Свойства галогенов
Химический диктант. Свойства галогенов “РОЗЧИННИК”
“РОЗЧИННИК”  Кислород, его общая характеристика и свойства
Кислород, его общая характеристика и свойства Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии
Применение ЗДМ к равновесиям комплексообразования и их роль в аналитической химии Алкены «Бутен»
Алкены «Бутен» Биологическое окисление
Биологическое окисление Химическая кинетика
Химическая кинетика Биохимия центральной нервной системы
Биохимия центральной нервной системы Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров
Международная классификация моторных масел по вязкости в нормах J 300 SAE Ассоциации автомобильных инженеров Титриметрический анализ
Титриметрический анализ Молярная концентрация вещества в растворе
Молярная концентрация вещества в растворе Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини