Содержание
- 2. Ионные реакции – реакции протекающие между ионами в растворе.
- 3. Порядок составления ионных уравнений реакции. 1. Записывают молекулярное уравнение реакции 2. Определяют растворимость каждого из веществ
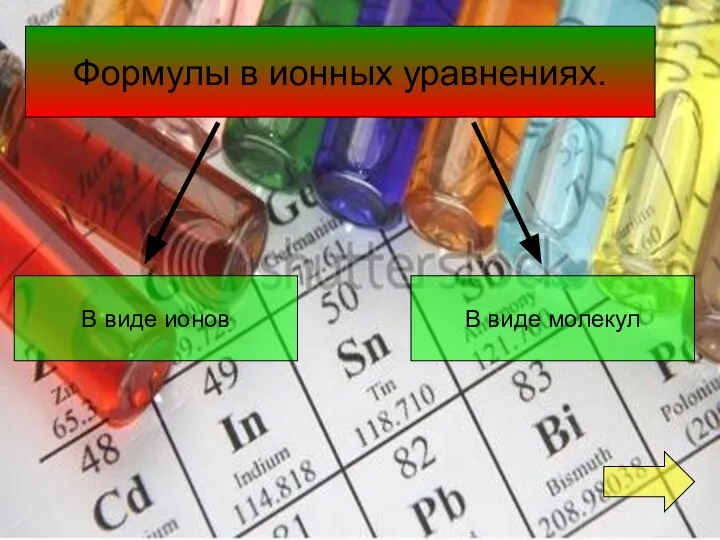
- 4. Формулы в ионных уравнениях. В виде ионов В виде молекул
- 5. Сильных кислот:(HClO4, H2SO4, HNO3, HI и др.); Сильных оснований:( щелочей - CsOH, NaOH, KOH, Ca(OH)2 и
- 6. Большая часть молекул слабых электролитов в растворе не диссоциирует на ионы Воды H2O; Слабых кислот (HNO2,
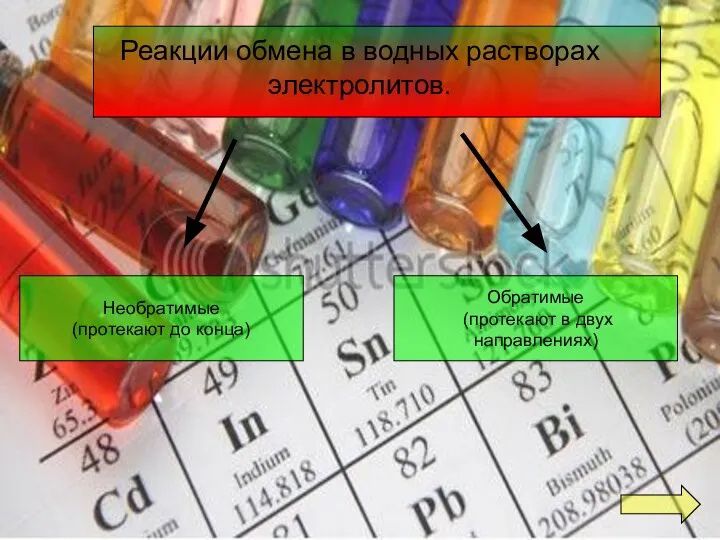
- 7. Реакции обмена в водных растворах электролитов. Необратимые (протекают до конца) Обратимые (протекают в двух направлениях)
- 8. Необратимыми являются реакции между сильными электролитами, в результате которых образуются: Реакции с образованием малорастворимых веществ, выпадающих
- 9. б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов) 2NaOH + H2SO4 = Na2SO4 + 2Н20
- 10. в) Реакции, протекающие с образованием газообразных веществ. NaOH + NH4CI = NaCl + NH3 ↑ +
- 11. Реакции обмена, если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, являются обратимыми, т.е. до
- 12. Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих
- 14. Скачать презентацию









 Презентация Серная кислота, свойства серной кислоты.
Презентация Серная кислота, свойства серной кислоты. Каучук. Строение и применение
Каучук. Строение и применение Мыс айналымы
Мыс айналымы Дисперсні системи
Дисперсні системи Презентація на тему: Каучук. Історія його відкриття
Презентація на тему: Каучук. Історія його відкриття  Мыло и мыловарение
Мыло и мыловарение Cellulase. Introduction (source)
Cellulase. Introduction (source) Роль химии в сохранении окружающей среды
Роль химии в сохранении окружающей среды Сложные реакции
Сложные реакции Метод Кнехта
Метод Кнехта Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Презентация по Химии "История спичек" - скачать смотреть
Презентация по Химии "История спичек" - скачать смотреть  Игра - викторина по химии для учащихся 8-х классов
Игра - викторина по химии для учащихся 8-х классов Презентация по Химии "Полимеры" - скачать смотреть
Презентация по Химии "Полимеры" - скачать смотреть  Липиды. Классификация липидов
Липиды. Классификация липидов Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Метаморфизм. Факторы метаморфизма
Метаморфизм. Факторы метаморфизма Обобщение и систематизация знаний по теме «Химическая связь и строение атома»
Обобщение и систематизация знаний по теме «Химическая связь и строение атома» Элементердің құрамына қарай бөлінуі
Элементердің құрамына қарай бөлінуі Основания как электролиты
Основания как электролиты Производные 8-замещенных хинолина
Производные 8-замещенных хинолина Алканы. Алкены. Алкины
Алканы. Алкены. Алкины Хлор и его соединения
Хлор и его соединения Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Электроотрицательность (ЭО). Ковалентная связь
Электроотрицательность (ЭО). Ковалентная связь Химический элемент. Изотопы. 11 класс
Химический элемент. Изотопы. 11 класс Техника безопасности для учащихся в кабинете химии.
Техника безопасности для учащихся в кабинете химии.  Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы