Содержание
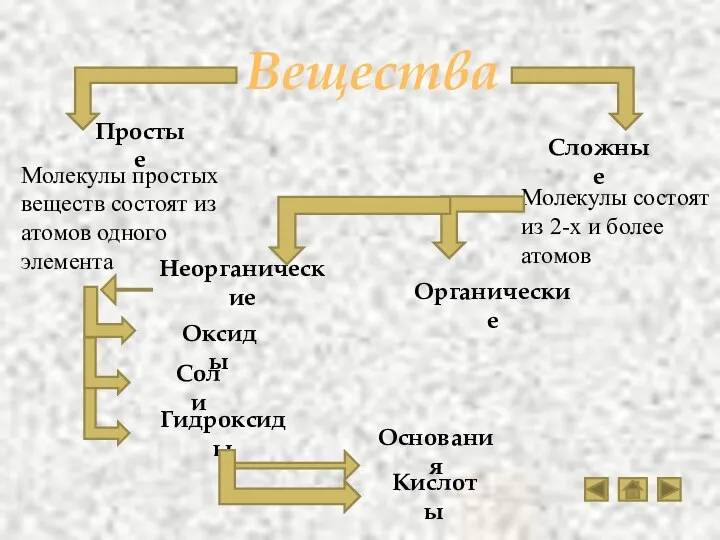
- 2. Вещества Простые Неорганические Органические Сложные Оксиды Соли Гидроксиды Кислоты Основания Молекулы простых веществ состоят из атомов
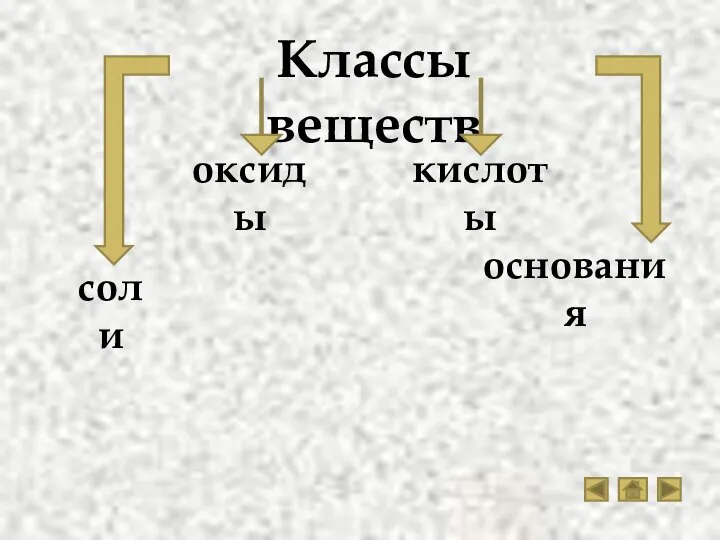
- 3. Классы веществ кислоты основания соли оксиды
- 4. Оксиды Солеобразующие Несолеобразующие это сложные вещества, состоящие из двух химических элементов, один из которых — кислород
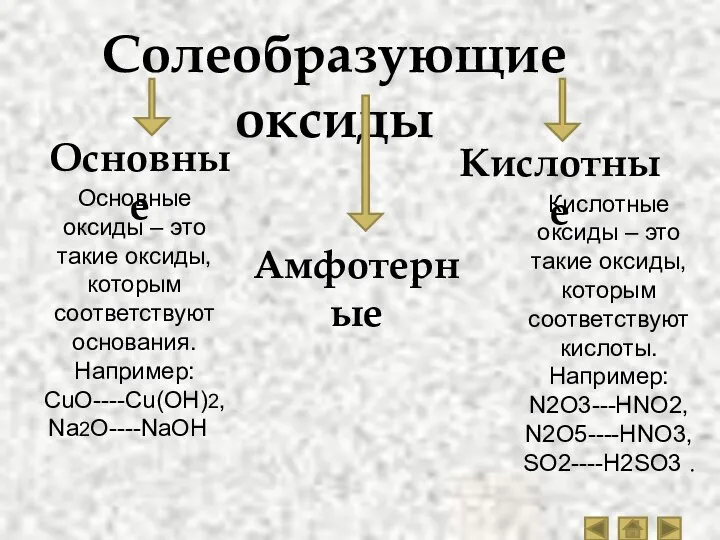
- 5. Солеобразующие оксиды Основные Амфотерные Кислотные Основные оксиды – это такие оксиды, которым соответствуют основания. Например: CuO----Cu(OH)2,
- 6. Основный оксид + кислота соль + вода. (реакция обмена) CuO + 2HNO3 = Cu(NO3)2 + H2O
- 7. Кислотный оксид + основание соль + вода. (реакция обмена) SO2 + 2NaOH = Na2SO3 + H2O
- 8. Кислоты Этот класс соединений широко распространен в природе. В желудке человека содержится сильная бескислородная одноосновная соляная
- 9. Кислоты – это сложные вещества, которые состоят из атомов водорода и кислотного остатка.
- 10. Химические свойства кислот Кислота + основание соль + вода. (реакция обмена) HСl + NaOH = NaCl
- 11. Кислота + металл соль + водород. (реакция замещения) 1)Металл должен находиться в ряду стандартных электронных потенциалов
- 12. Основания – это сложные вещества, в состав которых входят атомы металла, связанные с одной или несколькими
- 13. Основания Водные растворы щелочей, мылкие на ощупь, разъедают кожу, ткань, изменяют окраску индикаторов. Нерастворимые основания этими
- 14. Свойства оснований Типичные реакции оснований Основание + оксид неметалла соль + вода. ( реакция обмена) 2KOH
- 15. Разложение нерастворимых оснований Cu(OH)2 = CuO + H2O
- 16. Соли Соли – это сложные вещества, состоящие из атомов металлов и кислотных остатков.
- 17. Соли имеют самые различные цвета: а - медный купорос; б - дихромат калия; в - желтая
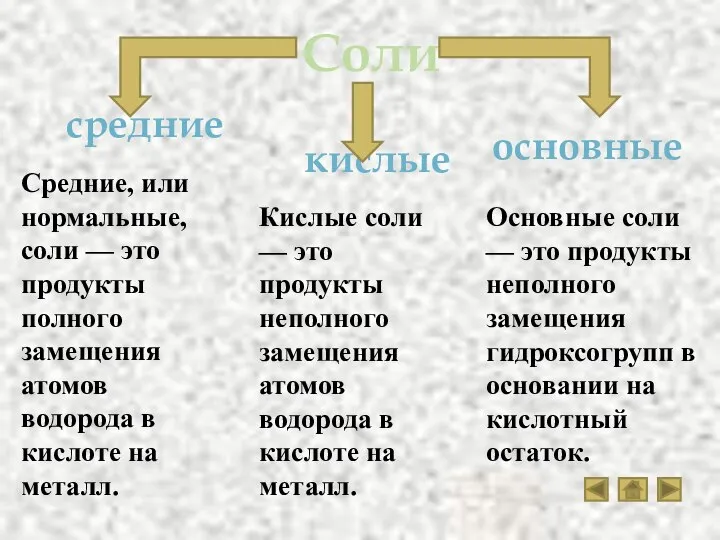
- 18. Соли кислые средние основные Средние, или нормальные, соли — это продукты полного замещения атомов водорода в
- 20. Скачать презентацию













 Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура
Термическая обработка. Превращения в стали при нагревании. Перегрев и пережег стали. Видманштеттовая струкрура Викторина по химии
Викторина по химии Алканы. Гомологический ряд
Алканы. Гомологический ряд Презентация по химии Химические уравнения Реакции обмена
Презентация по химии Химические уравнения Реакции обмена  Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Минералы и горные породы
Минералы и горные породы Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол
Сложные вещества Выполнил ученик 8 класса КГООУ «Железногорская санаторно-лесная школа» Москальчук Павел Учитель химии и биол История возникновения химии
История возникновения химии Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия
Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия  Урок в 8 классе
Урок в 8 классе Белки. Свойства белков. (Тема 2)
Белки. Свойства белков. (Тема 2) Металлы в живой приподе
Металлы в живой приподе Основы электрохимии
Основы электрохимии Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Химия нефти и газа
Химия нефти и газа Основные характеристики клеев
Основные характеристики клеев Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Профилактика интоксикаций медьсодержащими веществами
Профилактика интоксикаций медьсодержащими веществами Процесс электролиза
Процесс электролиза Гетероциклічні ароматичні сполуки
Гетероциклічні ароматичні сполуки Коррозия металлов
Коррозия металлов Кислоты. Классификация. Способы получения
Кислоты. Классификация. Способы получения Симметрия кристаллических решеток
Симметрия кристаллических решеток Липиды омыляемые и неомыляемые
Липиды омыляемые и неомыляемые Химия функциональных материалов. Адсорбционные материалы. Цеолиты
Химия функциональных материалов. Адсорбционные материалы. Цеолиты Классификация методов аналитической химии
Классификация методов аналитической химии Амфотерность. Амфотерные соединения
Амфотерность. Амфотерные соединения