Содержание
- 2. Теперь, давайте вспомним прошлую тему: Составьте уравнения возможных реакций: а) Аl + СI2 → б) Zn
- 3. Проблема! Могут ли металлы находиться в природе в свободном ( самородном ) состоянии, т.е. в виде
- 4. В природе металлы могут встречаться в виде простого вещества (самородки) или в виде сложного вещества: Благородные
- 6. В природе металлы встречаются чаще всего в виде соединений (металлических руд). А что такое металлические руды?
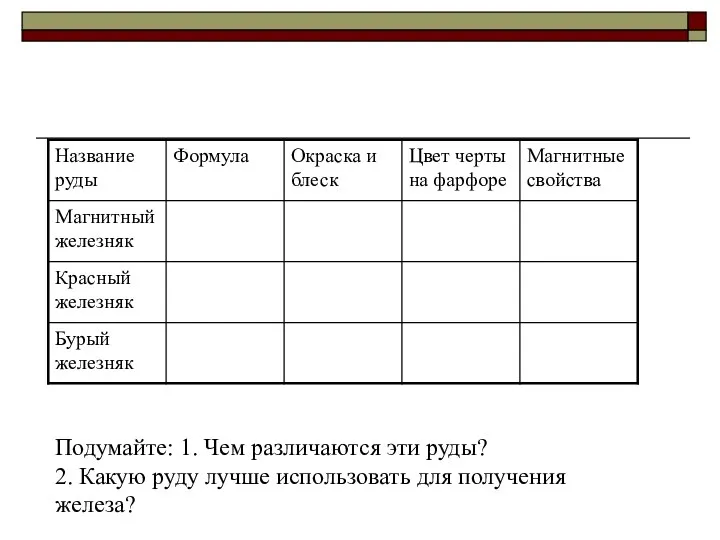
- 8. Подумайте: 1. Чем различаются эти руды? 2. Какую руду лучше использовать для получения железа?
- 9. Активные Ме (до Sn) встречаются только в виде соединений. Менее активные металлы могут встречаются и в
- 10. Вопрос! Как вы думаете, ребята, какой основной химический процесс лежит в основе получения металлов?
- 11. Получением металлов из их соединений занимается важнейшая отрасль промышленности, называемая металлургией.
- 12. Вопрос! Как добиться доступной формы для переработки?
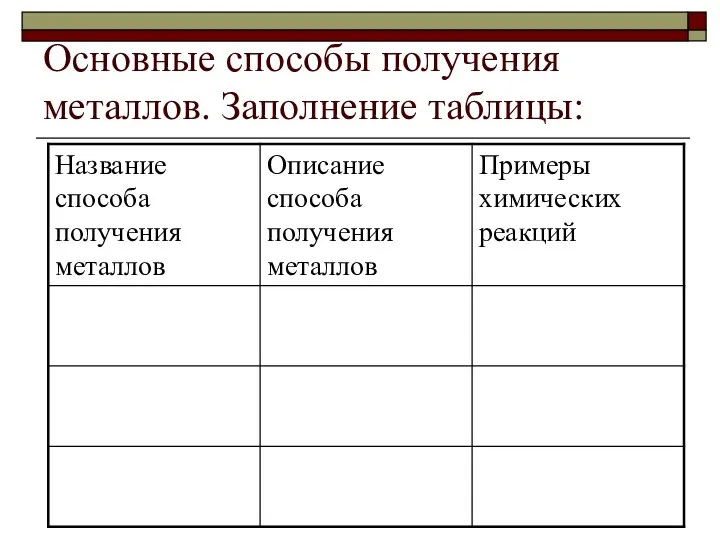
- 13. Основные способы получения металлов. Заполнение таблицы:
- 14. Пирометаллургия. восстановление металлов из их руд, происходящее при высоких температурах Обжиг в древности Обжиг (окисление): 2PbS
- 15. Гидрометаллургия Методы восстановления металлов из растворов их солей другими более активными металлами. Этим способом можно получить
- 16. Электрометаллургия получение Ме с помощью электрического тока (электролиз). Так получают активные легкие Ме: щелочные и щелочноземельные,
- 17. Термическое разложение соединений : так получают Ме в особо чистой форме : титан, цирконий, торий -
- 18. Закрепление темы: Предложите цепочку производства : Как можно получить из пирита FeS2 железо и серную кислоту?
- 20. Скачать презентацию















 Электролитическая диссоциация воды
Электролитическая диссоциация воды Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Ионы и ионная химическая связь" - скачать смотреть  Неметаллы. Сера. 9 класс
Неметаллы. Сера. 9 класс Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Алюминий и его соединения
Алюминий и его соединения ГИДРОЛИЗ СОЛЕЙ 9 класс
ГИДРОЛИЗ СОЛЕЙ 9 класс  Презентация по Химии "Сера" - скачать смотреть
Презентация по Химии "Сера" - скачать смотреть  Классификация оснований
Классификация оснований Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Ц
Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Ц Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги
Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги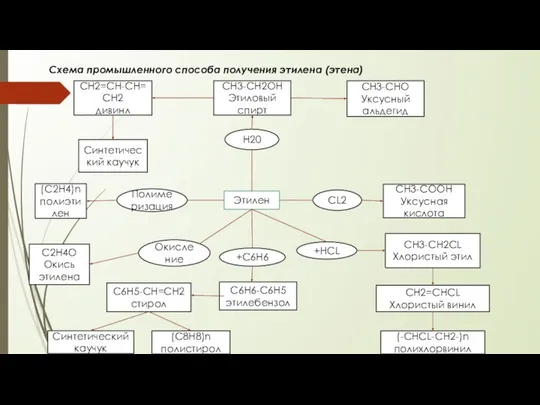 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена) Введение в биохимию. Строение и функции белков (часть 1)
Введение в биохимию. Строение и функции белков (часть 1) Гидролиз солей
Гидролиз солей Области применения спиртов
Области применения спиртов Періодична система
Періодична система  Алка́ны
Алка́ны Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона
Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона  Изделия из неорганических материалов - керамика
Изделия из неорганических материалов - керамика Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Биохимия печени и крови
Биохимия печени и крови Молекулярные свойства жидкостей
Молекулярные свойства жидкостей Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Презентация по Химии "Всё о кремнии" - скачать смотреть
Презентация по Химии "Всё о кремнии" - скачать смотреть  Растворы
Растворы Аллотропные модификации углерода
Аллотропные модификации углерода Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть
Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть  Окислительно-восстановительные реакции (лекция 6)
Окислительно-восстановительные реакции (лекция 6)