Содержание
- 2. план Автопротолиз воды. Понятие рН растворов. Индикаторы. Гидролиз солей. Типы гидролиза.
- 3. Электролитическая диссоциация воды Вода типичный амфолит: H2O ↔ H+ + OH- Автопротолиз – реакции, в которых
- 4. KВ = [H+]·[OH-] = 1·10-14 при 25 ° С Произведение равновесных концентраций ионов водорода и гидроксид-ионов
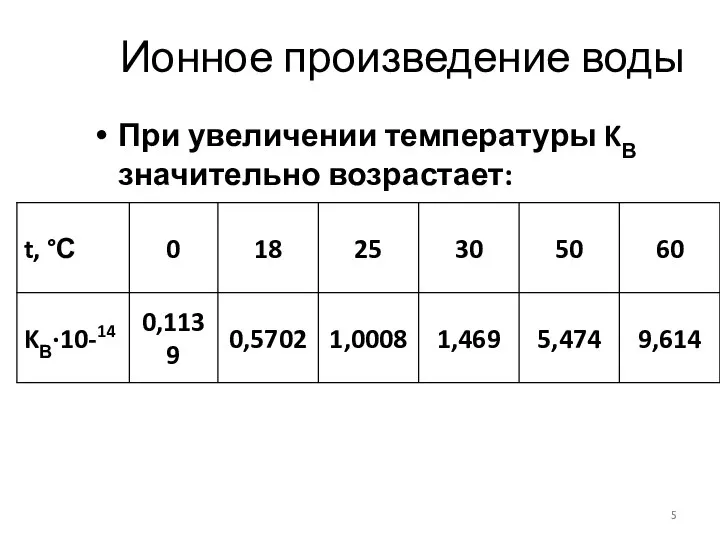
- 5. Ионное произведение воды При увеличении температуры KВ значительно возрастает:
- 6. Ионное произведение воды KВ = [H+]·[OH-] = 10-14 при 25 ° С [H+] = [OH-] =
- 7. Водородный показатель рН Для удобства вместо значений [H+] используют водородный показатель pH. Водорoдный показатель есть отрицательный
- 8. По аналогии используют гидроксильный показатель (pOH): pOH = -lg[OH-] Поскольку при 25 °С KВ = [H+]·[OH-]
- 9. Водородный показатель рН Величина pH используется как мера кислотности, нейтральности или щёлочности водных растворов: в кислой
- 10. Расчет равновесной концентрации [Н+] и [ОН-] 1.Пример, концентрация ионов Н+ в 0,001М р-ре НСl равна [Н+]
- 11. Индикаторы Кислотно-основные индикаторы - слабые органические кислоты HInd или основания IndOH, подвергающиеся ионизации в водных растворах,
- 12. Уравнение диссоциации кислотных индикаторов: НInd + Н2О ↔ Н3О + + Ind - Донор протона Окраска
- 13. Индикаторы Интервал индикатора - область значений рН, в которой становится видимым изменение окраски индиатора. Обычно стараются
- 14. Универсальный индикатор Широко применяются смеси индикаторов, позволяющие определить значение рН растворов в большом диапазоне концентраций (1-10;
- 15. рН-метры Наиболее точным методом определения pH является потенциометрический, основанный на измерении зависимости потенциала электрода от концентрации
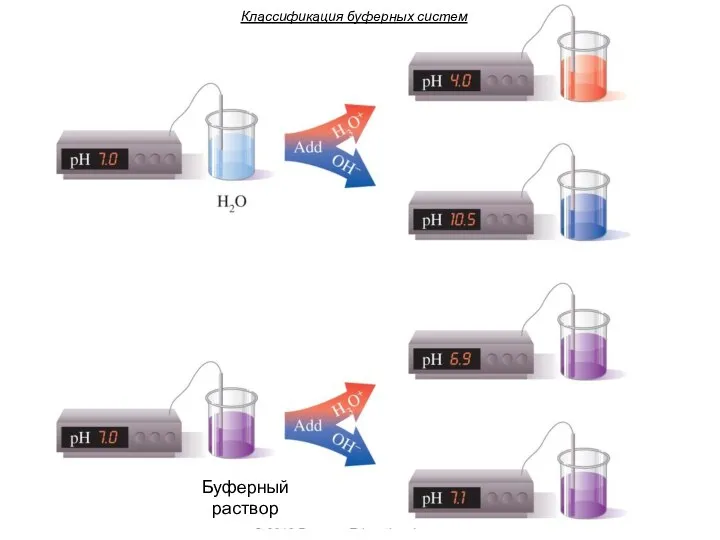
- 16. Буферными системами (буферами) называют растворы, обладающие свойством достаточно стойко сохранять постоянство концентрации ионов водорода как при
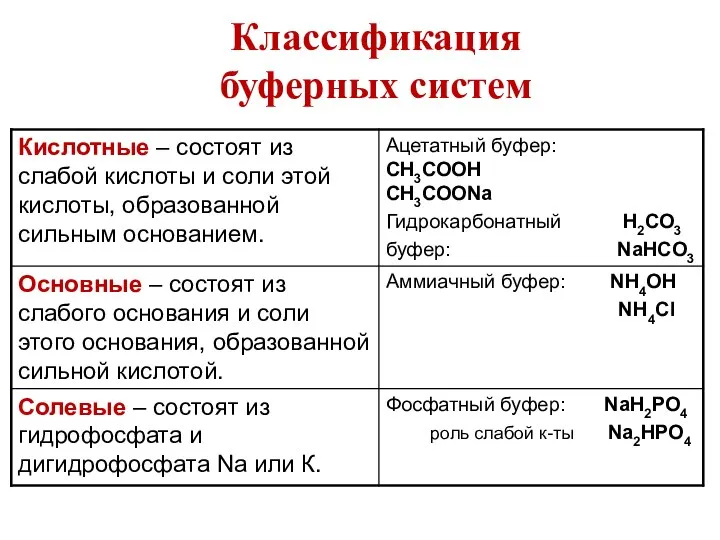
- 17. Классификация буферных систем Буферный раствор
- 18. Классификация буферных систем
- 19. Гидролиз солей При растворении солей в воде происходит не только диссоциация на ионы и гидратация этих
- 20. Гидролиз солей – это взаимодействие солей с водой В результате гидролиза соли в растворе появляется некоторое
- 21. Гидролизу подвергаются: Катион слабого основания Al3+; Fe3+; Bi3+ и др. Анион слабой кислоты CO32-; SO32–; NO2–;
- 22. Гидролизу НЕ подвергаются: Катион сильного основания Na+; Ca2+; K+ и др. Анион сильной кислоты Cl–; SO42–;
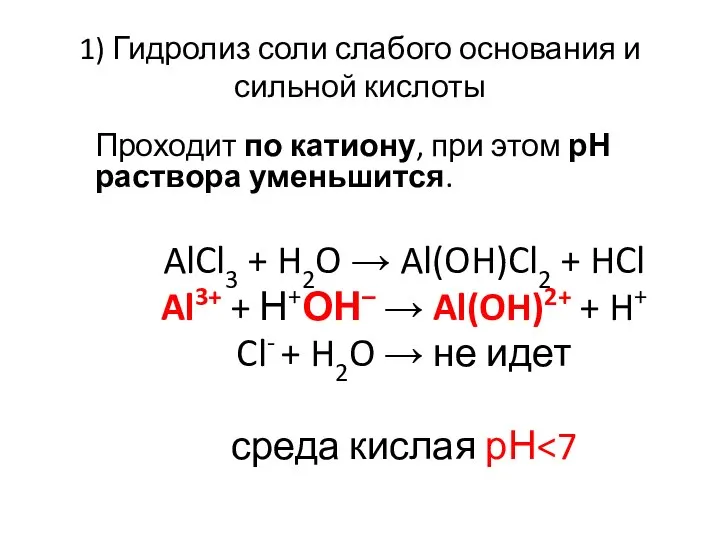
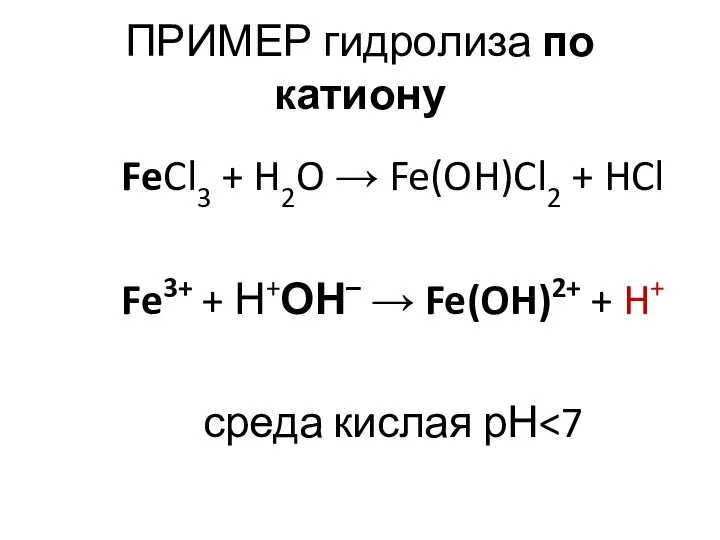
- 23. 1) Гидролиз соли слабого основания и сильной кислоты Проходит по катиону, при этом рН раствора уменьшится.
- 24. ПРИМЕР гидролиза по катиону FeCl3 + H2O → Fe(OH)Cl2 + HCl Fe3+ + Н+ОН– → Fe(OH)2+
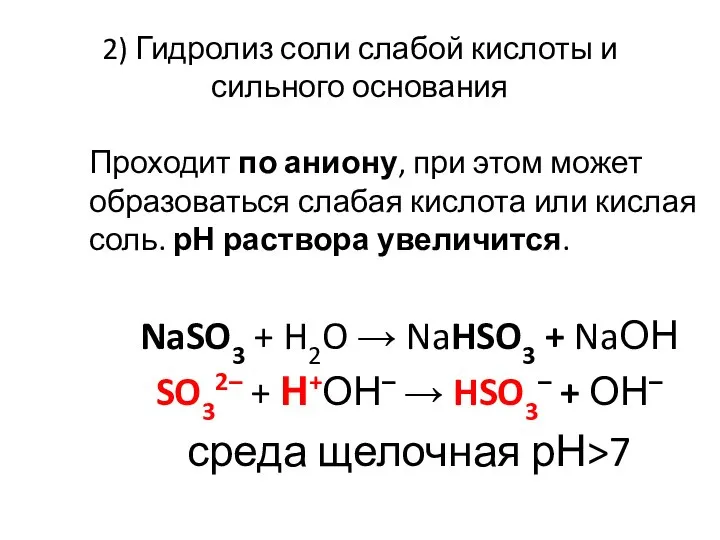
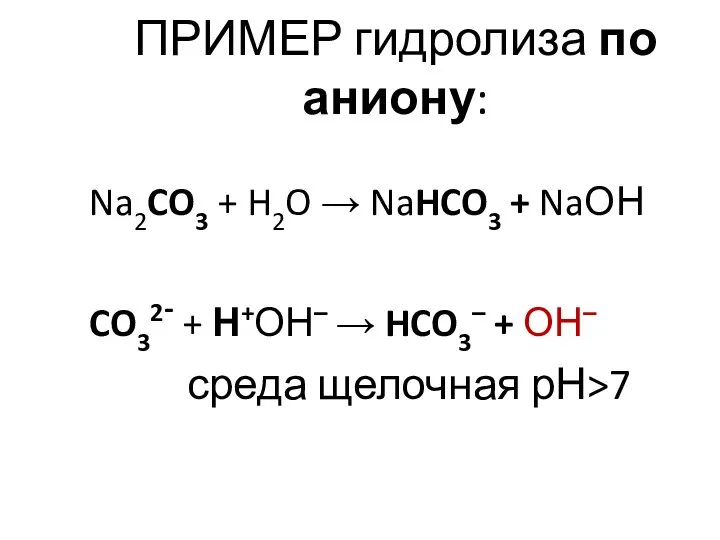
- 25. 2) Гидролиз соли слабой кислоты и сильного основания Проходит по аниону, при этом может образоваться слабая
- 26. ПРИМЕР гидролиза по аниону: Na2CO3 + H2O → NaHCO3 + NaОН CO32- + Н+ОН– → HCO3–
- 27. 3) Гидролиз соли слабой кислоты и слабого основания Проходит полностью; рН 7 : Al2(SO3)3 + 6H2O
- 28. Гидролиз соли слабой кислоты и слабого основания Реакция в этом случае идет до конца, так как
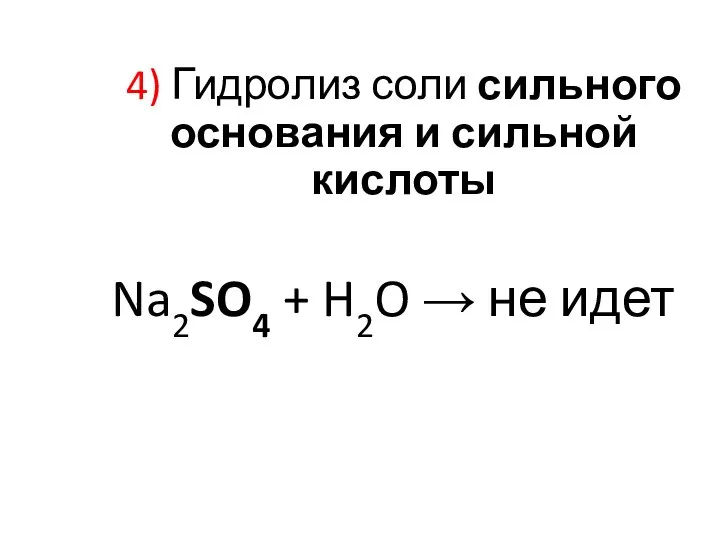
- 29. 4) Гидролиз соли сильного основания и сильной кислоты Na2SO4 + H2O → не идет
- 30. Закономерности гидролиза разбавленных растворов солей: Протекает: Гидролиз соли слабого основания и сильной кислоты Гидролиз соли слабой
- 31. Определение среды в растворах солей Индикаторы в разных средах https://goo.gl/gkh7ip Определение среды в растворах солей https://goo.gl/eSj2XS
- 32. Количественные характеристики гидролиза Степень гидролиза αг (доля гидролизованных единиц) Константа гидролиза - Кг.
- 33. Степень гидролиза Степень гидролиза αг – показатель глубины протекания гидролиза На степень гидролиза влияют: природа соли
- 34. Константа гидролиза Кг характеризует способность соли подвергаться гидролизу: чем больше константа гидролиза, тем сильнее протекает гидролиз.
- 36. Скачать презентацию


![KВ = [H+]·[OH-] = 1·10-14 при 25 ° С Произведение равновесных](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396039/slide-3.jpg)
![Ионное произведение воды KВ = [H+]·[OH-] = 10-14 при 25 °](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396039/slide-5.jpg)
![Водородный показатель рН Для удобства вместо значений [H+] используют водородный показатель](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396039/slide-6.jpg)
![По аналогии используют гидроксильный показатель (pOH): pOH = -lg[OH-] Поскольку при](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396039/slide-7.jpg)

![Расчет равновесной концентрации [Н+] и [ОН-] 1.Пример, концентрация ионов Н+ в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1396039/slide-9.jpg)

















 Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Кислородные соединения азота. Азотная кислота
Кислородные соединения азота. Азотная кислота Основания LiOH - гидроксид лития
Основания LiOH - гидроксид лития What is enthalpy?
What is enthalpy?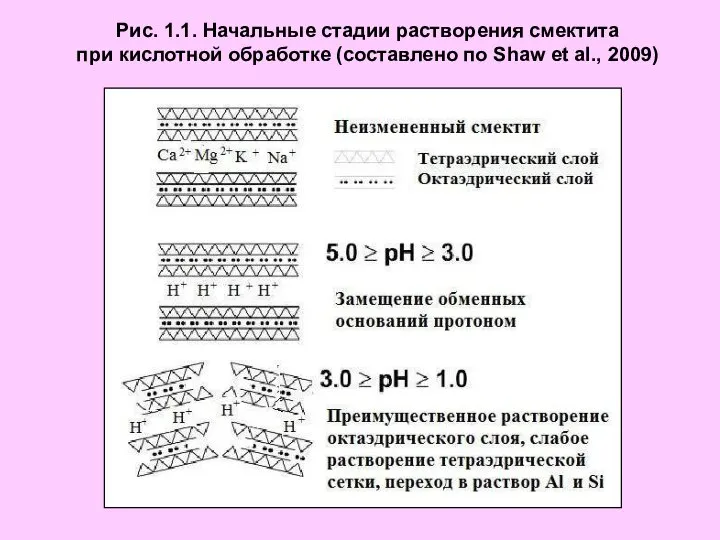 Начальные стадии растворения смектита при кислотной обработке
Начальные стадии растворения смектита при кислотной обработке Определение формулы вещества по известной общей формуле и массовой доли одного из элементов
Определение формулы вещества по известной общей формуле и массовой доли одного из элементов Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю.
лекарства Урок-защита проектов Разработала учитель химии МОУ «Гимназия №1» г. Саратова Шишкина И.Ю. Энергетика и направление химических реакций
Энергетика и направление химических реакций Олійно-жирова промисловість Підготувала учениця 11-Б класу Халімон Заріна
Олійно-жирова промисловість Підготувала учениця 11-Б класу Халімон Заріна  Пластмасса
Пластмасса Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного
Решение задач на определение массовой (объемной) доли выхода продукта реакции от теоретически возможного Химический состав фракций нефти
Химический состав фракций нефти Утилизация отходов московского МСЗ №2
Утилизация отходов московского МСЗ №2 Анализ стадии технологического процесса производства гранулотола
Анализ стадии технологического процесса производства гранулотола Поверхностно-активные вещества (ПАВ)
Поверхностно-активные вещества (ПАВ) Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Естественные и искусственные стекла
Естественные и искусственные стекла Химическое равновесие. Термодинамика химического равновесия
Химическое равновесие. Термодинамика химического равновесия Спирты: свойства, получение, применение
Спирты: свойства, получение, применение Хлор 11 класс - Презентация
Хлор 11 класс - Презентация Строение и свойства неорганических веществ. Кислоты и основания
Строение и свойства неорганических веществ. Кислоты и основания Химические элементы
Химические элементы Презентация по Химии "Соединения кальция" - скачать смотреть
Презентация по Химии "Соединения кальция" - скачать смотреть  Актуалізація опорних знань учнів і мотивація навчальної діяльносты. Хімія 7 клас
Актуалізація опорних знань учнів і мотивація навчальної діяльносты. Хімія 7 клас Щелочные металлы
Щелочные металлы Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Природные источники углеводородов
Природные источники углеводородов