Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Ц
Содержание
- 2. Цель работы: Провести реакции, характеризующие общие химические свойства солей.
- 3. 1. Взаимодействие солей с щелочами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), спиртовка, спички,
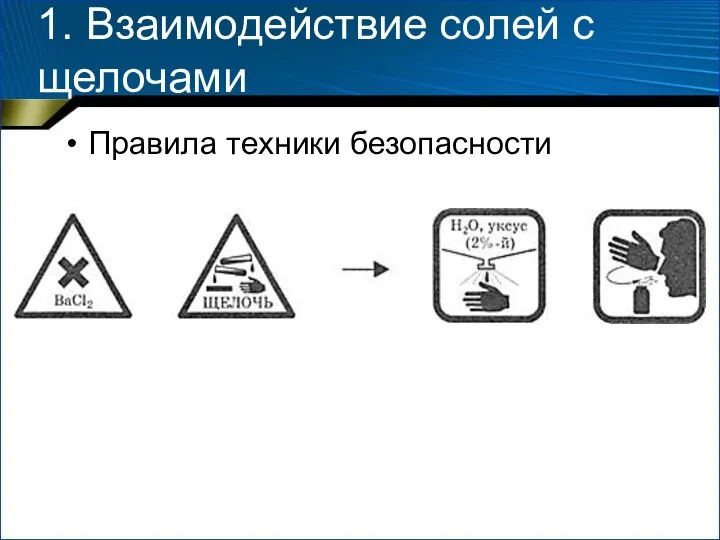
- 4. 1. Взаимодействие солей с щелочами Правила техники безопасности
- 5. 1. Взаимодействие солей с щелочами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно
- 6. 1. Взаимодействие солей с щелочами Fe2(SO4)3 NaOH KOH (NH4)2SO4 KOH Ba(NO3)2 NaOH + Fe2(SO4)3 =Na2SO4 +Fe(OH)3
- 7. 1. Взаимодействие солей с щелочами 4. Ответьте на вопрос: при каких условиях соли взаимодействуют с щелочами?
- 8. 2. Взаимодействие солей с кислотами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), растворы силиката
- 9. 2. Взаимодействие солей с кислотами Правила техники безопасности
- 10. 2. Взаимодействие солей с кислотами Содержание и порядок выполнения опыта 1. В трех пробирках слейте попарно
- 11. 2. Взаимодействие солей с кислотами
- 12. 2. Взаимодействие солей с кислотами 3. Ответьте на вопрос: при каких условиях соли взаимодействуют с кислотами?
- 13. 3. Взаимодействие солей с солями Оборудование и реактивы: штатив для пробирок, пробирки (2 шт.); растворы хлорида
- 14. 3. Взаимодействие солей с солями Правила техники безопасности
- 15. 3. Взаимодействие солей с солями Содержание и порядок выполнения опыта 1. Проведите качественные реакции, подтверждающие состав
- 16. 3. Взаимодействие солей с солями
- 17. 4. Взаимодействие растворов солей с металлами Оборудование и реактивы: штатив для пробирок, пробирки (3 шт.), пинцет;
- 18. 4. Взаимодействие растворов солей с металлами Правила техники безопасности
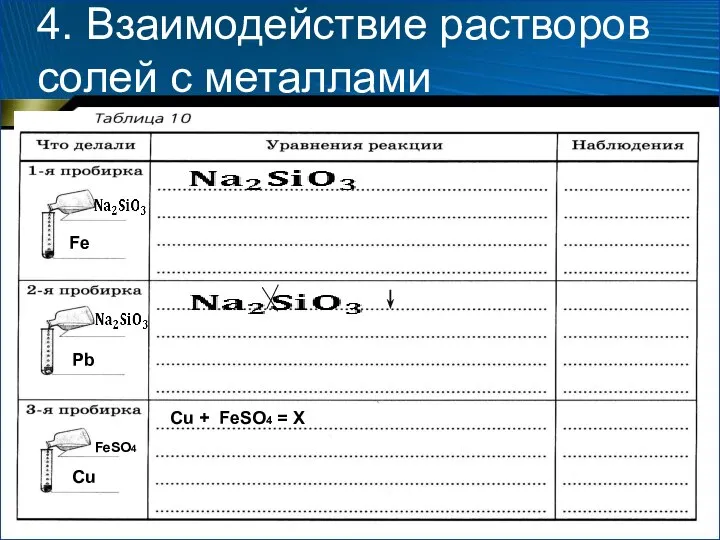
- 19. 4. Взаимодействие растворов солей с металлами Содержание и порядок выполнения опыта 1. Возьмите три пробирки. В
- 20. 4. Взаимодействие растворов солей с металлами Fe Pb Cu FeSO4 Cu + FeSO4 = X
- 21. 4. Взаимодействие растворов солей с металлами 6. Сделайте вывод о взаимодействии растворов солей с металлами, вставив
- 22. Задание на дом: Прочитать §41, Выполнить упр. 1—5, Повторить §§ 38 – 40 , Подготовиться к
- 24. Скачать презентацию



















 Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Органическая химия. Алифатические углеводороды
Органическая химия. Алифатические углеводороды Получение и приминение этилена
Получение и приминение этилена Презентация по Химии "Почему золото блестит?" - скачать смотреть
Презентация по Химии "Почему золото блестит?" - скачать смотреть  Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач.
Химия элементов. Лекция 6 Комплексные соединения: типы и классификация. Методы получения и разрушения. Решение задач. 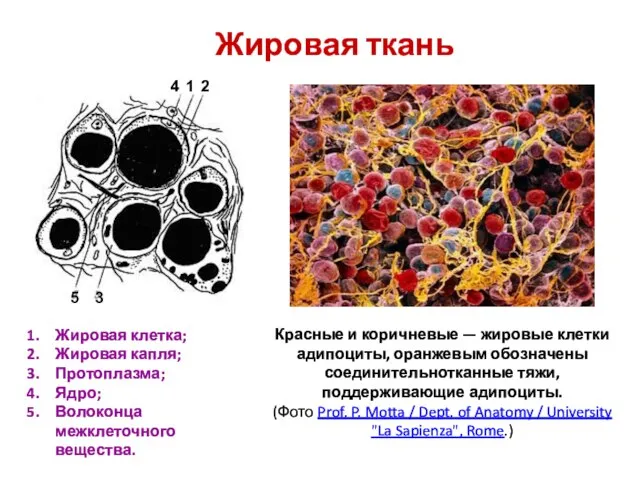 Жировая ткань
Жировая ткань Зависимость константы скорости химической реакции от температуры
Зависимость константы скорости химической реакции от температуры История микроскопа
История микроскопа  Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов
Изучение влияния азотсодержащих удобрений на качество продукции по содержанию нитратов Клиническая фармакология антибактериальных препаратов
Клиническая фармакология антибактериальных препаратов Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Химический элемент натрий
Химический элемент натрий Ковалентная химическая связь
Ковалентная химическая связь Транс-жиры
Транс-жиры Обмен липидов
Обмен липидов Метаболизм углеводов
Метаболизм углеводов Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В.
Добрый день! Учитель химии МКОУ СОШ №2 им.Ж.И. Алферова г.Туринска Кузнецова Т.В. Роль минеральных веществ в организме человека
Роль минеральных веществ в организме человека Водородная связь
Водородная связь Разделение смесей
Разделение смесей Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват
Подготовка к ЕГЭ: КИСЛОРОДСОДЕРЖАЩИЕ. УГЛЕВОДЫ. Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразоват Дисперсные системы и растворы
Дисперсные системы и растворы Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В.
Периодическая система химических элементов Д.И.Менделеева Учитель химии МБОУ СОШ №37 г. Шахты Ростовской области Вабищевич М.В. Mineralogy. Chemical composition and properties of minerals
Mineralogy. Chemical composition and properties of minerals Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования Соли. Названия и классификация солей
Соли. Названия и классификация солей