Повторение и обобщение. Зависимость свойств веществ от типа химической связи и кристаллической решетки
Содержание
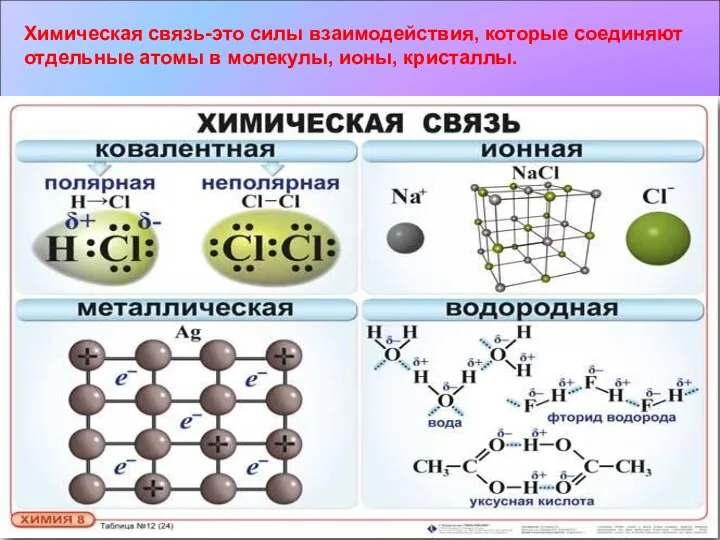
- 2. Химическая связь-это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
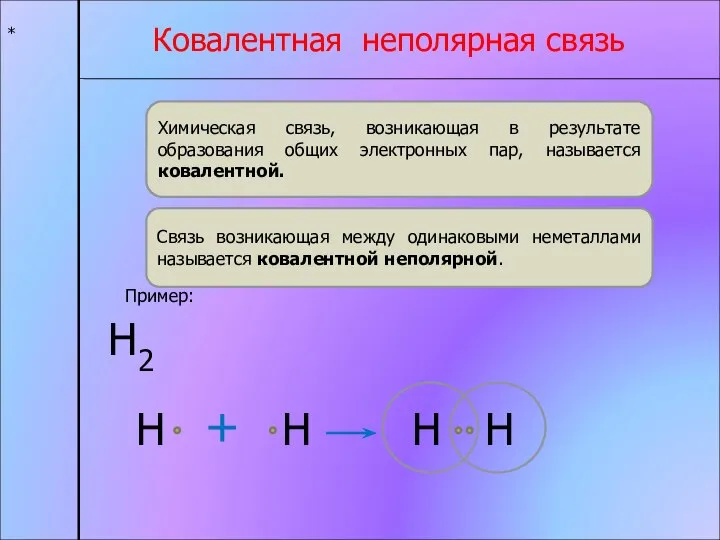
- 3. * Ковалентная неполярная связь Химическая связь, возникающая в результате образования общих электронных пар, называется ковалентной. Связь
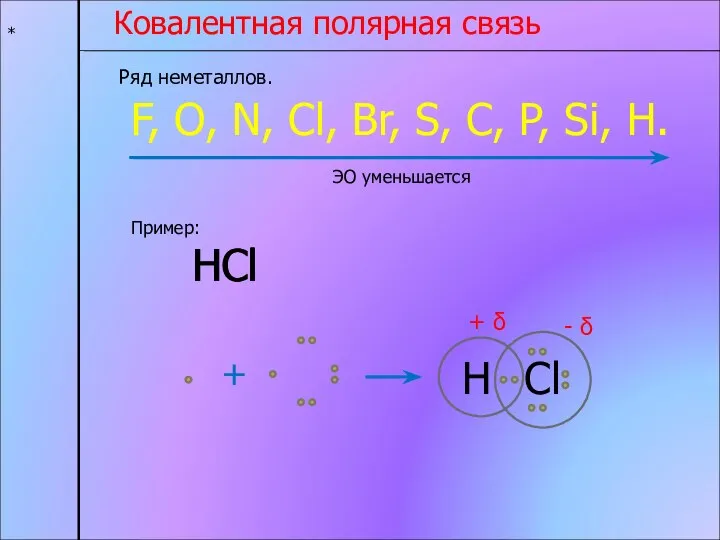
- 4. * Ковалентная полярная связь Ряд неметаллов. F, O, N, Cl, Br, S, C, P, Si, H.
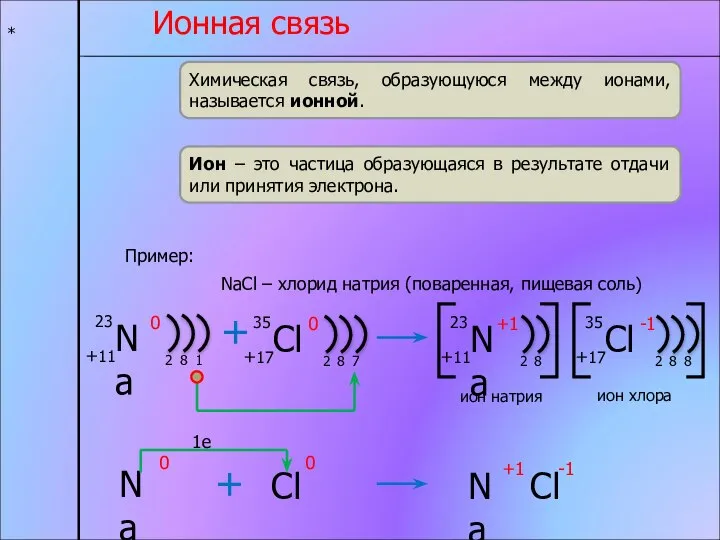
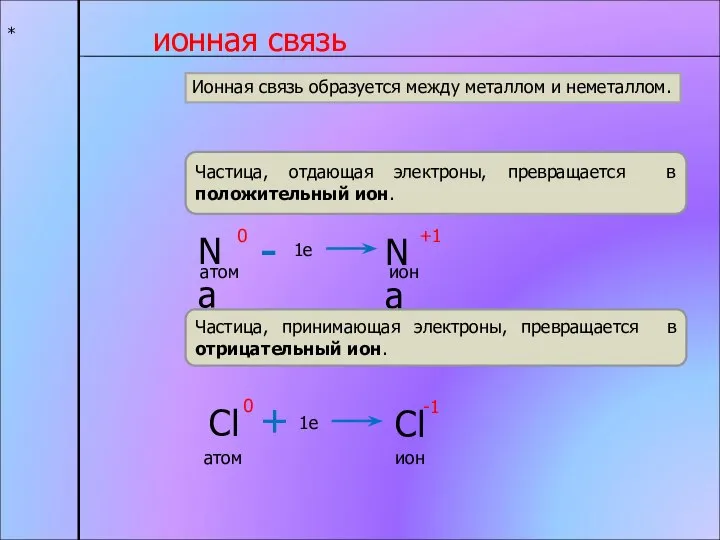
- 5. * Ионная связь Химическая связь, образующуюся между ионами, называется ионной. Ион – это частица образующаяся в
- 6. * ионная связь Частица, отдающая электроны, превращается в положительный ион. Частица, принимающая электроны, превращается в отрицательный
- 7. * Металлическая связь Связь в металлах и сплавах между атом – ионами посредством обобществленных электронов называют
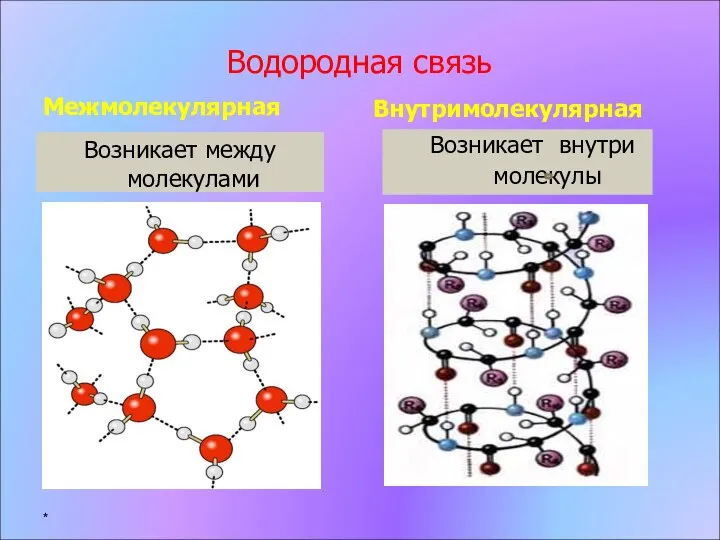
- 8. Водородная связь Межмолекулярная Возникает между молекулами Внутримолекулярная Возникает внутри молекулы *
- 9. Сравнение различных видов связи Сходство: любой вид связи образуется за счет перехода электронов Различие: способ образования
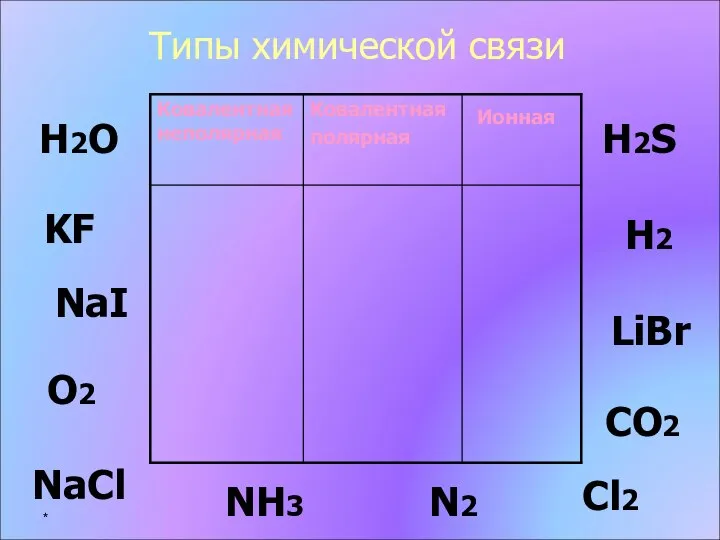
- 10. Типы химической связи KF H2 H2O Н2S О2 NH3 N2 LiBr NaCl CO2 Cl2 NaI *
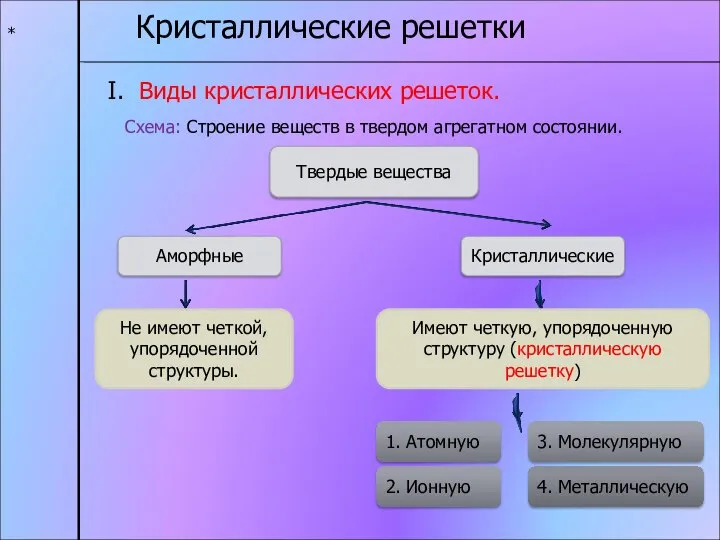
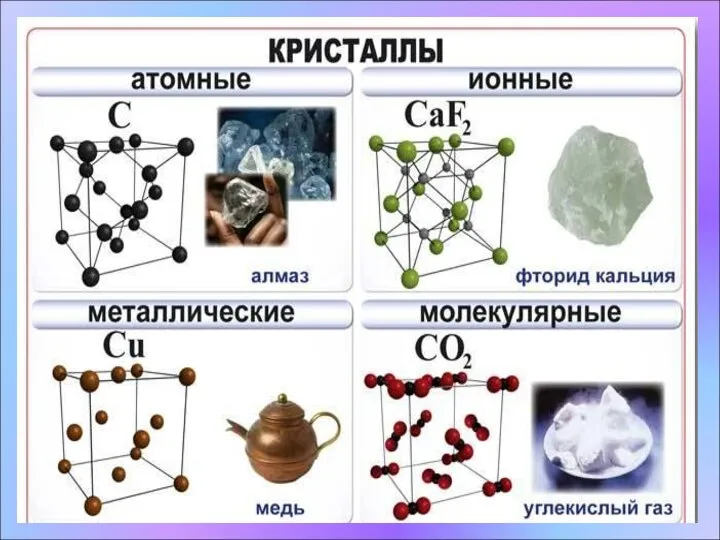
- 11. * Кристаллические решетки I. Виды кристаллических решеток. Схема: Строение веществ в твердом агрегатном состоянии. Твердые вещества
- 12. *
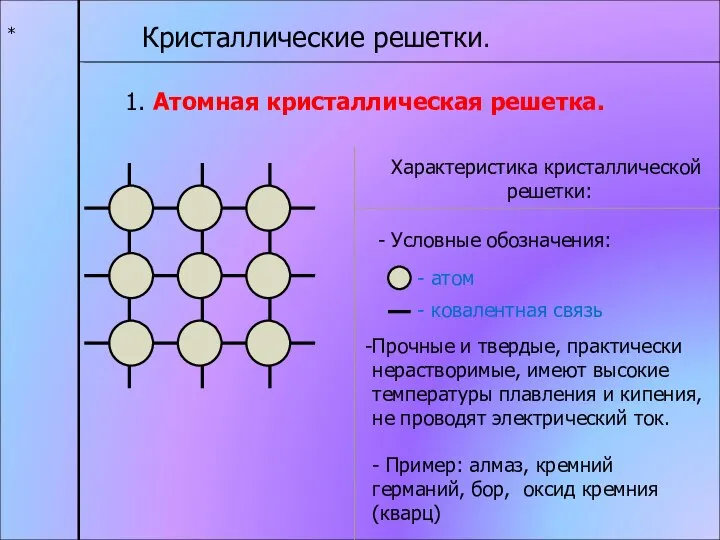
- 13. * Кристаллические решетки. 1. Атомная кристаллическая решетка. Характеристика кристаллической решетки: - атом - ковалентная связь Прочные
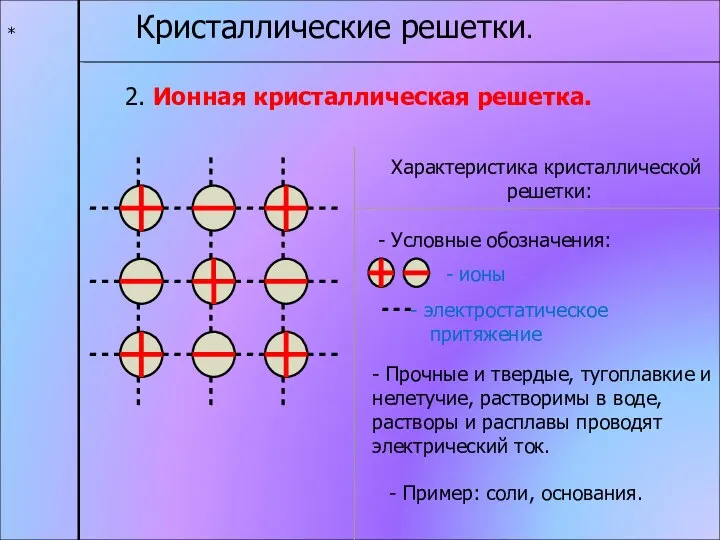
- 14. * Кристаллические решетки. 2. Ионная кристаллическая решетка. Характеристика кристаллической решетки: - ионы электростатическое притяжение - Прочные
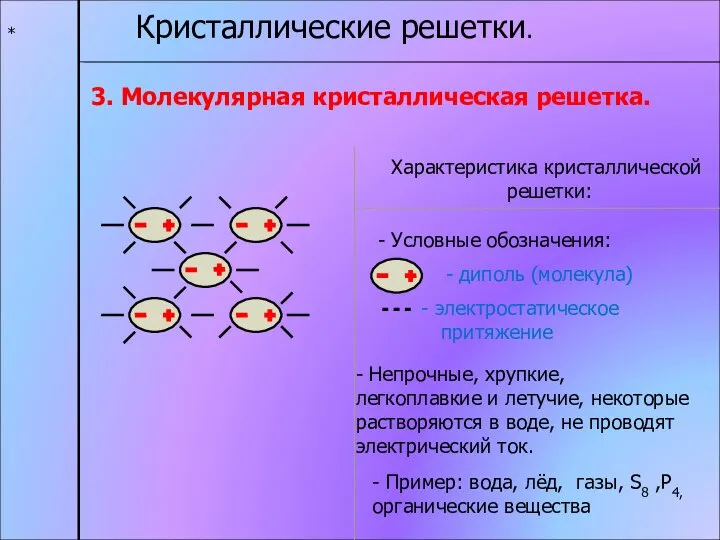
- 15. * Кристаллические решетки. 3. Молекулярная кристаллическая решетка. Характеристика кристаллической решетки: - диполь (молекула) электростатическое притяжение -
- 17. Скачать презентацию


 Презентация по Химии "Кислоты" - скачать смотреть
Презентация по Химии "Кислоты" - скачать смотреть  Метод кислотноосновного титрования (Метод нейтрализации)
Метод кислотноосновного титрования (Метод нейтрализации) Кислотно-основное титрование
Кислотно-основное титрование Алюминий и его соединения
Алюминий и его соединения Коррозия металлов
Коррозия металлов Гормоны, биологически активные вещества органической природы
Гормоны, биологически активные вещества органической природы Гігієна води. Лекція 6
Гігієна води. Лекція 6 Задачи на определение массовой доли веществ в смесях
Задачи на определение массовой доли веществ в смесях Счастливы вместе с химией
Счастливы вместе с химией Строение атома
Строение атома Кобаламины(витамин В12) антианемический
Кобаламины(витамин В12) антианемический Простые вещества – металлы и неметаллы
Простые вещества – металлы и неметаллы Комплексные соединения
Комплексные соединения Процессы и аппараты химической технологии
Процессы и аппараты химической технологии Синтез 2,4-диметил-3,5-ди (этоксикар-бонил) пиррол
Синтез 2,4-диметил-3,5-ди (этоксикар-бонил) пиррол Презентация по Химии "Краткая история развития химических знаний" - скачать смотреть
Презентация по Химии "Краткая история развития химических знаний" - скачать смотреть  Составление уравнений ОВР
Составление уравнений ОВР Свойства растворов. Протолитическая теория кислот и оснований Бренстеда-Лоури
Свойства растворов. Протолитическая теория кислот и оснований Бренстеда-Лоури Азот и его соединения
Азот и его соединения Спирты: классификация, изомерия, номенклатура
Спирты: классификация, изомерия, номенклатура АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ.
АЛКЕНЫ – НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. Физико-химические методы исследования и техника лабораторных работ
Физико-химические методы исследования и техника лабораторных работ Нанотехнологии в химии
Нанотехнологии в химии  Арбузный снег. Предположения
Арбузный снег. Предположения Моторные масла. Свойства, состав, классификация
Моторные масла. Свойства, состав, классификация Основы строения органических соединений
Основы строения органических соединений Геохимические показатели техногенеза
Геохимические показатели техногенеза Обмен веществ и энергии в клетке
Обмен веществ и энергии в клетке