Предмет органічної хімії Урок в 9 му класі КЗ Верхівцевського НВК учителя хімії Кукси Наталії Миколаївни.
Содержание
- 2. Мета: Дати загальну характеристику з основних питань: Органічні речовини Походження речовин Найважливіші характеристики ОС Основні положення
- 3. Блок №1 Цілі: Органічні речовини Походження речовин Найважливіші характеристики ОС Основні положення теорії будови хімічних сполук.
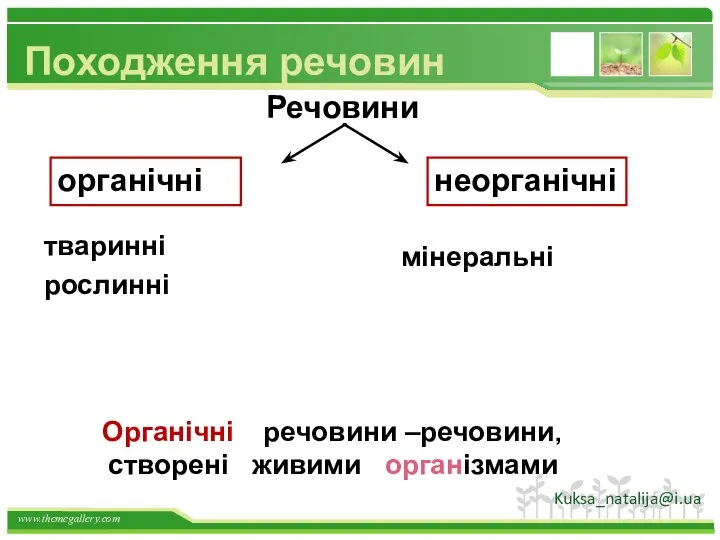
- 4. Походження речовин Речовини рослинні мінеральні органічні неорганічні речовини –речовини, створені живими організмами Органічні тваринні Kuksa_natalija@i.ua
- 5. Найважливіші характеристики ОС 1) Багатоманітністьсть ( близько 27 млн.) 2)До складу обов’язково входять (С) і (Н)
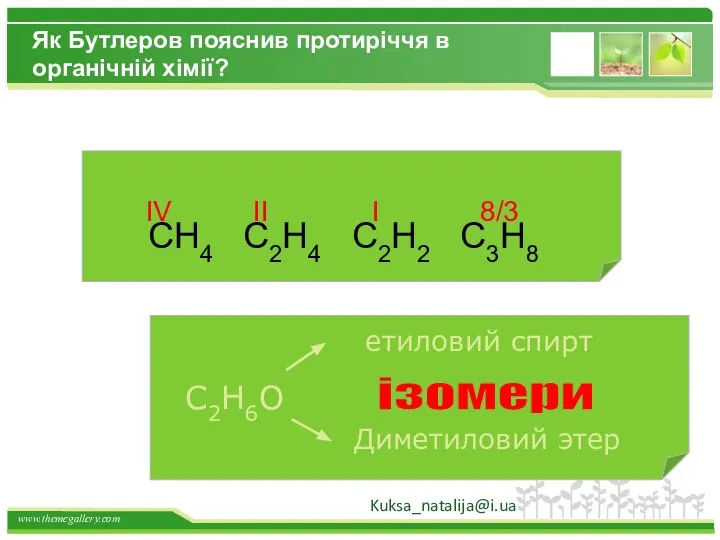
- 6. Як Бутлеров пояснив протиріччя в органічній хімії? CH4 C2H4 C2H2 C3H8 IV II I 8/3 Kuksa_natalija@i.ua
- 7. Бутлеров Олександр Михайлович (1828-1886) Російський хімік, академік Петербурзької АН (з 1874 р.). Творець теорії хімічної будови
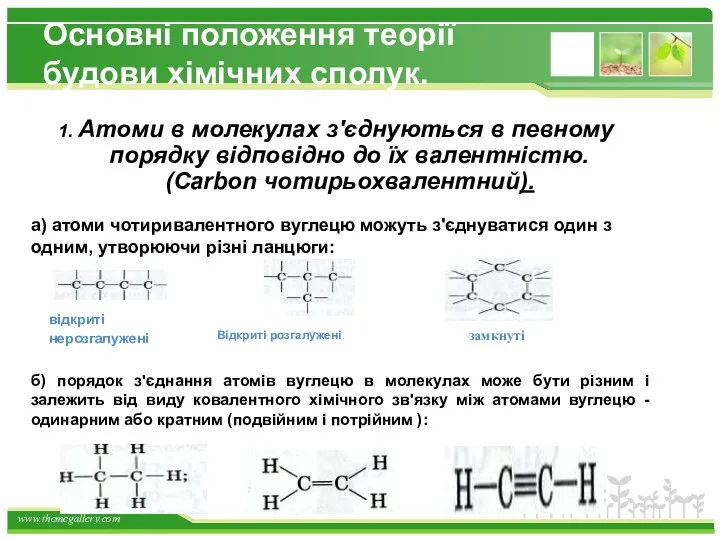
- 8. Основні положення теорії будови хімічних сполук. 1. Атоми в молекулах з'єднуються в певному порядку відповідно до
- 9. Друге положення Властивості речовин залежать не тільки від їх якісного і кількісного складу, але і від
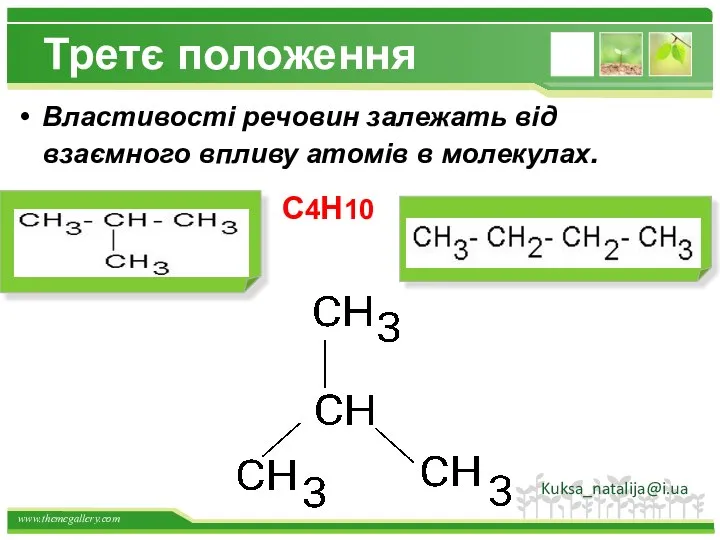
- 10. Третє положення Властивості речовин залежать від взаємного впливу атомів в молекулах. С4Н10 Kuksa_natalija@i.ua
- 11. Класифікація ОС Природні – утворені природнім шляхом, без втручання людини. мед нафта бавовна Kuksa_natalija@i.ua
- 12. Класифікація ОС Штучні – створює людина в лаборатортних умовах, схожі на природні речовини. хутро бензин шовк
- 13. Класифікація ОС Синтетичні –створює людина в лаборатортних умовах, подібних речовин в природі немає пральні порошки ліки
- 14. Вуглеводні Цілі: Классифікація вуглеводнів Види сполучень атомів Карбону між собою Структурні формули органічних речовин Будова молекул
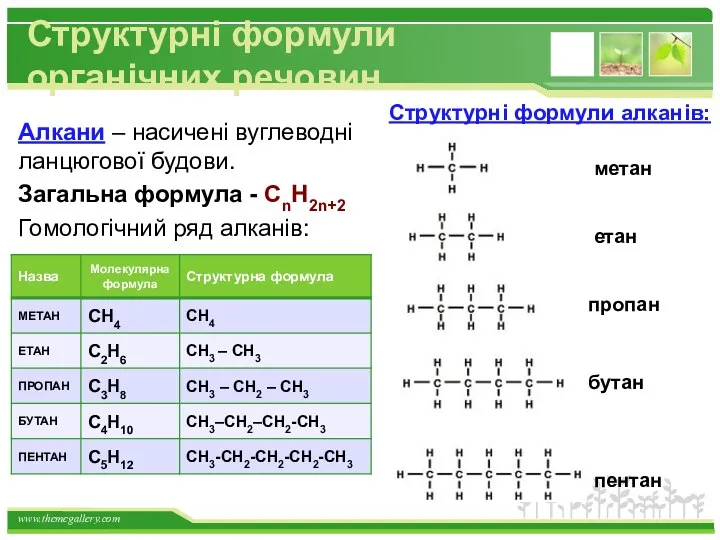
- 15. Структурні формули органічних речовин Алкани – насичені вуглеводні ланцюгової будови. Загальна формула - СnH2n+2 Гомологічний ряд
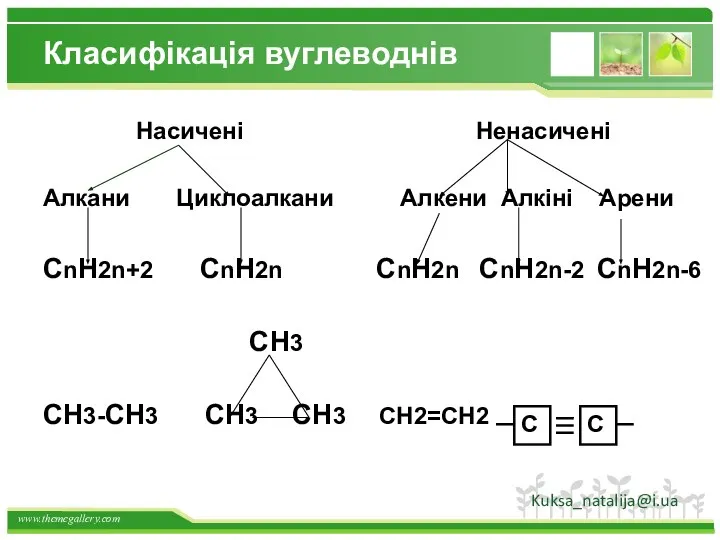
- 16. Класифікація вуглеводнів Насичені Ненасичені Алкани Циклоалкани Алкени Алкіні Арени CnH2n+2 CnH2n CnH2n CnH2n-2 CnH2n-6 CH3 CH3-CH3
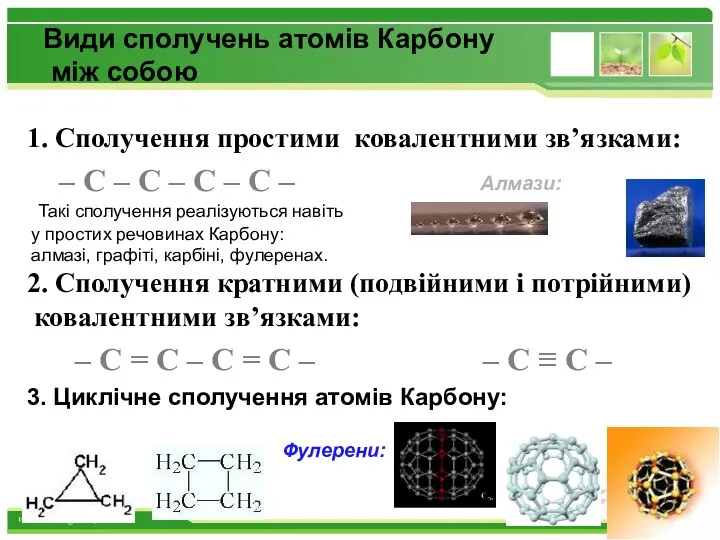
- 17. Види сполучень атомів Карбону між собою 1. Сполучення простими ковалентними зв’язками: – С – С –
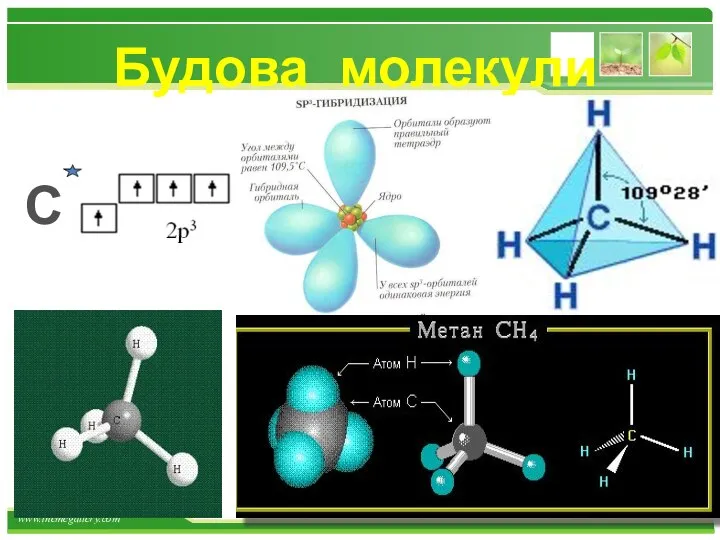
- 18. Будова молекули С
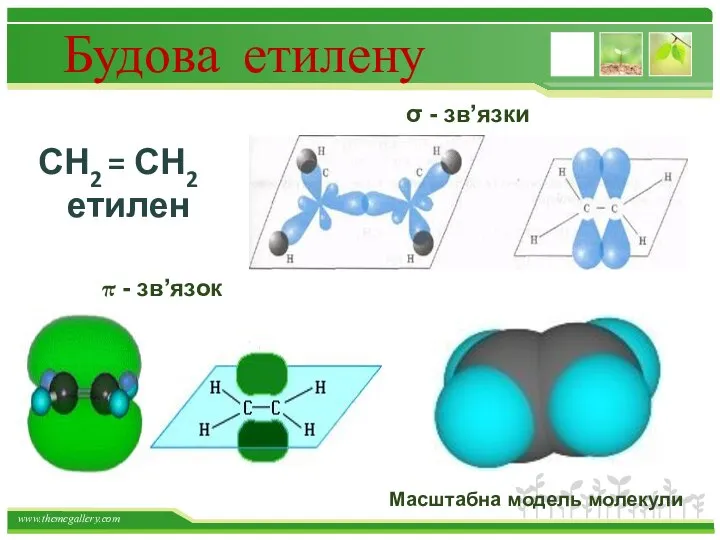
- 19. Будова етилену СН2 = СН2 етилен σ - зв’язки π - зв’язок Масштабна модель молекули
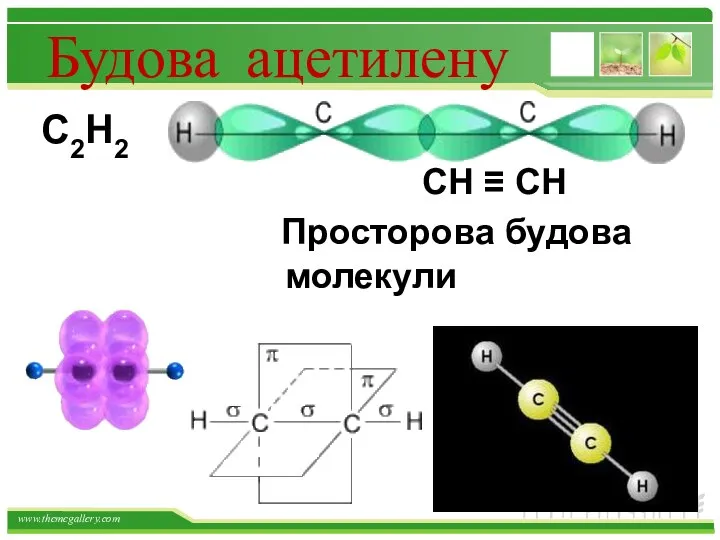
- 20. Будова ацетилену С2Н2 СН ≡ СН Просторова будова молекули
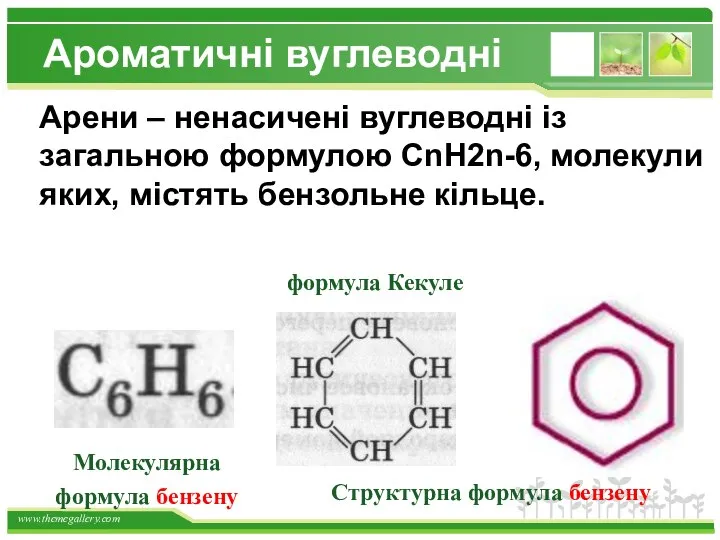
- 21. Структурна формула бензену Арени – ненасичені вуглеводні із загальною формулою CnH2n-6, молекули яких, містять бензольне кільце.
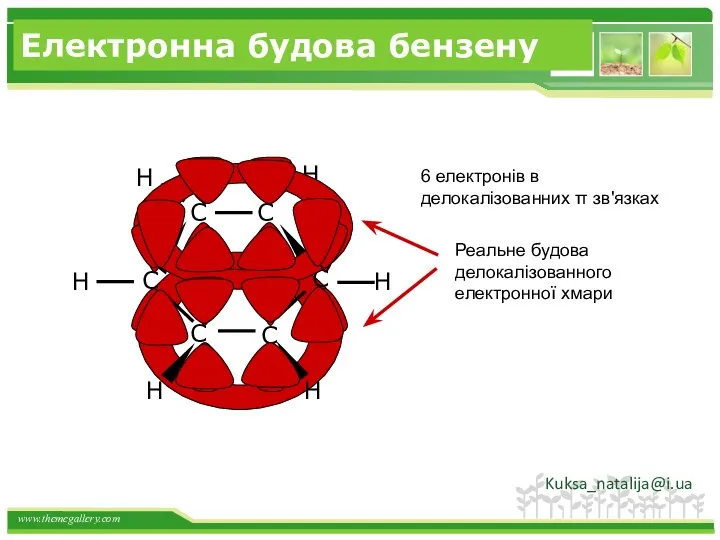
- 22. Електронна будова бензену 6 електронів в делокалізованних π зв'язках Kuksa_natalija@i.ua
- 23. Фізичні властивості метану: Метан (СН4) - газ; без кольору; без запаху; майже не розчиняється у воді;
- 24. Фізичні властивості етилену С2Н4 безбарвний газ; добре розчинний в органічних розчинниках; tплавл = - 169,2 ̊С;
- 25. Фізичні властивості С2Н2 безбарвний газ; майже без запаху; малорозчинний у воді, але під тиском добре розчиняється
- 26. Фізичні властивості бензену. безбарвна рідина, з різким характерним запахом, легше води, розчиняється у воді, розчинний в
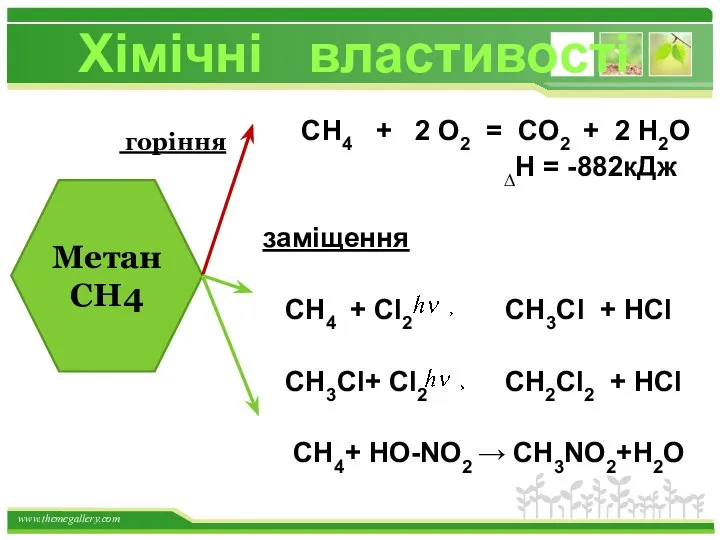
- 27. СН4 + 2 О2 = СО2 + 2 Н2О ∆Н = -882кДж заміщення СН4 + Cl2
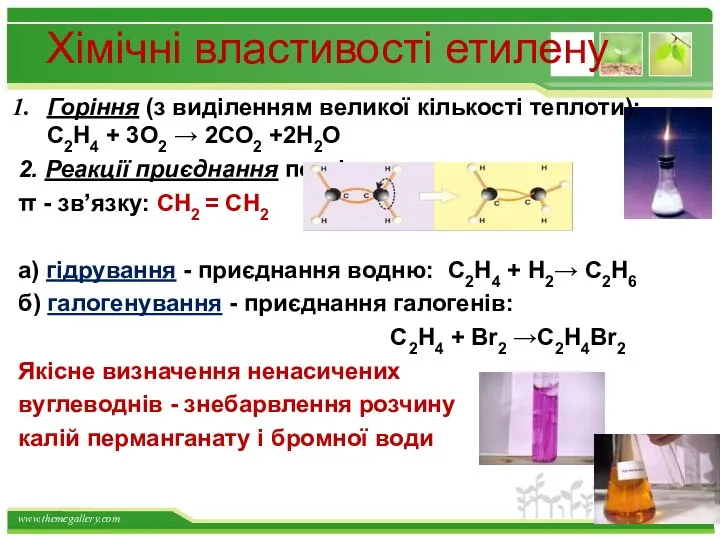
- 28. Хімічні властивості етилену Горіння (з виділенням великої кількості теплоти): С2Н4 + 3O2 → 2СО2 +2Н2О 2.
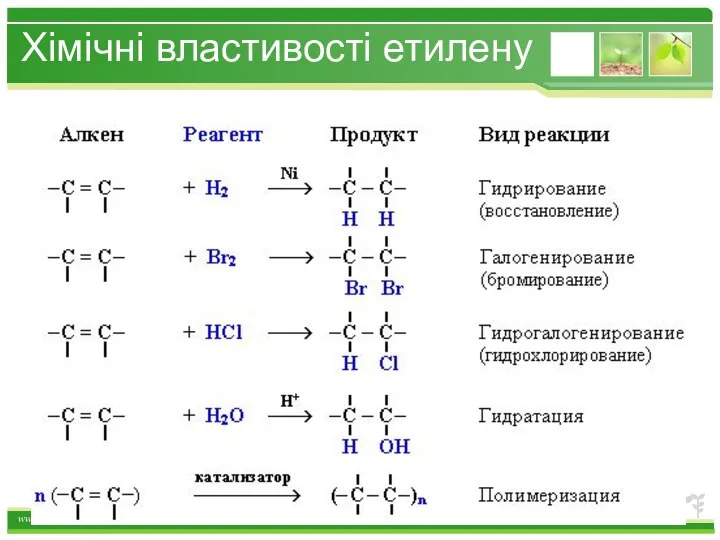
- 29. Хімічні властивості етилену
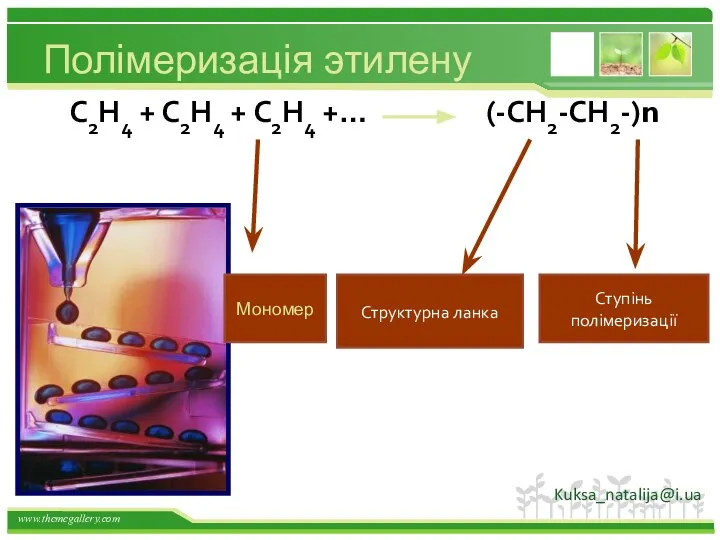
- 30. Полімеризація этилену С2Н4 + С2Н4 + С2Н4 +… (-СН2-СН2-)n Структурна ланка Ступінь полімеризації Мономер Kuksa_natalija@i.ua
- 31. Хімічні властивості ацетилену Горіння (яскравим кіптявим полум’ям): 2С2Н2 + 5O2 → 4СО2 +2Н2О 2. Реакції приєднання
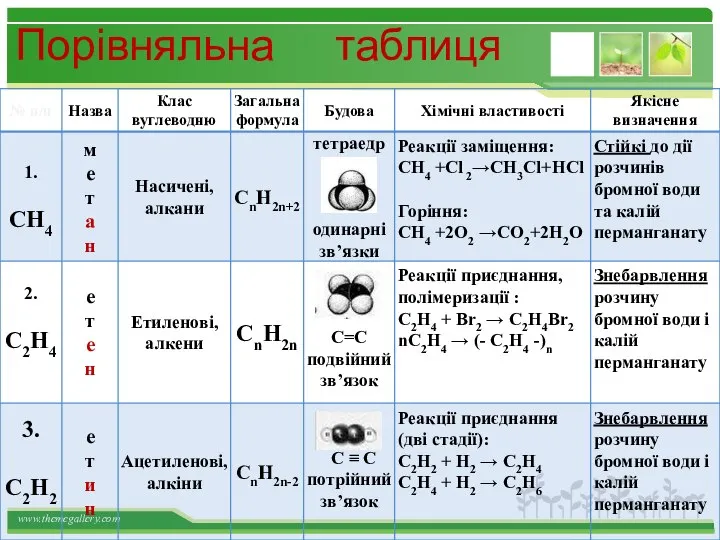
- 32. Порівняльна таблиця
- 33. Бензен горить. Полум'я бензену кіптяве з за високого вмісту карбону в молекулі. Хімічні властивості бензену Через
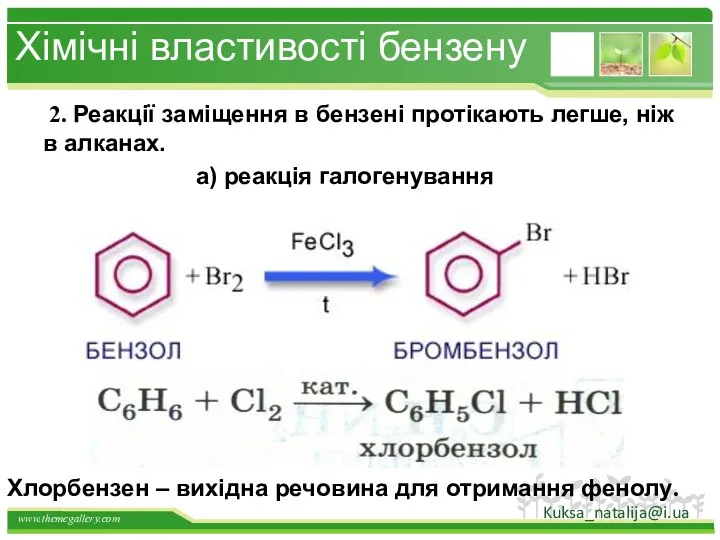
- 34. Хімічні властивості бензену 2. Реакції заміщення в бензені протікають легше, ніж в алканах. а) реакція галогенування
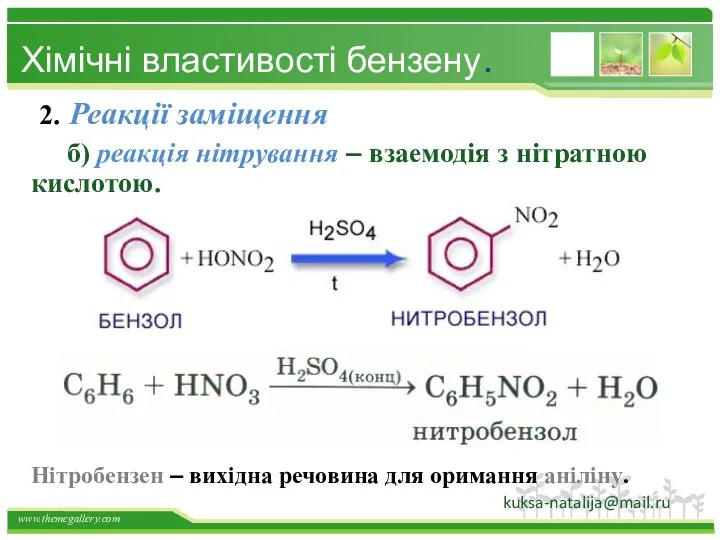
- 35. 2. Реакції заміщення б) реакція нітрування – взаемодія з нітратною кислотою. Хімічні властивості бензену. Нітробензен –
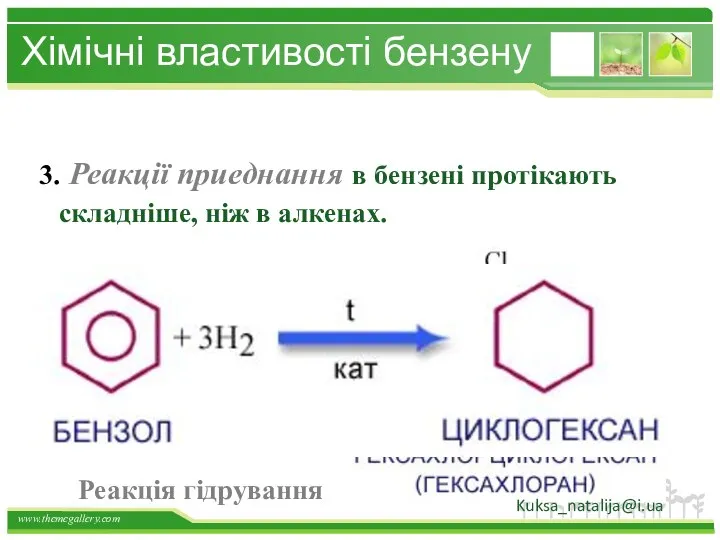
- 36. Хімічні властивості бензену 3. Реакції приеднання в бензені протікають складніше, ніж в алкенах. Реакція гідрування Kuksa_natalija@i.ua
- 37. Хімічні властивості бензену Незважаючи на високу ненасиченість молекули бензену (за складом), він не дає характерних, якісних
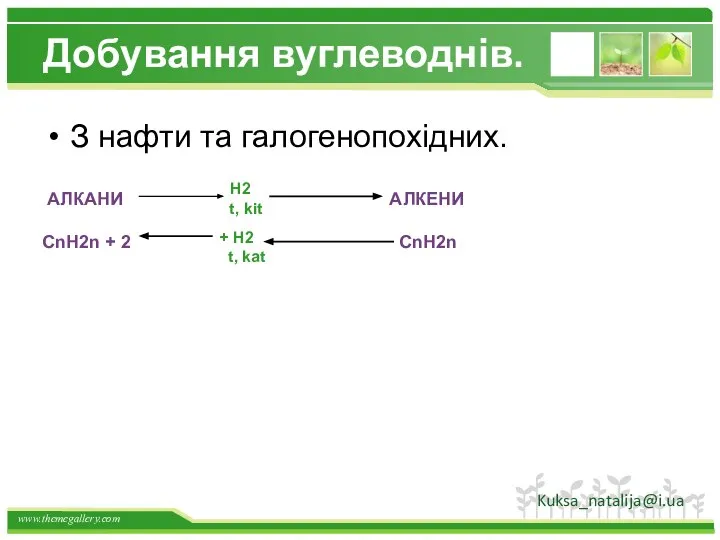
- 38. Добування вуглеводнів. З нафти та галогенопохідних. АЛКАНИ CnH2n + 2 АЛКЕНИ CnH2n H2 t, kit +
- 39. Добування вуглеводнів. АЛКЕНИ - H2 t, kat АЛКІНИ СnH2n + H2 t, kat СnH2n-2 Kuksa_natalija@i.ua
- 40. Добування бензену. Бензен є першим представником аренів. Його можна отримати трімерізаціей ацетилену. Бензен отримують при переробці
- 41. Застосування алканів
- 42. Застосування алкенів
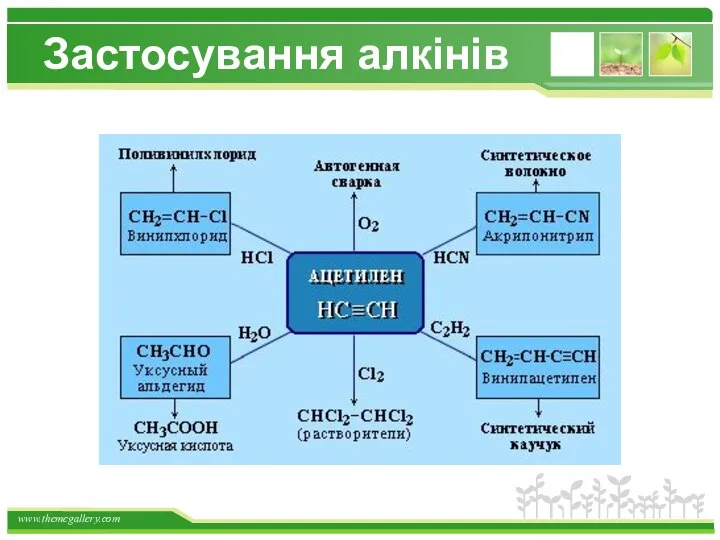
- 43. Застосування алкінів
- 44. Застосування бензену 1-добавка до бензину; виробництво 2-розчинників; 3-ацетону; 4-аніліну; 5-фенолу; 6-пестицидів; 7-ліків; 8-фенолформальдегідних пластмас. kuksa_natalija@i.ua
- 46. Скачать презентацию





















 Происхождение нефти
Происхождение нефти Мило. Мийні засоби
Мило. Мийні засоби  Ионный обмен или сорбция
Ионный обмен или сорбция Эпоксидные смолы
Эпоксидные смолы Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Лекарственные средства, производные барбитуровой кислоты
Лекарственные средства, производные барбитуровой кислоты Phase formation rules for high entropy alloys
Phase formation rules for high entropy alloys Алканы. Хлороформ
Алканы. Хлороформ Горечи. Лекция 3
Горечи. Лекция 3 8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ
8 класс. РЕШЕНИЕ ЗАДАЧ ПО УРАВНЕНИЯМ ХИМИЧЕСКИХ РЕАКЦИЙ Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Хроматография. (Лекция 4)
Хроматография. (Лекция 4) Неорганические вещества клетки
Неорганические вещества клетки Сульфат меди
Сульфат меди Коррозия металлов
Коррозия металлов Механизмы двухсубстатных реакций
Механизмы двухсубстатных реакций Алканы. Алкены. Алкины
Алканы. Алкены. Алкины Неметаллы и их соединения
Неметаллы и их соединения Вещество. Состояние вещества. Кристаллические решётки
Вещество. Состояние вещества. Кристаллические решётки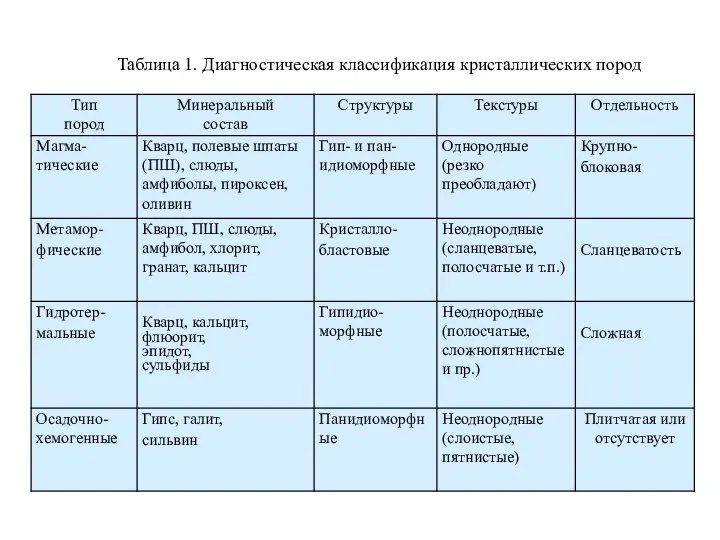 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Производные пиррола и индола. (Лекция 4)
Производные пиррола и индола. (Лекция 4) Презентация по Химии "Степень окисления" - скачать смотреть
Презентация по Химии "Степень окисления" - скачать смотреть  Гетерогенные и лигандообменные равновесия и процессы
Гетерогенные и лигандообменные равновесия и процессы Основания. Классификация оснований
Основания. Классификация оснований Металл золото
Металл золото Сравнение нормативов некоторых веществ
Сравнение нормативов некоторых веществ Производство топлив и масел
Производство топлив и масел История открытия жиров
История открытия жиров