Содержание
- 2. Основні відомості: Основні відомості: Кислоти, у класичному визначенні — електроліти, які при розчиненні в йонізуючому розчиннику
- 3. Формула: Формула: Нn(зал)m Н-водень,n- к-сть молекул,(зал)-кислотний залишок
- 4. Назви кислот: Назви кислот: HNO3 — нітратна кислота (азотна) Н2SO4 — сульфатна кислота (сірчана) Н3РО4 —
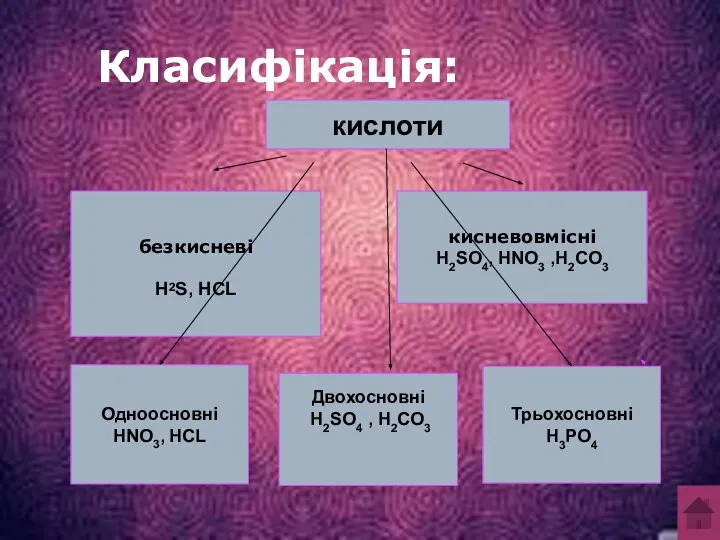
- 5. Класифікація: Класифікація:
- 6. За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна
- 7. Хімічні властивості: Хімічні властивості: 1.Взаємодія кислоти з металами Кислота+метал№1=метал№2+сіль 2.Взаємодія кислоти з оксидом Кислота+оксид=сіль+водень 3.взаємодія кислоти
- 8. Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад: SO3 + Н2O = H2SO4
- 9. Використання в природі: Використання в природі: Кислоти постійно присутні навколо нас. Наприклад, дощова вода на перший
- 10. Кислоти в організмі людини: Кислоти в організмі людини: Аскорбінова, фолієва, оротовая, пангамовая, нікотинова і інші кислоти
- 11. Чимало кислот в нашій їжі. Фрукти, овочі, молочні продукти, ліки постачають цілий букет кислот: яблучну, щавлеву,
- 12. Багато рослин містять кислоти і використовують їх як «Хімічна зброя» Мухомори в якості отруйних токсинів «використовують»
- 13. Якщо ви присяде поблизу мурашника, то надовго запам'ятаєте пекучі укуси його мешканців. Мураха впорскує в ранку
- 15. Скачать презентацию
Основні відомості:
Основні відомості:
Кислоти, у класичному визначенні — електроліти, які при розчиненні в
Основні відомості:
Основні відомості:
Кислоти, у класичному визначенні — електроліти, які при розчиненні в
HCL = H++CL-
Формула:
Формула:
Нn(зал)m
Н-водень,n- к-сть молекул,(зал)-кислотний залишок
Формула:
Формула:
Нn(зал)m
Н-водень,n- к-сть молекул,(зал)-кислотний залишок
Назви кислот:
Назви кислот:
HNO3 — нітратна кислота (азотна)
Н2SO4 — сульфатна кислота (сірчана)
Н3РО4 —
Назви кислот:
Назви кислот:
HNO3 — нітратна кислота (азотна)
Н2SO4 — сульфатна кислота (сірчана)
Н3РО4 —
НРО3 — метафосфатна кислота
Н2СО3 — карбонатна кислота (вугільна)
Н3ВО3 — боратна кислота (борна)
HNO2 — нітритна кислота (азотиста)
Н2SO3 — сульфітна кислота (сірчиста)
HCl — хлоридна кислота (хлороводнева, або соляна)
HI — йодидна кислота (йодоводнева)
HBr — бромідна кислота (бромоводнева)
H2S — сульфідна кислота(сірководнева)
Класифікація:
Класифікація:
Класифікація:
Класифікація:
За стандартних умов багато кислот — рідини (H2S04, HN03), але
За стандартних умов багато кислот — рідини (H2S04, HN03), але
За стандартних умов багато кислот — рідини (H2S04, HN03), але є й тверді кислоти — ортофосфатна Н3Р04, метафосфатна НРОз, силікатна (драглиста маса) H2Si03. Всі кислоти важчі за воду. Деякі кислоти леткі (НСl, HN03), вони мають задушливий запах. Майже всі кислоти безбарвні.
Кислоти — їдкі речовини. Особливо небезпечні сульфатна, нітратна та хлоридна кислоти. Вони роз'їдають папір, деревину, тканини. Бризки кислот, що потрапили на шкіру, можуть спричинити хімічний опік. Тому поводитися з кислотами треба обережно. Особливо слід берегти очі. В хімічних лабораторіях під час роботи з кислотами очі захищають окулярами. Якщо бризки кислоти потрапили на шкіру або в очі, їх треба негайно змити великою кількістю води і звернутися до медпункту.
Фізичні властивості:
Хімічні властивості:
Хімічні властивості:
1.Взаємодія кислоти з металами
Кислота+метал№1=метал№2+сіль
2.Взаємодія кислоти з оксидом
Кислота+оксид=сіль+водень
3.взаємодія кислоти з
Хімічні властивості:
Хімічні властивості:
1.Взаємодія кислоти з металами
Кислота+метал№1=метал№2+сіль
2.Взаємодія кислоти з оксидом
Кислота+оксид=сіль+водень
3.взаємодія кислоти з
Кислота№1+сіль№1=кислота№2+сіль№2
Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад:
SO3
Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад: SO3
Багато оксигеновмісних кислот можна добути взаємодією кислотних оксидів з водою, наприклад:
SO3 + Н2O = H2SO4
N2O5 + Н2O = 2HNO3
Але ти пам'ятаєш, що не всі кислоти можна добути, розчинюючи відповідний оксид у воді. Так, силіцій(IV) оксид SiO2 — складова річкового піску — у воді не розчиняється. Проте і йому відповідає певна кислота — силікатна H2SiO3, тільки добувають її не з оксиду, а іншим способом:
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
Безкисневі кислоти НСl, HBr, HI, H2S добувають синтезом з водню та неметалу й наступним розчиненням водневої сполуки у воді:
Н2 + Сl2 = 2НСl
Способи добування:
Використання в природі:
Використання в природі:
Кислоти постійно присутні навколо нас. Наприклад, дощова
Використання в природі:
Використання в природі:
Кислоти постійно присутні навколо нас. Наприклад, дощова
Кислоти в організмі людини:
Кислоти в організмі людини:
Аскорбінова, фолієва, оротовая, пангамовая, нікотинова
Кислоти в організмі людини:
Кислоти в організмі людини:
Аскорбінова, фолієва, оротовая, пангамовая, нікотинова
Чимало кислот в нашій їжі. Фрукти, овочі, молочні продукти, ліки постачають
Чимало кислот в нашій їжі. Фрукти, овочі, молочні продукти, ліки постачають
Чимало кислот в нашій їжі. Фрукти, овочі, молочні продукти, ліки постачають цілий букет кислот: яблучну, щавлеву, лимонну, мигдалеву, молочну, масляну, кавову, оцтову, аскорбінову та інші. Навіть синильна кислота (сильна отрута) знайома кожному, хто ласував ядерця кісточок слив, вишень чи мигдалю. Кількість її мізерно, але відчути смак і запах можна. Так що ядерця захоплюватися не слід, особливо якщо вони взяті з недозрілих плодів або торішніх компотів.
Кислоти в їжі:
Багато рослин містять кислоти і використовують їх як
«Хімічна зброя»
Мухомори в
Багато рослин містять кислоти і використовують їх як «Хімічна зброя» Мухомори в
Багато рослин містять кислоти і використовують їх як
«Хімічна зброя»
Мухомори в якості отруйних токсинів «використовують» іботеновой кислоту. Ця речовина так отруйно, що Мухоморові нема чого ховатися.
Однак лосі жують мухомори і не гинуть від цього. Швидше - навпаки: мухоморами вони лікують якісь свої «хвороби».
Ботанікам відомо більше 800 видів рослин, що виробляють синильну кислоту.
Багато рослин виділяють кислоти, пригнічуючи ними інші види рослин.
У волосках кропиви міститься пекуча
мурашина кислота
Кислоти в рослинному світі:
Якщо ви присяде поблизу мурашника, то надовго запам'ятаєте пекучі укуси його
Якщо ви присяде поблизу мурашника, то надовго запам'ятаєте пекучі укуси його
Якщо ви присяде поблизу мурашника, то надовго запам'ятаєте пекучі укуси його мешканців. Мураха впорскує в ранку від укусу отрута, що містить мурашину кислоту. Мурашиної кислотою обумовлено печіння кропиви, її виділяють деякі гусениці.
Тропічний павук стріляє у ворогів цівкою рідини, що містить 84% оцтової кислоти.
Плоскі тисяченожкі використовують пари синильної кислоти.
Деякі жуки вистрілюють цівкою розведеної сірчаної кислоти.
Кислоти в тваринному світі:











 НЕМЕТАЛЛЫ АЗОТ
НЕМЕТАЛЛЫ АЗОТ Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4
Олефиновые углеводороды как сырье для органического синтеза. Реакции олефинов. Способы производства олефинов. Лекция 4 Lipid metabolism
Lipid metabolism КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ
КОВАЛЕНТНАЯ СВЯЗЬ ПОЛЯРНАЯ И НЕПОЛЯРНАЯ Минерал как химическое соединение
Минерал как химическое соединение Основы электрохимии
Основы электрохимии Презентация по Химии "Мы изучаем химию" - скачать смотреть
Презентация по Химии "Мы изучаем химию" - скачать смотреть  Соли, их классификация и свойства
Соли, их классификация и свойства Аллотропные модификации
Аллотропные модификации Термодинамика
Термодинамика Молекулярно-массовые характеристики полимеров (Лекция 2)
Молекулярно-массовые характеристики полимеров (Лекция 2) Антибиотики. Классификация антибиотиков по механизму действия
Антибиотики. Классификация антибиотиков по механизму действия Щелочные металлы IА группы. Литий
Щелочные металлы IА группы. Литий Месторождения хрома
Месторождения хрома Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У
Пластмассы полимеризационного и поликонденсационного получения. Группа № Анисимов Роман Соловьева Алеся Столбов Никита У Осадочные породы. (Лекция 9.2)
Осадочные породы. (Лекция 9.2) Природные и синтетические красители
Природные и синтетические красители Строение атома
Строение атома Проект по химии Лешковой Ирины 10 «Б»
Проект по химии Лешковой Ирины 10 «Б» Реакции соединения
Реакции соединения Алюминий и сплавы на его основе
Алюминий и сплавы на его основе Гомологи. Алкин
Гомологи. Алкин Значение органической химии в жизни людей
Значение органической химии в жизни людей Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов
Тема: Строение электронных оболочек атомов. Разработал: Учитель химии – биологии первой квалификационной категории Баженов  Химическая связь
Химическая связь Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика Ядерна зброя. Вплив іонізуючого випромінювання на живий організм
Ядерна зброя. Вплив іонізуючого випромінювання на живий організм Гетероциклические соединения
Гетероциклические соединения