Содержание
- 2. Строение атома
- 3. Модель Томсона В 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно
- 4. Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый
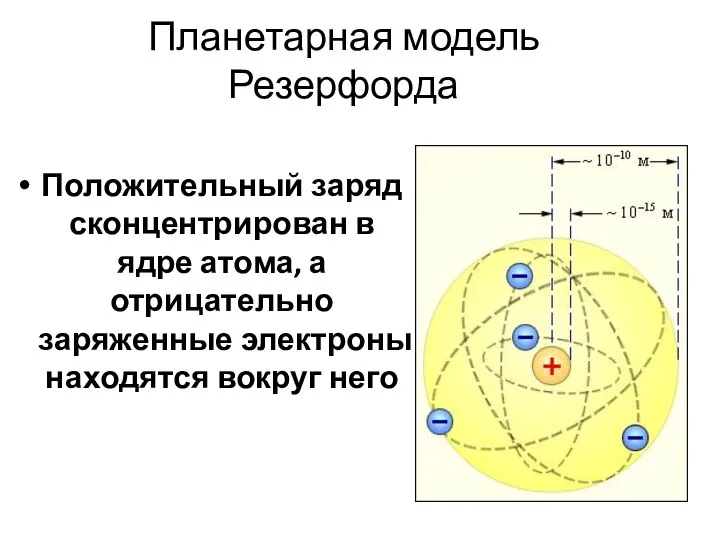
- 5. Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
- 7. Обсудим некоторые термины АТОМ - мельчайшая , химически неделимая, частица ОРБИТАЛИ - место расположения электрона в
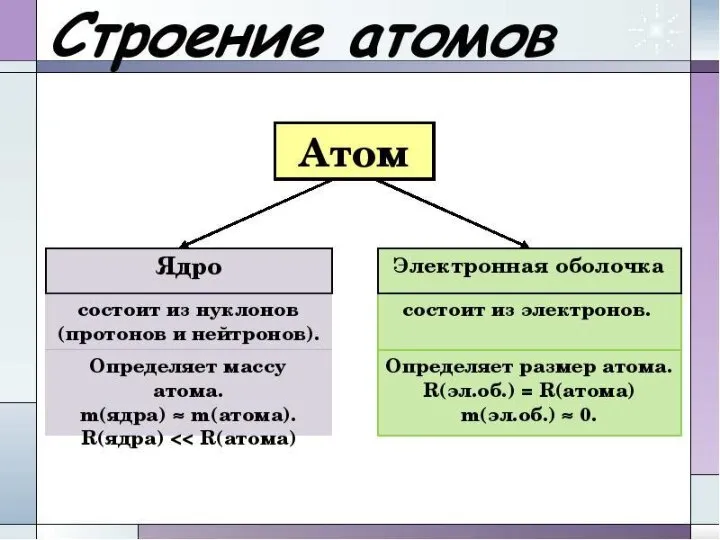
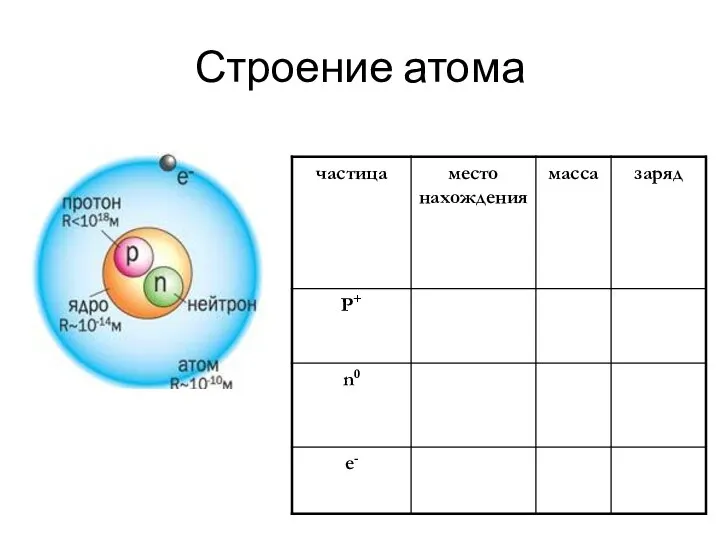
- 9. Строение атома
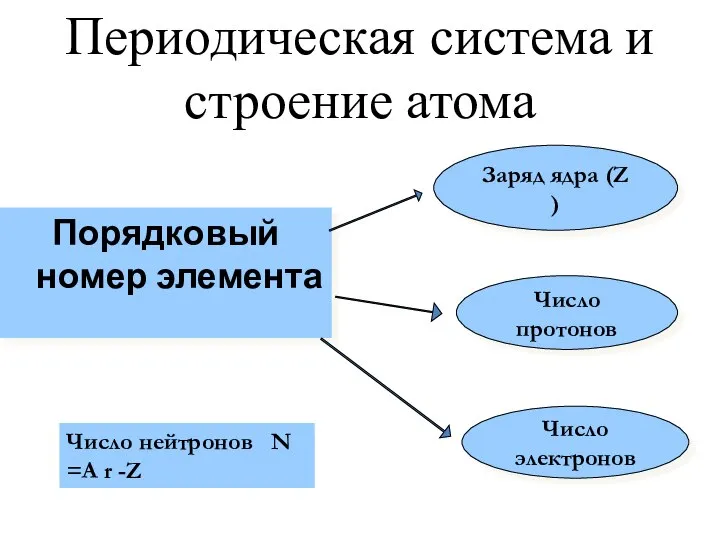
- 10. Периодическая система и строение атома Порядковый номер элемента Число протонов Число электронов Заряд ядра (Z )
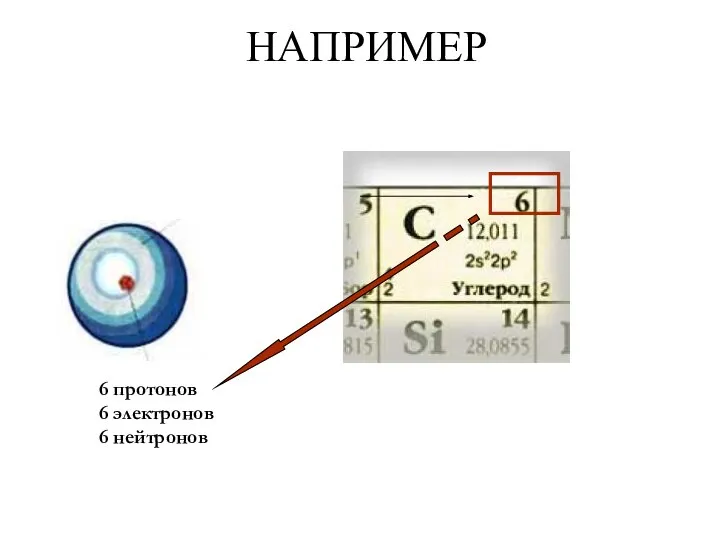
- 11. НАПРИМЕР 6 протонов 6 электронов 6 нейтронов
- 12. Изотопы ИЗОТОПЫ – это атомы одного химического элемента , имеющие одинаковое число протонов и электронов, но
- 13. Практическая часть Закончи определения АТОМ –это … ПЛАНЕТАРНАЯ МОДЕЛЬ –это… ОРБИТАЛЬ –это… ПОРЯДКОВЫЙ НОМЕР –показывает …
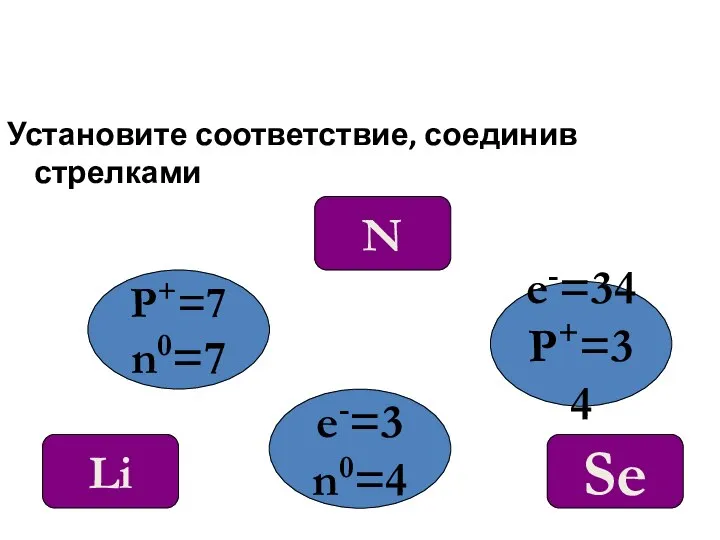
- 14. Установите соответствие, соединив стрелками P+=7 n0=7 e-=34 P+=34 e-=3 n0=4 N Se Li
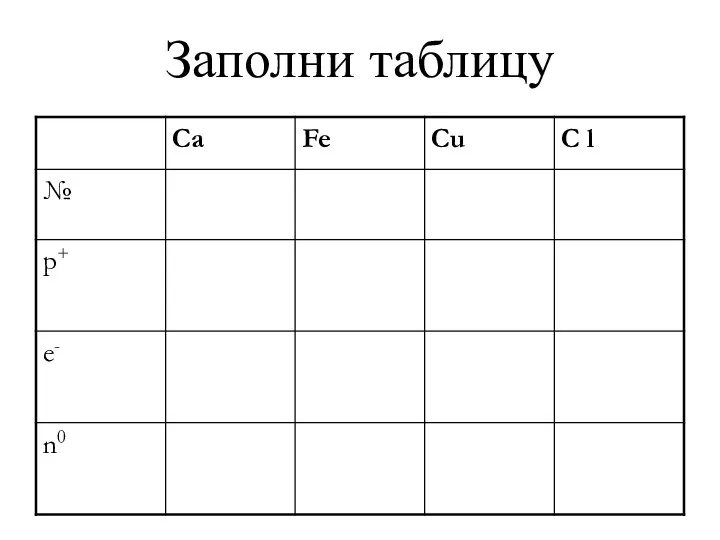
- 15. Заполни таблицу
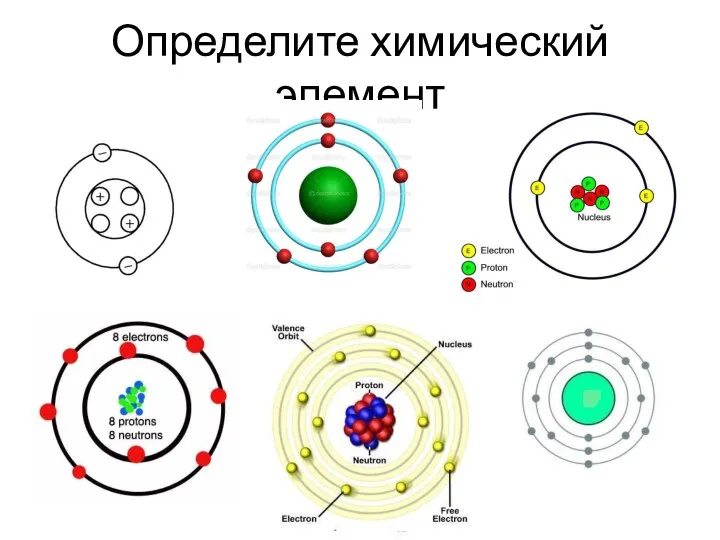
- 16. Определите химический элемент
- 17. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 18. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 20. Скачать презентацию








 Презентация по химии Электрохимический ряд напряжений металлов
Презентация по химии Электрохимический ряд напряжений металлов  Тема: «Йод в организме человека . Использование его в медицине» Выполнила: Роппельд В.
Тема: «Йод в организме человека . Использование его в медицине» Выполнила: Роппельд В.  ГИА-9 Химия. А1
ГИА-9 Химия. А1 Ионизирующее излучение и окружающая среда
Ионизирующее излучение и окружающая среда Природные и синтетические красители и ароматизаторы
Природные и синтетические красители и ароматизаторы Предпрофильный курс Мир химии
Предпрофильный курс Мир химии Электролитическая диссоциация
Электролитическая диссоциация Жидкие кристаллы
Жидкие кристаллы Иондар және олардың түзілуі
Иондар және олардың түзілуі Карбон қышқылдары
Карбон қышқылдары Презентация по Химии "Галогени" - скачать смотреть бесплатно
Презентация по Химии "Галогени" - скачать смотреть бесплатно Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Классификация кристаллов по силам связи
Классификация кристаллов по силам связи Периодический закон Д.И. Менделеева (8 класс)
Периодический закон Д.И. Менделеева (8 класс) Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева
Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева Задачи для решения дома
Задачи для решения дома Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Коррозия металлов
Коррозия металлов Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Ауыр металдар
Ауыр металдар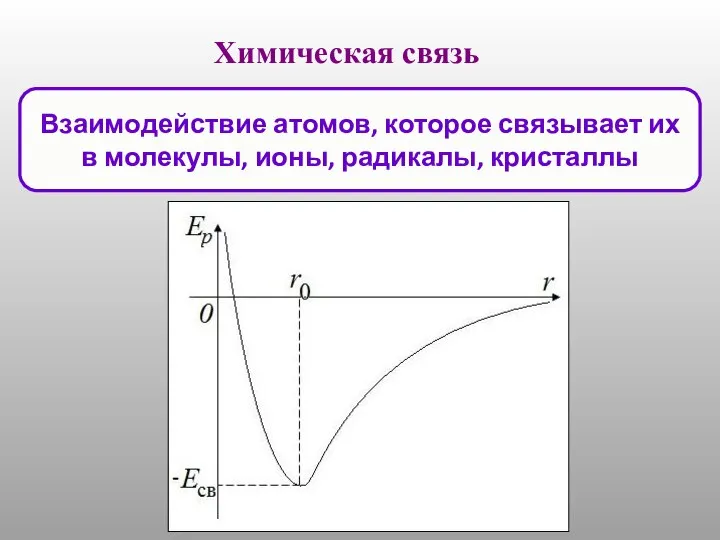 Химическая связь
Химическая связь Основные положения МКТ
Основные положения МКТ Альдегиды и кетоны
Альдегиды и кетоны Аттестационная работа. Исследовательская работа. Влияет ли зубная паста на прочность зубов
Аттестационная работа. Исследовательская работа. Влияет ли зубная паста на прочность зубов Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения
Общая и неорганическая химия. Лекция 20 Особенности химии серы. Водородные и кислородные соединения Газообразное состояние вещества
Газообразное состояние вещества Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО
Понятие о валентности и химической связи. Ковалентная химическая связь.(Учитель химии и биологии Алексеева А.К. МОУ «Рунгинская СО Строение белков. Интегрированный урок по биологии и химии в 10 классе
Строение белков. Интегрированный урок по биологии и химии в 10 классе