Содержание
- 2. Ответьте на вопросы: Какой химический элемент входит в состав любого органического вещества? УГЛЕРОД
- 3. Элемент, в переводе с греческого «несущий свет»? ФОСФОР
- 4. Какие 2 элемента наиболее распространены в космосе? ВОДОРОД И ГЕЛИЙ
- 5. Вещество, поддерживающее горение и дыхание? КИСЛОРОД
- 6. Самый легкий газ? ВОДОРОД
- 7. Артур Конан Дойль «СОБАКА БАСКЕРВИЛЕЙ» Найдите химическую ошибку:
- 8. Шерлок Холмс: «Фосфор! Странная смесь…Совершенно без запаха. Состав преступления теперь налицо…»
- 9. На воздухе белый фосфор действительно светится в темноте. Достаточно небольшого трения, чтобы фосфор воспламенился с выделением
- 10. Что объединяет все элементы из данного ряда? Н, В, С, О, Р, F, S, N, He,
- 11. Что объединяет все показанные слайды?
- 12. Что такое неметаллы?
- 13. Используя опыт повседневной жизни, школьные знания приведите примеры, связанные с понятием неметаллов.
- 14. Что вы знаете о неметаллах? Запишите в тетрадях вопросы, которые вы хотите узнать о неметаллах, используя:
- 15. У атомов неметаллов внешняя электронная оболочка содержит много ( от 4 до 7) электронов( исключение атом
- 16. И стремится к завершению либо путем принятия недостающих электронов (тогда неметалл - окислитель) , либо путем
- 17. Если на внешней электронной оболочке 8 электронов это инертный газ.
- 18. У атомов элементов-неметаллов в периоде с увеличением порядкового номера заряд ядра увеличивается; радиусы атомов уменьшаются; число
- 19. У атомов элементов-неметаллов в подгруппе (в длиннопериодной таблице - в группе) с увеличением порядкового номера заряд
- 20. Простые вещества. Большинство неметаллов - простые вещества, в которых атомы связаны ковалентными связями; в благородных газах
- 21. Неметаллы в природе В природе встречаются самородные неметаллы N2 и O2 (в воздухе), сера (в земной
- 22. Кислород — газ без цвета, а озон имеет бледно-фиолетовый цвет. Озон более бактерициден (лат. ицдао —
- 24. Красный фосфор Сера Алмаз Кислород
- 25. Фосфор в природе Апатит (содержит фосфат кальция)
- 26. Карбонаты
- 28. В состав внутренней мантии Земли в основном входят элементы: МАГНИЙ, КРЕМНИЙ и КИСЛОРОД в виде соединений
- 29. Галогены в природе Фтор-F2 Флюорит -CaF2 Бром-Br2 в аналогичных соединениях, вместе с хлором Хлор-Cl2 каменная соль-
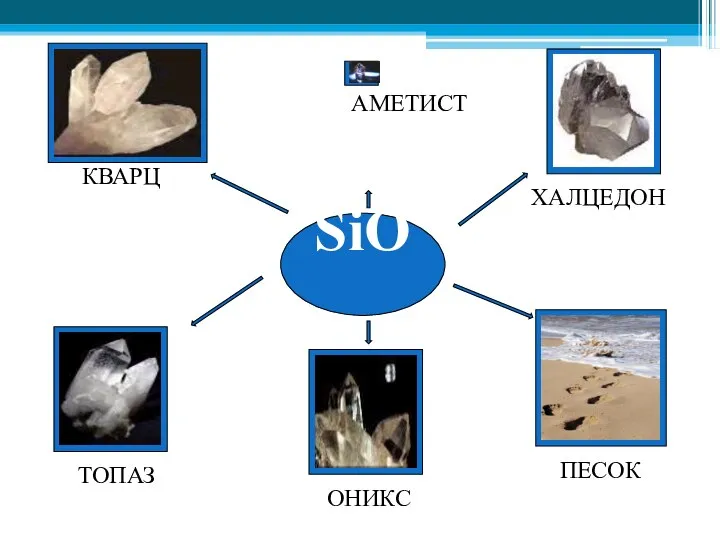
- 30. SiO2
- 31. Аллотропия Аллотро́пия (от др-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование одного и того
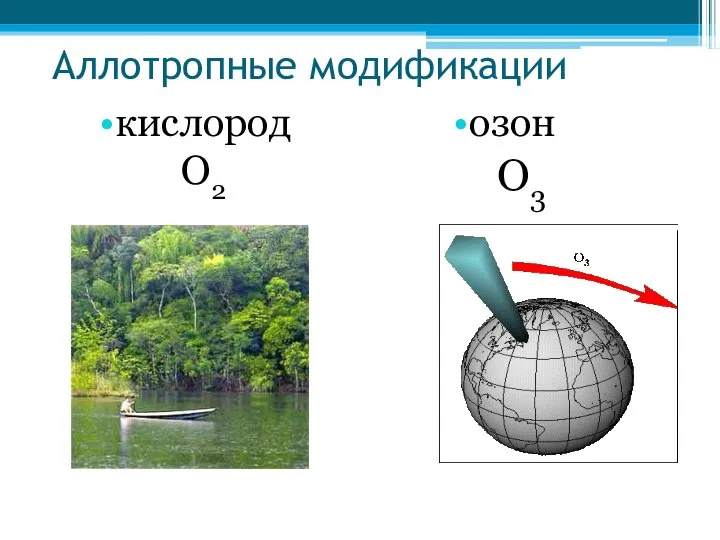
- 32. Аллотропные модификации кислород О2 озон О3
- 35. Аллотропные видоизменения фосфора Белый фосфор Красный фосфор
- 36. Аллотропия углерода алмаз графит
- 37. АЛЛОТРОПИЯ (ответьте на вопросы) Что такое аллотропия? Чем вызвано явление аллотропии?
- 38. Перед вами фотографии различных веществ, найдите среди них неметаллы, попробуйте догадаться о каком неметалле идет речь,
- 39. Конфигурация внешнего электронного слоя
- 42. Скачать презентацию





































 Электролитическая диссоциация воды
Электролитическая диссоциация воды Жидкостная хроматография
Жидкостная хроматография Презентация по Химии "Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Ионы и ионная химическая связь" - скачать смотреть  Неметаллы. Сера. 9 класс
Неметаллы. Сера. 9 класс Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Алюминий и его соединения
Алюминий и его соединения ГИДРОЛИЗ СОЛЕЙ 9 класс
ГИДРОЛИЗ СОЛЕЙ 9 класс  Презентация по Химии "Сера" - скачать смотреть
Презентация по Химии "Сера" - скачать смотреть  Классификация оснований
Классификация оснований Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Ц
Урок № 58. «Химические свойства солей». Лабораторный опыт № 11 Урок химии в 8 классе по учебнику Габриелян О. С. Учитель химии МОУ «Ц Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги
Проект по химии на тему: «Дисахариды» Учениц 10 «Б» класса Богдановой Анны Ганиной Ольги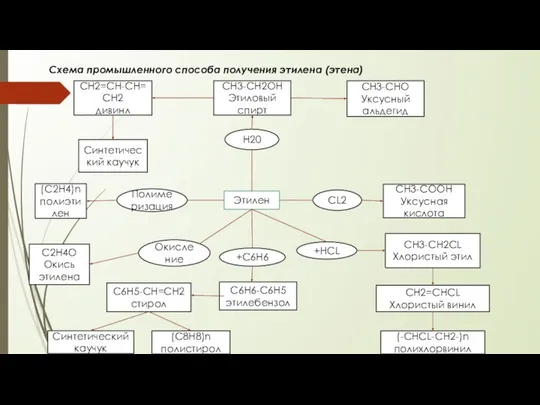 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена) Введение в биохимию. Строение и функции белков (часть 1)
Введение в биохимию. Строение и функции белков (часть 1) Гидролиз солей
Гидролиз солей Области применения спиртов
Области применения спиртов Періодична система
Періодична система  Алка́ны
Алка́ны Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона
Хімія і здоров’я людини Виконала Учениця 11-Б класу Тихонюк Альона  Изделия из неорганических материалов - керамика
Изделия из неорганических материалов - керамика Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7)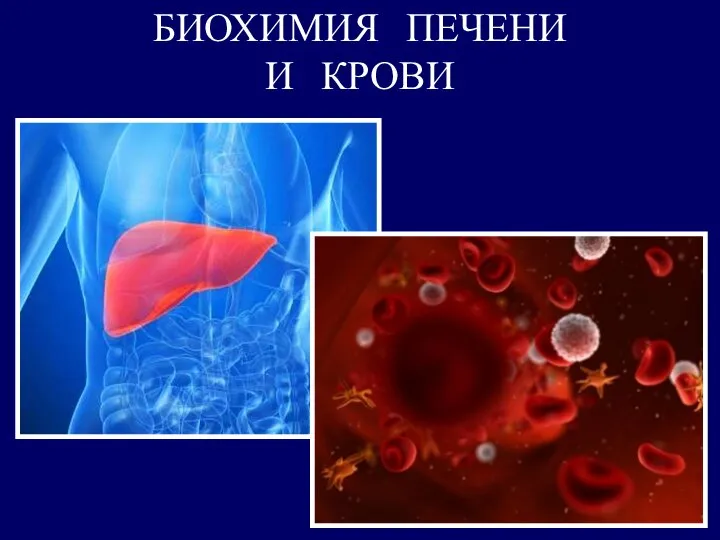 Биохимия печени и крови
Биохимия печени и крови Молекулярные свойства жидкостей
Молекулярные свойства жидкостей Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Презентация по Химии "Всё о кремнии" - скачать смотреть
Презентация по Химии "Всё о кремнии" - скачать смотреть  Растворы
Растворы Аллотропные модификации углерода
Аллотропные модификации углерода Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть
Презентация по Химии "Игра для знатоков химии "Пять звезд"" - скачать смотреть  Окислительно-восстановительные реакции (лекция 6)
Окислительно-восстановительные реакции (лекция 6)