Содержание
- 2. Цель: обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ. Задачи:
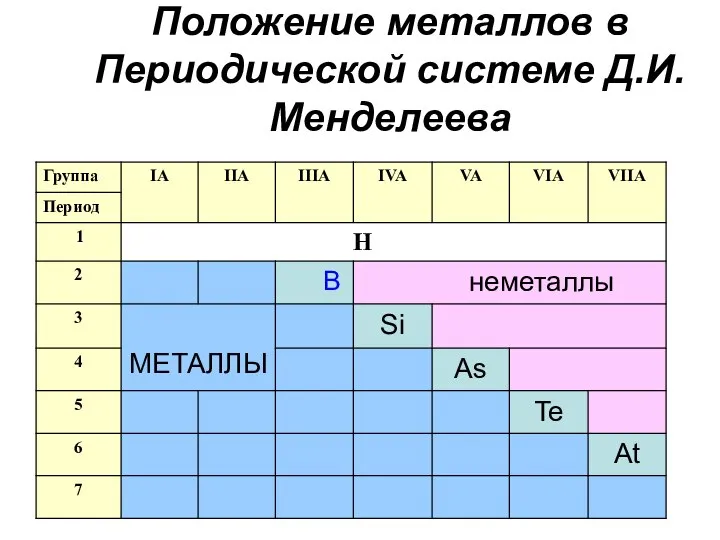
- 3. Положение металлов в Периодической системе Д.И. Менделеева
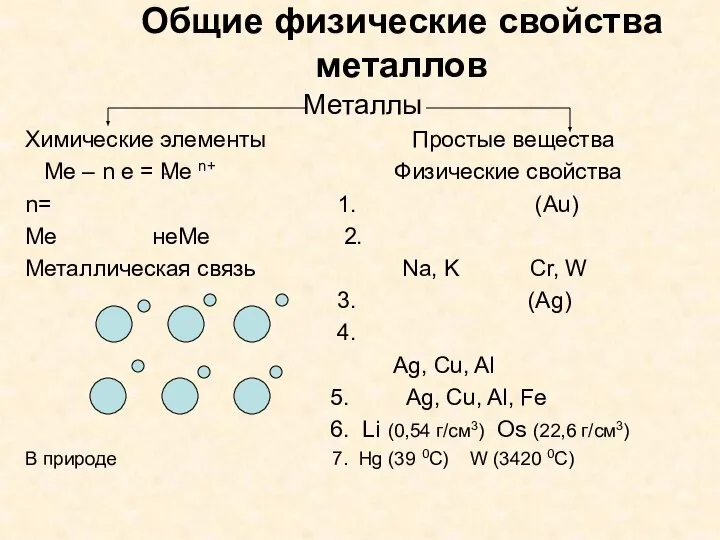
- 4. Общие физические свойства металлов Металлы Химические элементы Простые вещества Ме – n e = Ме n+
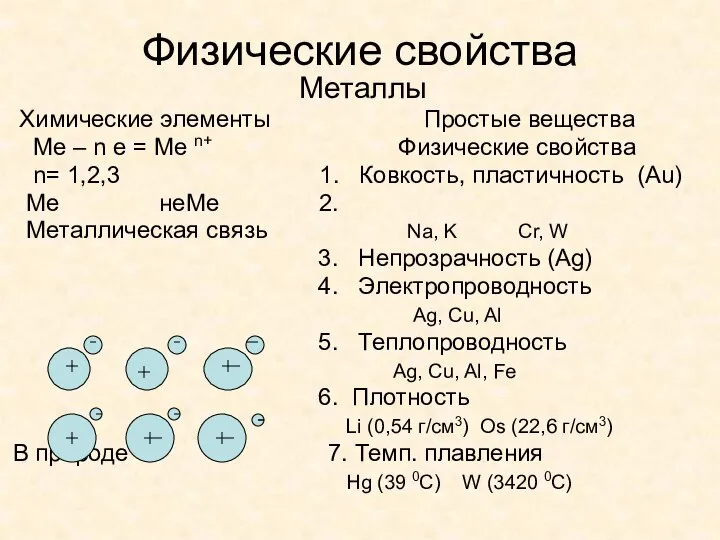
- 5. Физические свойства Металлы Химические элементы Простые вещества Ме – n e = Ме n+ Физические свойства
- 6. Химические свойства Электрохимический ряд напряжений металлов Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→ Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au Металл, находящийся в ряду напряжений левее водорода, способен
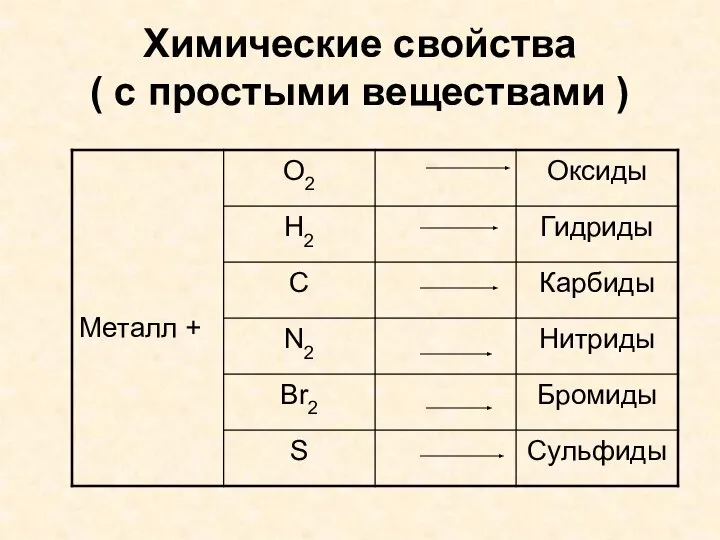
- 7. Химические свойства ( с простыми веществами )
- 8. Взаимодействие со сложными веществами с кислотами Mg + 2HCl (разб) = MgCl2 + H2 Mg –
- 9. с водными растворами солей менее активных металлов Zn + CuSO4 = ZnSO4 + Cu Zn0 –
- 10. Металлы в природе Наиболее активные – в виде солей: NaCl – поваренная соль. NaCl * KCl
- 11. Al2O3 – корунд, рубин, сапфир.
- 12. FeS – сульфид железа.
- 13. Мало активные – в свободном виде: Cu и Pt
- 14. Au и Ag
- 15. Применение металлов Конструкционные материалы. Металлы и их сплавы -- один их главных конструкционных материалов современной цивилизации.
- 17. Выводы и итоги урока: Все металлы имеют металлическую кристаллическую решетку. В металлах существует металлическая связь. Основные
- 19. Скачать презентацию












 Биохимия нервной ткани
Биохимия нервной ткани Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Минералы. Галенит
Минералы. Галенит Химические свойства хрома
Химические свойства хрома Функции белков
Функции белков Кремний и его соединения
Кремний и его соединения Химические свойства полимеров
Химические свойства полимеров Классификация органических реакций в органической химии
Классификация органических реакций в органической химии Водород. Получение водорода
Водород. Получение водорода Атмосфера. Химические и физико-химические процессы в атмосфере
Атмосфера. Химические и физико-химические процессы в атмосфере Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Одноатомные спирты
Одноатомные спирты Фенол қосылыстары
Фенол қосылыстары Белки, или протеины
Белки, или протеины Именные реакции в органической химии
Именные реакции в органической химии Кристаллы вокруг нас
Кристаллы вокруг нас Установление структуры биополимеров
Установление структуры биополимеров Рибофлавин - витамин красоты
Рибофлавин - витамин красоты Загальна характеристика рослинних кормiв. (Тема 1)
Загальна характеристика рослинних кормiв. (Тема 1) Ферменты гидролиза и биосинтеза нуклеиновых кислот
Ферменты гидролиза и биосинтеза нуклеиновых кислот ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите
ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ТЕМ БАЗОВОГО СОДЕРЖАНИЯ КУРСА ХИМИИ В 8 КЛАССЕ, НА ОСНОВЕ ТЕХНОЛОГИИ ПОЛНОГО УСВОЕНИЯ. Алексашенко Д.Н. Учите Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см
Презентация по Химии "Шкода запаху гуми і її токсичність. Які хвороби характерні для працівників шинних заводів?" - скачать см Використання натуральних та штучних добавок при виготовленні харчових продукцій
Використання натуральних та штучних добавок при виготовленні харчових продукцій Крахмал. Физические свойства
Крахмал. Физические свойства Оксиды
Оксиды  Синтетикалық полимерлер (пластиктер)
Синтетикалық полимерлер (пластиктер)