Содержание
- 2. План урока: Строение молекулы серной кислоты Физические свойства Химические свойства Получение Применение
- 3. Строение молекулы серной кислоты H2SO4 - молекулярная формула Вопросы: Простое или сложное вещество? Какова валентность атомов:
- 4. Физические свойства серной кислоты H2SO4 Ответьте на вопросы: Каково агрегатное состояние серной кислоты? Хорошо ли она
- 5. Химические свойства разбавленной кислоты Дописать уравнения реакций: Взаимодействие с металлами: H2SO4+Mg-> Взаимодействие с основными и амфотерными
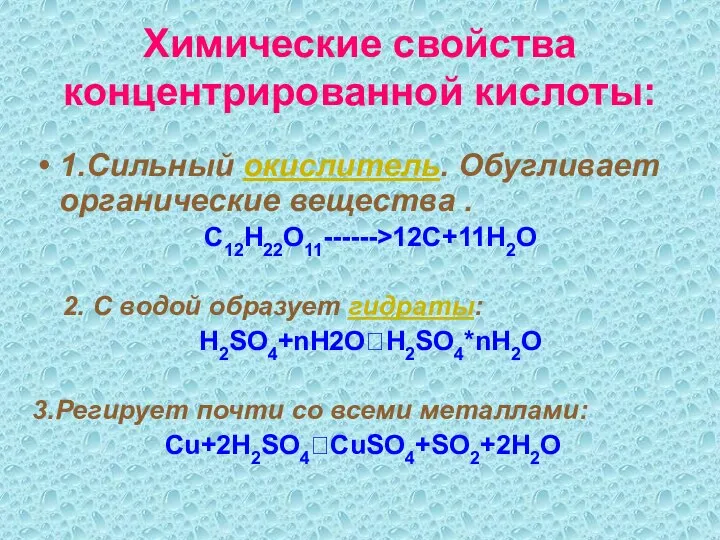
- 6. Химические свойства концентрированной кислоты: 1.Сильный окислитель. Обугливает органические вещества . С12Н22О11------>12С+11Н2О 2. С водой образует гидраты:
- 7. Взаимодействие концентрированной серной кислоты с металлами
- 8. Соли серной кислоты Предложите названия следующим веществам . Каково их применение?
- 9. Получение серной кислоты в промышленности Осуществить цепочку превращения: FeS2SO2SO3H2SO4 По учебнику самостоятельно изучить получение серной кислоты
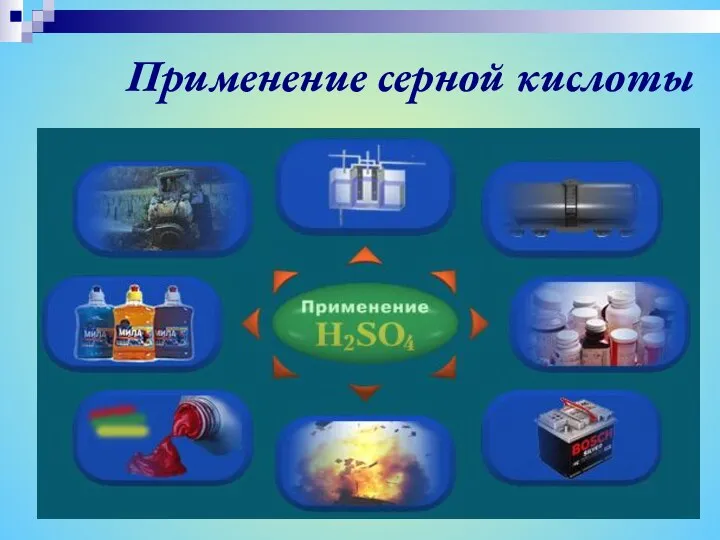
- 10. Применение серной кислоты
- 12. Скачать презентацию







 Буферные системы
Буферные системы Homecredit Bank. Показатели и зоны роста
Homecredit Bank. Показатели и зоны роста Механизмы образования ковалентной связи
Механизмы образования ковалентной связи Синтез уксусной кислоты
Синтез уксусной кислоты Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны
Тема : Спирты Презентация по химии Ученицы 11 «Б» класса ЗОШ №41 Зануды Татьяны  Утворення кристалів у природі
Утворення кристалів у природі  Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Stoffe bestehen aus kleinsten teilchen
Stoffe bestehen aus kleinsten teilchen СКЛО МУРАНО Скарби о.Мурано
СКЛО МУРАНО Скарби о.Мурано  Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай
Подготовил ученик 9-Б класса Дебальцевской ОШ І-ІІІ №3 Плешаков Николай  Реакционная способность аренов
Реакционная способность аренов Адиабатическое приближение
Адиабатическое приближение Металлы. Общая характеристика
Металлы. Общая характеристика Пудра. Виды пудр. Процесс изготовления
Пудра. Виды пудр. Процесс изготовления Anionic Polymerization
Anionic Polymerization Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Щелочные металлы
Щелочные металлы Химиялық элементтердің тірі және өлі табиғатта таралуы
Химиялық элементтердің тірі және өлі табиғатта таралуы Растворы неэлектролитов и электролитов
Растворы неэлектролитов и электролитов Химическая посуда
Химическая посуда Альдегидтер және кетондар
Альдегидтер және кетондар Диоксины, глобальные экотоксиканты
Диоксины, глобальные экотоксиканты Коррозия металлов. Сущность процесса коррозии
Коррозия металлов. Сущность процесса коррозии Оксиды. Основания. Кислоты. 6 класс
Оксиды. Основания. Кислоты. 6 класс Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Исследование химических моделей (11 класс)
Исследование химических моделей (11 класс) ДЕЙТЕРИЙ. ТЯЖЕЛАЯ ВОДА
ДЕЙТЕРИЙ. ТЯЖЕЛАЯ ВОДА Экстракция
Экстракция