Содержание
- 2. обобщить знания об алюминии и его соединениях, опытным путем изучить амфотерность оксида и гидроксида алюминия, уметь
- 3. Вопросы для беседы: Положение алюминия в ПСХЭ. Какими химическими свойствами обладает алюминий – простое вещество? Что
- 4. «Люди гибнут за металл» В.Гете. 1. Подумайте, почему алюминий так дорого ценился? 2. Какие соединения образует
- 5. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия. В обе пробирки
- 6. Доказательство амфотерности: Опыт1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. Опыт 2.Взаимодействие
- 7. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
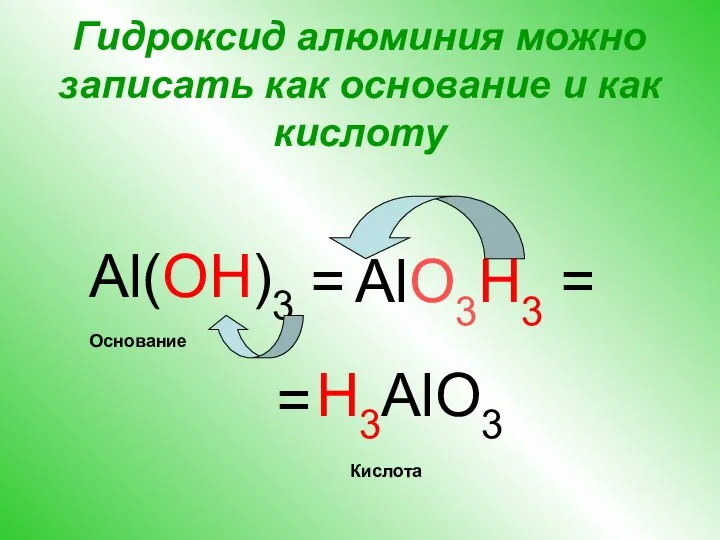
- 8. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 9. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 10. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 11. Алюминий в природе 1.Боксит 2.Рубин 3.Каолин
- 12. Применение соединений алюминия
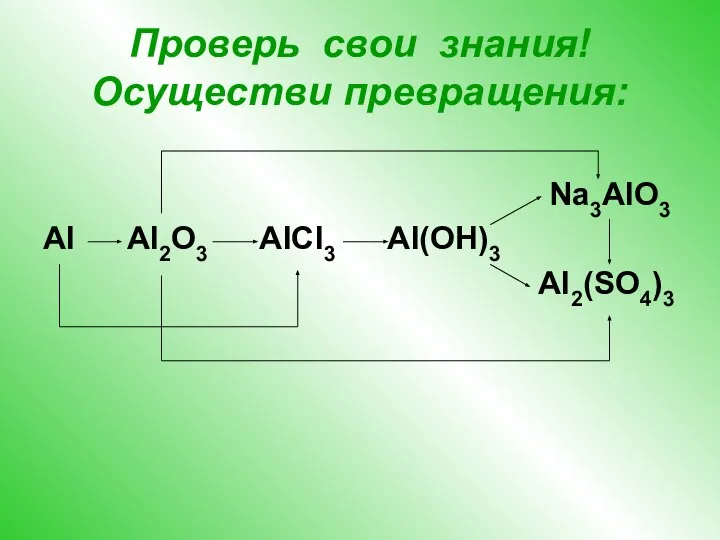
- 13. Проверь свои знания! Осуществи превращения: Na3AlO3 Al Al2O3 AlCl3 Al(OH)3 Al2(SO4)3
- 15. Скачать презентацию










 Хімічні властивості кислот
Хімічні властивості кислот Химический элемент. Неон
Химический элемент. Неон Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно
Презентация по Химии "Феноли та нафтоли. Ароматичні аміни. Азо- та діазосполуки." - скачать смотреть бесплатно Дегтярева М.О. Московская область г. Королёв АОУ ЛНИП 242-645-771
Дегтярева М.О. Московская область г. Королёв АОУ ЛНИП 242-645-771 Метод инверсионной вольтамперометрии
Метод инверсионной вольтамперометрии Аморфные тела
Аморфные тела Получение силикагеля, модифицированного бензоксазолами
Получение силикагеля, модифицированного бензоксазолами Липиды. Составные части липидов
Липиды. Составные части липидов Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате
Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате Ниобий. Химические свойства
Ниобий. Химические свойства Биохимия лёгких
Биохимия лёгких Синтез метилового эфира цинкофорина
Синтез метилового эфира цинкофорина Configuratia electronica. Sistemul periodic al elementelor. (Curs 3)
Configuratia electronica. Sistemul periodic al elementelor. (Curs 3) Типы химических реакции
Типы химических реакции Кристаллы
Кристаллы Синтетический каучук
Синтетический каучук Презентация по Химии "Путешествие в неограниченную химию" - скачать смотреть
Презентация по Химии "Путешествие в неограниченную химию" - скачать смотреть  Химия актиноидов
Химия актиноидов Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления Метаболизм глицерофосфолипидов. Метаболизм холестерола. (Лекция 10)
Метаболизм глицерофосфолипидов. Метаболизм холестерола. (Лекция 10) Вторичная переработка углеводородов
Вторичная переработка углеводородов Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Оксид азота(2) NO
Оксид азота(2) NO Жидкие кристаллы
Жидкие кристаллы Важнейшие бинарные соединения
Важнейшие бинарные соединения Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы «Человек в мире веществ, материалов и химических реакций». «Химические вещества как строительные и поделочные материалы». М
«Человек в мире веществ, материалов и химических реакций». «Химические вещества как строительные и поделочные материалы». М