Содержание
- 2. Поверхностная энергия и межмолекулярные взаимодействия в однокомпонентных системах WK = 2σ WK ≈ nsZs|u11| σ =
- 3. f" σ =k1(fm - f ') δ К = σ/δ = k1(fm - f ') К
- 4. K ~ E ~ Рид ~ Нсубл/ Vm ~ σ/b ~|pT,max| где рT тах - максимальное
- 5. где А11 — константа Гамакера (Дж), которая зависит от числа молекул п в единице объема взаимодействующих
- 6. σ = σd + σn (по Фоуксу) Можно разделить поверхностную энергию на дисперсионную σd и недисперсионную
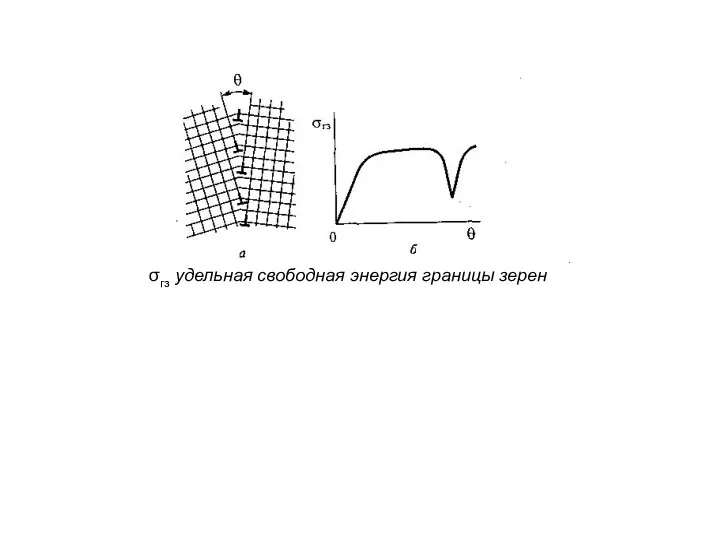
- 7. σгз удельная свободная энергия границы зерен
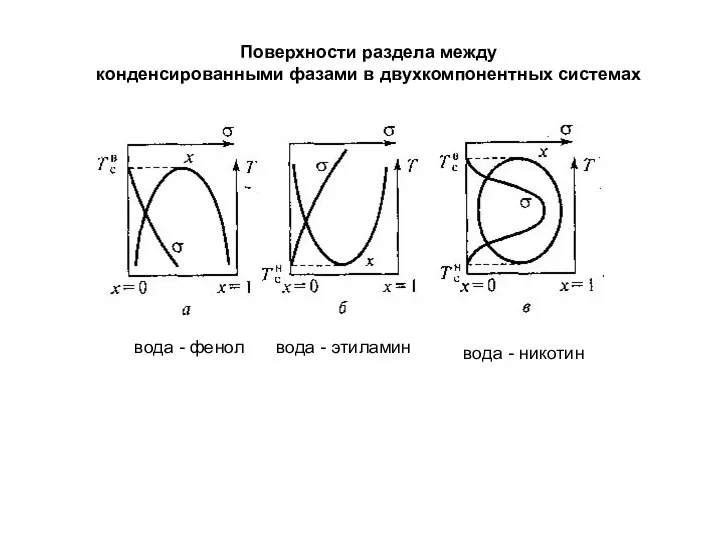
- 8. Поверхности раздела между конденсированными фазами в двухкомпонентных системах вода - фенол вода - этиламин вода -
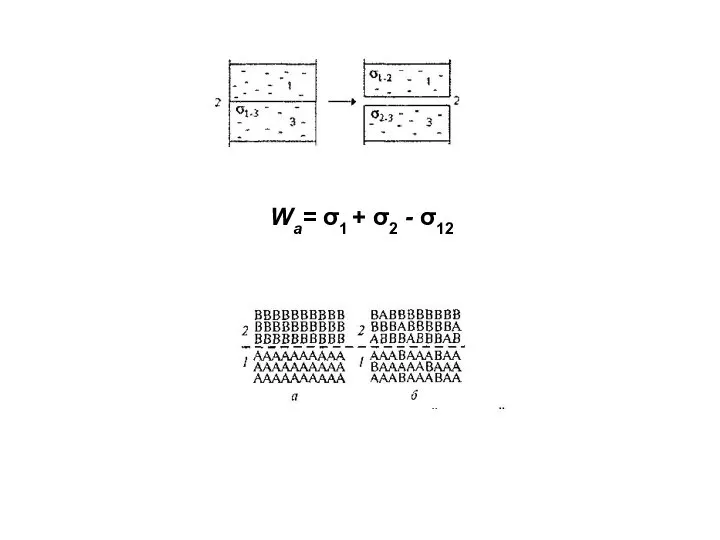
- 9. Wа= σ1 + σ2 - σ12
- 10. А* = АА + АВ - 2ААВ сложна константа Гамакера Согласно Ф. Фоуксу, Л. Джерифалко и
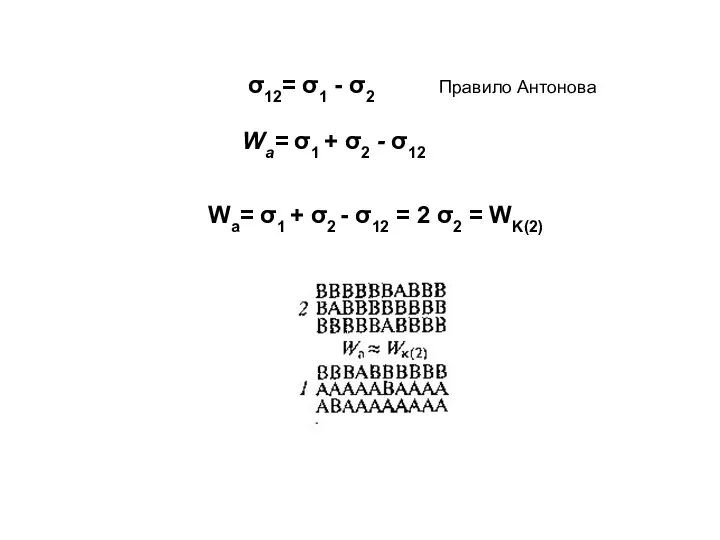
- 11. σ12= σ1 - σ2 Правило Антонова Wa= σ1 + σ2 - σ12 = 2 σ2 =
- 12. Смачивание и растекание σТГ = σТЖ + σЖГ cos θ Уравнение Юнга краевой угол острый: θ
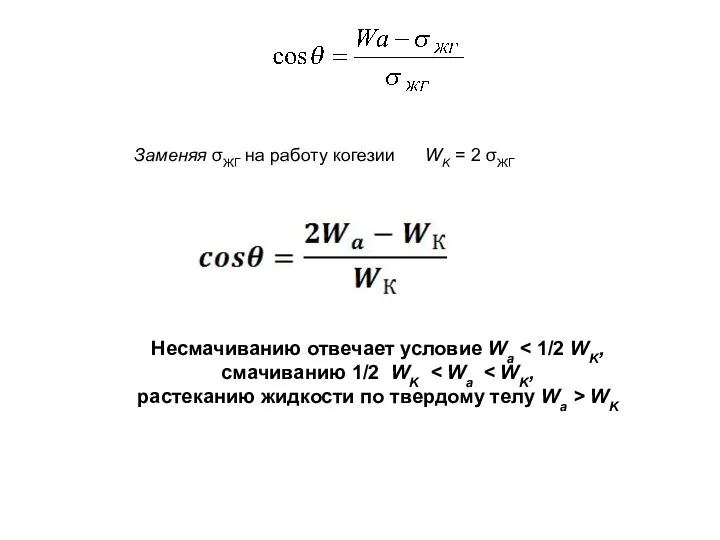
- 13. Заменяя σЖГ на работу когезии WK = 2 σЖГ Несмачиванию отвечает условие Wa смачиванию 1/2 WK
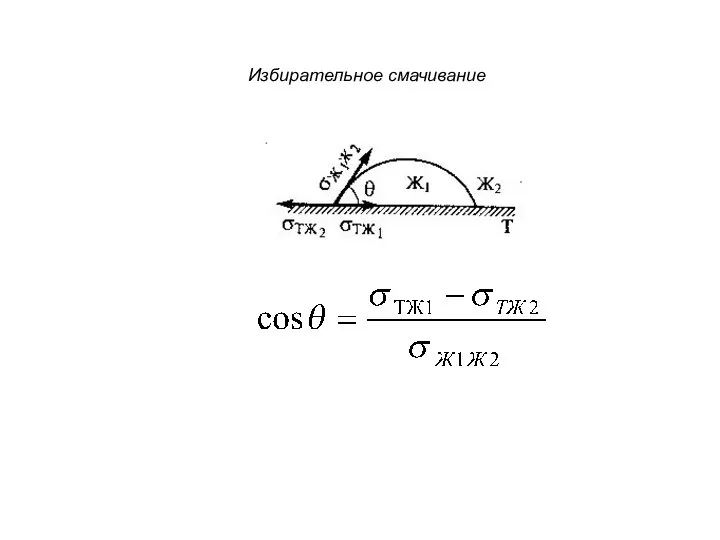
- 14. Избирательное смачивание
- 15. β = НВ/НМ Для гидрофильных поверхностей β > 1 Для гидрофобных поверхностей β
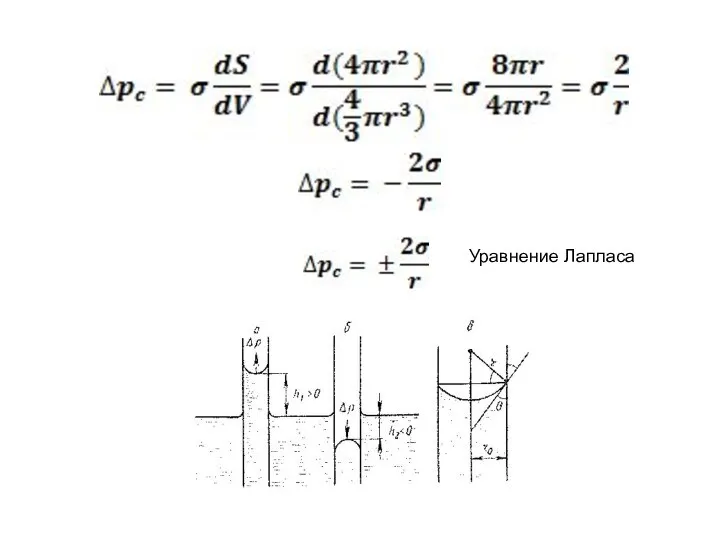
- 16. Капиллярное давление. Закон Лапласа. Δpc = ±(pr - p0) dG= pcdV + σdS При термодинамическом равновесии
- 17. Уравнение Лапласа
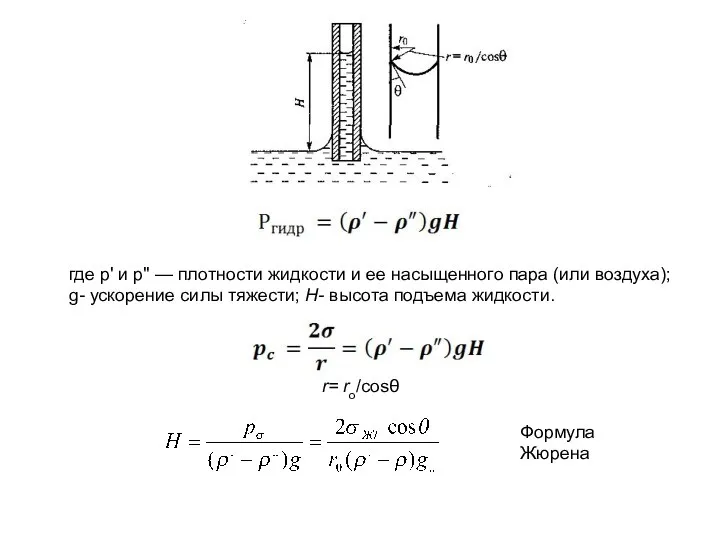
- 18. где р' и р" — плотности жидкости и ее насыщенного пара (или воздуха); g- ускорение силы
- 19. Уравнение Томсона (Кельвина) Δμ҆ = Δμ" Δμ' – приращение химпотенциале в жидкости Δμ" -приращение химпотенциале в
- 21. Скачать презентацию










 Петрография
Петрография Аморфные тела
Аморфные тела Химия S - элементов
Химия S - элементов Основания. Гидроксид лития
Основания. Гидроксид лития Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Элементарный состав живых организмов
Элементарный состав живых организмов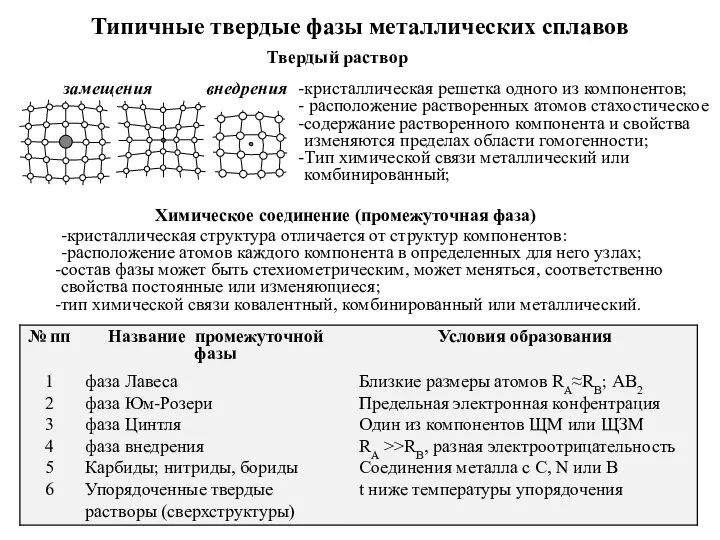 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Классификация лекарственных растений (ЛР) и лекарственного растительного сырья (ЛРС)
Классификация лекарственных растений (ЛР) и лекарственного растительного сырья (ЛРС) Теоретическое и прикладное материаловедение
Теоретическое и прикладное материаловедение Классификация органических веществ
Классификация органических веществ Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Пептиды. Тема 3
Пептиды. Тема 3 Элементы V группы Периодической системы химических элементов Д.И.Менделеева Работу выполнила учитель химии МОУ Северн
Элементы V группы Периодической системы химических элементов Д.И.Менделеева Работу выполнила учитель химии МОУ Северн Природный газ и нефть
Природный газ и нефть Физические свойства металлов. (9 класс)
Физические свойства металлов. (9 класс) Эмпирические правила
Эмпирические правила Химия вокруг нас
Химия вокруг нас Физические и химические свойства кислот
Физические и химические свойства кислот Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина Химические элементы человеческого организма и их свойства
Химические элементы человеческого организма и их свойства Курс лекций по химии
Курс лекций по химии Поняття про валентність. Ребус
Поняття про валентність. Ребус Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Радиоспектроскопические методы исследования, часть 1
Радиоспектроскопические методы исследования, часть 1 Теория химического строения А. М. Бутлерова. Часть III
Теория химического строения А. М. Бутлерова. Часть III Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов
Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов