Содержание
- 2. План 1. Комплексные соединения их структура и классификация. 2. Константа образования и константа нестойкости КС. Взаимосвязь
- 3. Номенклатура [Ag(NH3)2]Cl – хлорид диамминсеребра; K[Ag(CN)2] – дицианоаргентат калия; [Fe(SCN)3] – тритиоцианат железо.
- 4. Классификация По знаку заряда: а) катионные [Cu(NH3)4]2+; б) анионные [Fe(CN)6]4-; в) нейтральные[Fe(SCN)3]0 По принадлежности к определенному
- 5. Классификация По характеру связи между составными частями комплекса: а) внутрисферные имеют непосредственную (как пра-вило, координационную) связь
- 6. Классификация По числу центральных атомов: а) моноядерные; б) полиядерные. По скорости образования комплексов: а) лабильные; б)
- 7. Константа образования M(S)n + L ⮀ M(S)(n-1)L + S M(S)(n-1)L + L ⮀ M(S)(n-2)L2 + S
- 8. Константа образования или устойчивости β: M + L ↔ [ML] [ML] + L ↔ [ML2] M
- 9. Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+ + NH3 ⮀ [Ag(NH3)2]+
- 10. [Ag(NH3)2]Cl ⮀ [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ ⮀ [AgNH3]+ + NH3 [AgNH3]+ ⮀ Ag+ + NH3 [Ag(NH3)2]+
- 11. Константа нестойкости Кнест.
- 12. [Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+
- 13. [Ag(NH3)2]+ + I- → AgI↓+ 2NH3
- 14. Переведение комплексообразователя в другой, более прочный, комплексный ион [HgI4]2- + 4CN- ↔ [Hg(CN)4]2- + 4I- Кнест.[HgI4]2-
- 15. [ [М(NH3)n]2+ + nH+ → M2+ + nNH4+ где M = Cu2+, Cd2+, Co2+, Ni2+
- 16. Разрушение комплекса путем восстановления или окисления комплексообразователя 2[SbCl6]3- + 3Fe → 2Sb↓ + 3Fe2+ + 12Cl-
- 17. а) осуществляется ли реакция: AgСl + 2NH3 ⮀ [Ag(NH3)2]+
- 18. б) Возможен ли перевод катионов VI группы из осадков гидроксидов в раствор аммиакатов: Cu(OH)2 + 4NH3
- 20. Скачать презентацию

![Номенклатура [Ag(NH3)2]Cl – хлорид диамминсеребра; K[Ag(CN)2] – дицианоаргентат калия; [Fe(SCN)3] – тритиоцианат железо.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-2.jpg)
![Классификация По знаку заряда: а) катионные [Cu(NH3)4]2+; б) анионные [Fe(CN)6]4-; в)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-3.jpg)



![Константа образования или устойчивости β: M + L ↔ [ML] [ML]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-7.jpg)
![Ag+ + NH3 ⮀ [AgNH3]+ [AgNH3]+ + NH3 ⮀ [Ag(NH3)2]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-8.jpg)
![[Ag(NH3)2]Cl ⮀ [Ag(NH3)2]+ + Cl- [Ag(NH3)2]+ ⮀ [AgNH3]+ + NH3 [AgNH3]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-9.jpg)

![[Ag(NH3)2]Cl + 2H+ → AgCl↓ + 2NH4+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-11.jpg)
![[Ag(NH3)2]+ + I- → AgI↓+ 2NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-12.jpg)
![Переведение комплексообразователя в другой, более прочный, комплексный ион [HgI4]2- + 4CN-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-13.jpg)
![[ [М(NH3)n]2+ + nH+ → M2+ + nNH4+ где M = Cu2+, Cd2+, Co2+, Ni2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-14.jpg)
![Разрушение комплекса путем восстановления или окисления комплексообразователя 2[SbCl6]3- + 3Fe →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-15.jpg)
![а) осуществляется ли реакция: AgСl + 2NH3 ⮀ [Ag(NH3)2]+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/530778/slide-16.jpg)

 Кислоты
Кислоты Химический анализ веществ
Химический анализ веществ Кислоты. Физические свойства кислот
Кислоты. Физические свойства кислот Биохимия центральной нервной системы
Биохимия центральной нервной системы Карбоновые кислоты
Карбоновые кислоты Предмет физической и коллоидной химии. Термодинамика
Предмет физической и коллоидной химии. Термодинамика Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Поли- и гетерофункциональные соединения, участвующие в процессах жизнедеятельности  Химическая термодинамика и биоэнергетика. Второй закон термодинамики
Химическая термодинамика и биоэнергетика. Второй закон термодинамики Ацетилен
Ацетилен Диены. Тест. Учитель: Антонова Е.Л. Учитель: Антонова Е.Л.
Диены. Тест. Учитель: Антонова Е.Л. Учитель: Антонова Е.Л. Химические реакции органических соединений
Химические реакции органических соединений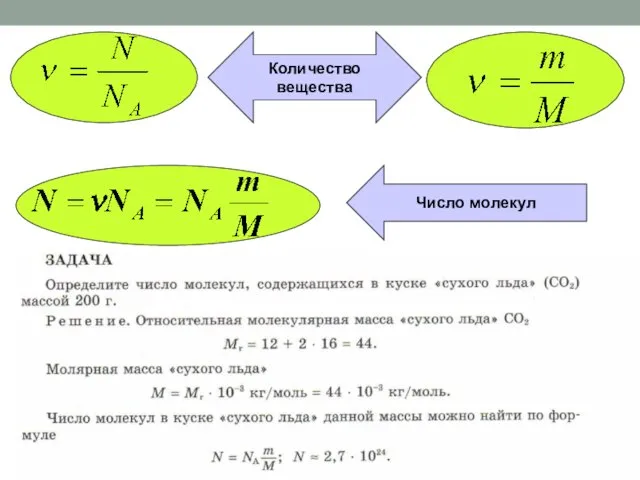 Агрегатные состояния вещества
Агрегатные состояния вещества Металдардың физикалық қасиеттерін ажырата білу
Металдардың физикалық қасиеттерін ажырата білу Хімія у нашому житті вода
Хімія у нашому житті вода  Огнеупорные материалы
Огнеупорные материалы Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас
Жиры – биологически важные органические соединения Работа ученицы 11а класса МБОУ СОШ № 26 Ногинского района Московской облас Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7
Тотығу-тотықсыздану титрлеу әдістері: перманганатометрия йодометрия хроматометрия. Дәріс № 7 Link reaction
Link reaction Химические соединения растительного и животного мира - углеводы
Химические соединения растительного и животного мира - углеводы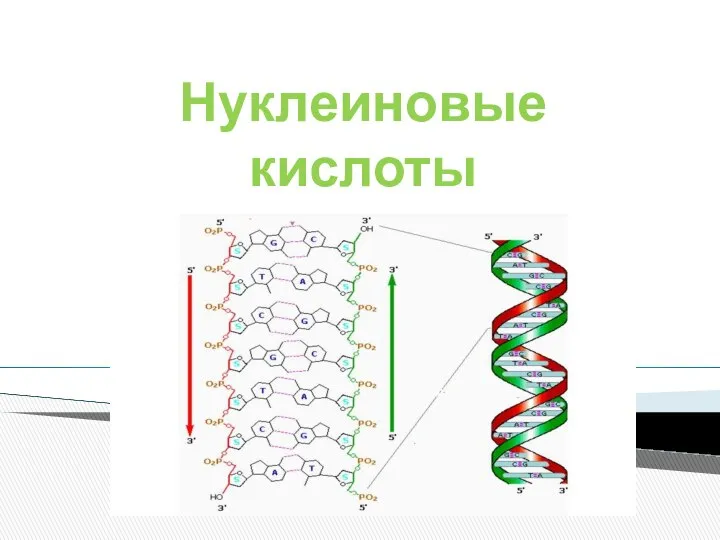 Нуклеиновые кислоты
Нуклеиновые кислоты КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ
КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ  Спазган: применение, форма, свойства, состав
Спазган: применение, форма, свойства, состав Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть
Презентация по Химии "Игра 9 класс. Знаешь ли ты классы неорганических веществ?" - скачать смотреть  Полівінілхлорид
Полівінілхлорид Минерал гранат
Минерал гранат Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Углерод и его соединения
Углерод и его соединения Реакции ионного обмена
Реакции ионного обмена