Содержание
- 2. оглавление 1)Определение реакциям 2)Протекание реакций ионного обмена а)реакции идущие с образованием осадка б)реакции идущие с образованием
- 3. Реакции, идущие с образованием осадка NaCl + AgNO3 = AgCl + NaNO3 Na+ + Cl- +
- 4. Реакции, идущие с выделением газа Na2CO3 +2HCl = 2NaCl + H2CO3 2Na+ + CO3- + 2H+
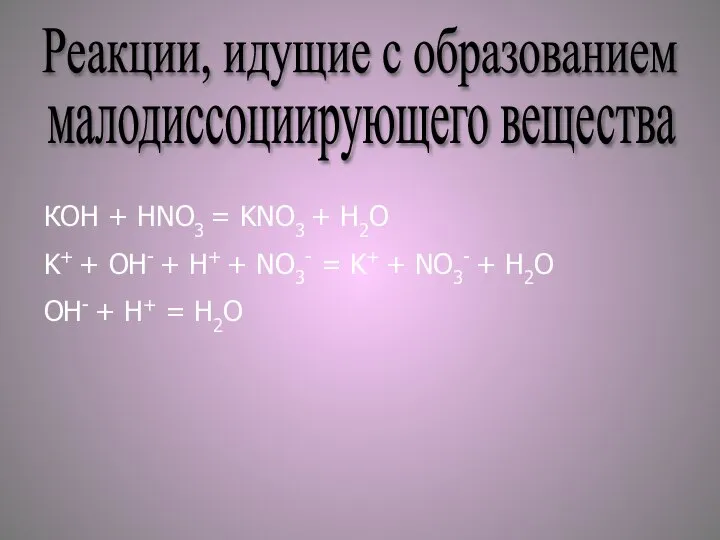
- 5. Реакции, идущие с образованием малодиссоциирующего вещества КOH + HNO3 = KNO3 + H2O K+ + OH-
- 6. обратимые реакции * Если в растворах нет таких ионов, которые могут связываться между собой с образованием
- 7. Особые случаи реакций ионного обмена a)ZnO + 2HCl = ZnCl2 + H2O ZnO + 2H+ +
- 8. Алгоритм составления ионных реакций 1. Записать молекулярное уравнение реакции, расставить коэффициенты. 2. Определить растворимые вещество в
- 10. Скачать презентацию






 Презентация Лепиды
Презентация Лепиды  Железо 9 класс - Презентация по Химии_
Железо 9 класс - Презентация по Химии_ Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация
Ступенчатые процессы получения полимеров: полиприсоединение, поликонденсация Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Материя и цвет. Свет
Материя и цвет. Свет Фуллерендер құрылымдары және олардың түрлерi
Фуллерендер құрылымдары және олардың түрлерi Соединения азота. Оксиды азота
Соединения азота. Оксиды азота Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Органическая химия. Фенолы
Органическая химия. Фенолы Презентация по Химии "Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева" - скачать смотреть
Презентация по Химии "Сходства и различия в теориях разбавленных растворов Аррениуса и Менделеева" - скачать смотреть  Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Новітні досягнення в хімії (9 клас)
Новітні досягнення в хімії (9 клас) Химия и производство
Химия и производство 11 хб
11 хб  Празеодим
Празеодим Презентация по Химии "Симметрия в мире химии: кристаллы" - скачать смотреть
Презентация по Химии "Симметрия в мире химии: кристаллы" - скачать смотреть  Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Классификация химических реакций по тепловому эффекту
Классификация химических реакций по тепловому эффекту Карбоновые кислоты
Карбоновые кислоты Второй закон термодинамики
Второй закон термодинамики Простые вещества – металлы. Общие физические свойства металлов.
Простые вещества – металлы. Общие физические свойства металлов.  УГЛЕВОДЫ И ЛИПИДЫ. ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТКИ Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Беша
УГЛЕВОДЫ И ЛИПИДЫ. ИХ РОЛЬ В ЖИЗНЕДЕЯТЕЛЬНОСТИ КЛЕТКИ Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Беша Вода – основа жизни на Земле
Вода – основа жизни на Земле Презентация по Химии "Полимеры" 10 класс
Презентация по Химии "Полимеры" 10 класс Гидролиз солей
Гидролиз солей Презентация по Химии "Силікатні матеріали: скло, кераміка, цемент" - скачать смотреть бесплатно
Презентация по Химии "Силікатні матеріали: скло, кераміка, цемент" - скачать смотреть бесплатно Вуглеводи
Вуглеводи Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер
Ерітінділер түрлері. Идеал ертітінділер және реал ерітінділер. Ерітіндінің пайыздық концентрациясына eсептер