Содержание
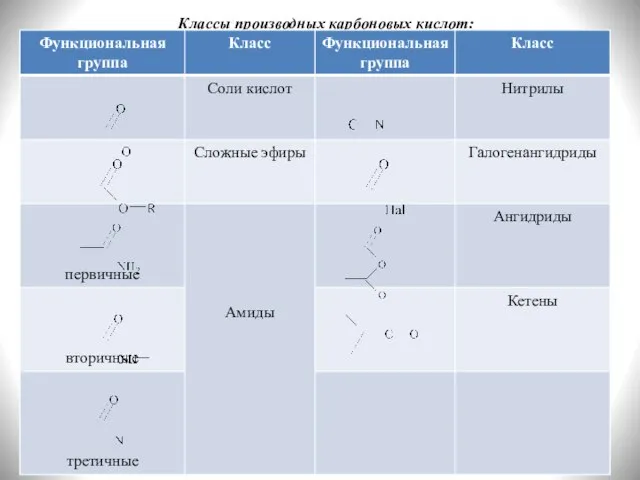
- 2. Классы производных карбоновых кислот:
- 3. ! Гидролиз любого производного карбоновой кислоты всегда ведет к образованию исходной карбоновой кислоты Основная роль производных
- 4. I Соли карбоновых кислот Распределение отрицательного заряда с атома кислорода за счет эффекта сопряжения гасит δ+
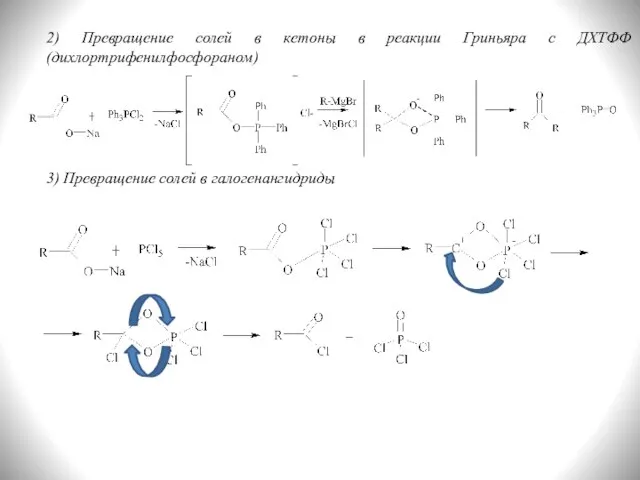
- 5. 2) Превращение солей в кетоны в реакции Гриньяра с ДХТФФ (дихлортрифенилфосфораном) 3) Превращение солей в галогенангидриды
- 6. 4) Превращение солей Ca, Ba, Th, Mn в кетоны в процессе пиролиза 5) Реакция Хунсдиккера-Бородина II
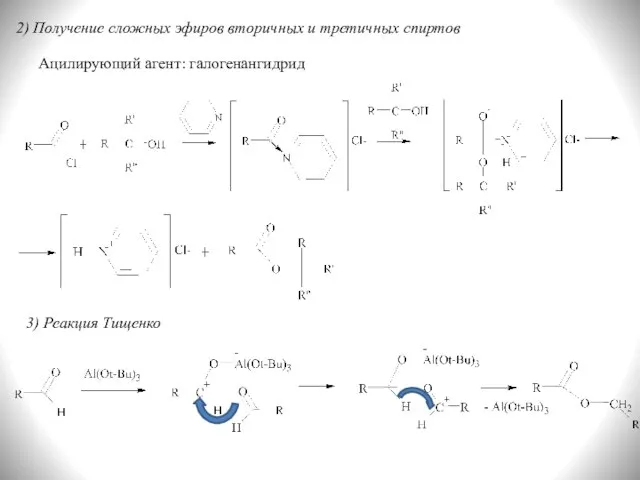
- 7. 2) Получение сложных эфиров вторичных и третичных спиртов Ацилирующий агент: галогенангидрид 3) Реакция Тищенко
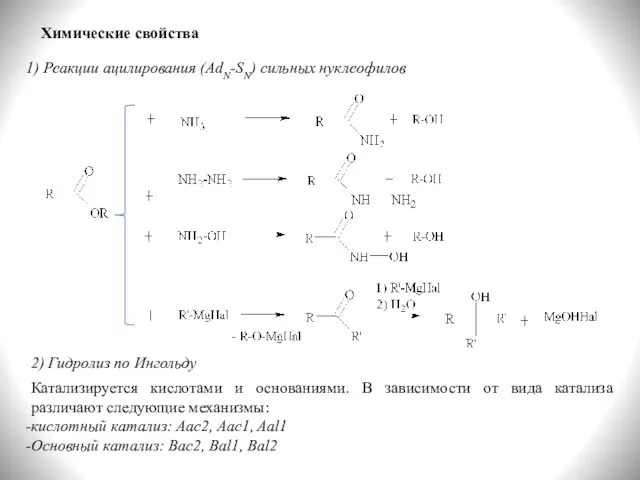
- 8. Химические свойства 1) Реакции ацилирования (AdN-SN) сильных нуклеофилов 2) Гидролиз по Ингольду Катализируется кислотами и основаниями.
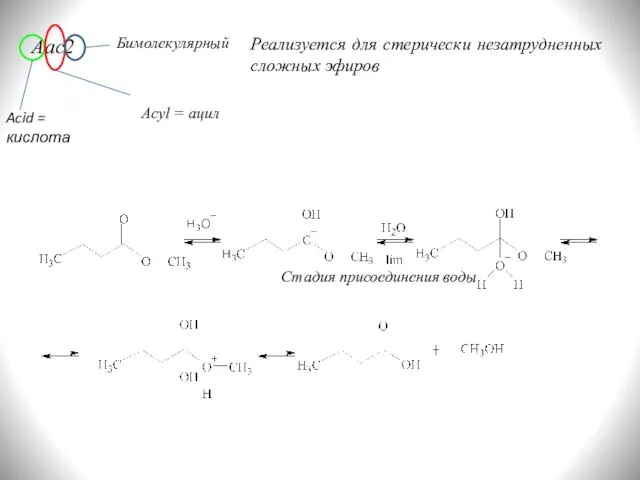
- 9. Aac2 Acid = кислота Acyl = ацил Бимолекулярный Реализуется для стерически незатрудненных сложных эфиров Стадия присоединения
- 10. Aac1 Реализуется для стерически затрудненных сложных эфиров (пространственное затруднение со стороны ацильной группы) Мономолекулярный Стадия диссоциации
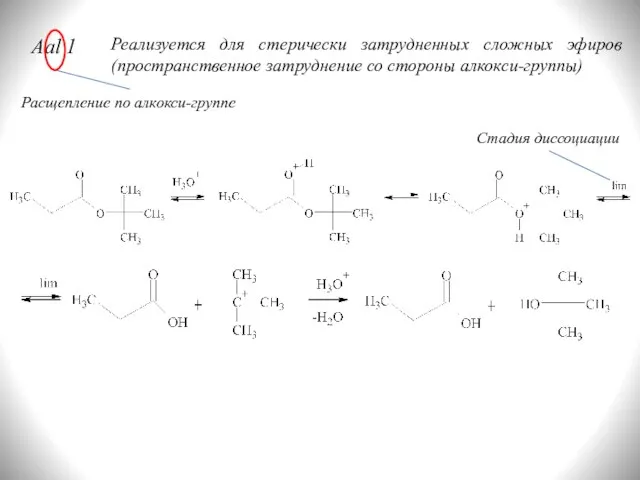
- 11. Aal 1 Реализуется для стерически затрудненных сложных эфиров (пространственное затруднение со стороны алкокси-группы) Расщепление по алкокси-группе
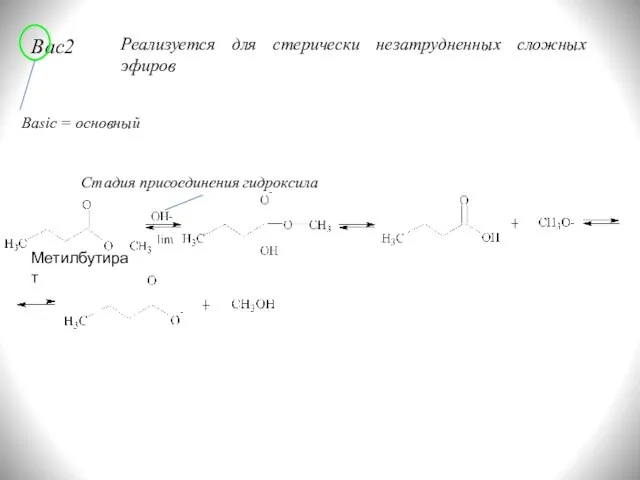
- 12. Bac2 Basic = основный Реализуется для стерически незатрудненных сложных эфиров Стадия присоединения гидроксила Метилбутират
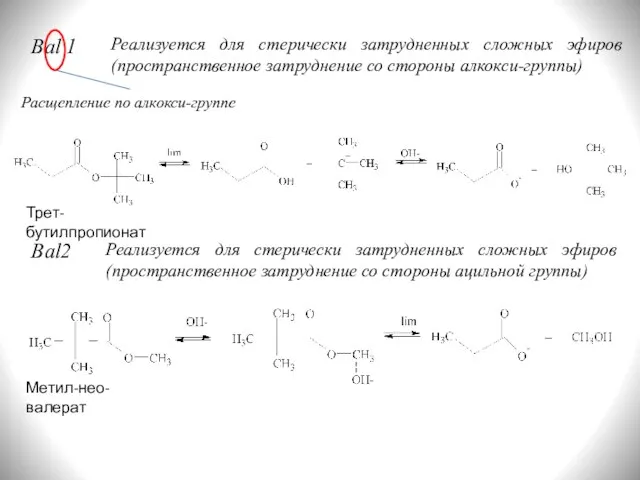
- 13. Bal 1 Реализуется для стерически затрудненных сложных эфиров (пространственное затруднение со стороны алкокси-группы) Расщепление по алкокси-группе
- 14. 3) Реакция переэтерификации Протекает до конца в случае замещения более сильным нуклеофилом более слабый 4) Сложноэфирная
- 16. 5) Ацилоиновая конденсация Соотношение эфир : натрий = 1 : 2 ацилоин Механизм:
- 17. 6) Восстановление сложных эфиров а) Восстановление по Буво-Блану Условия проведения реакции похожи на ацилоиновую конденсацию, но
- 18. III Амиды Методы получения 1) Термическая дегидратация аммонийных солей карбоновых кислот 2) Ацилирование аммиака, первичных и
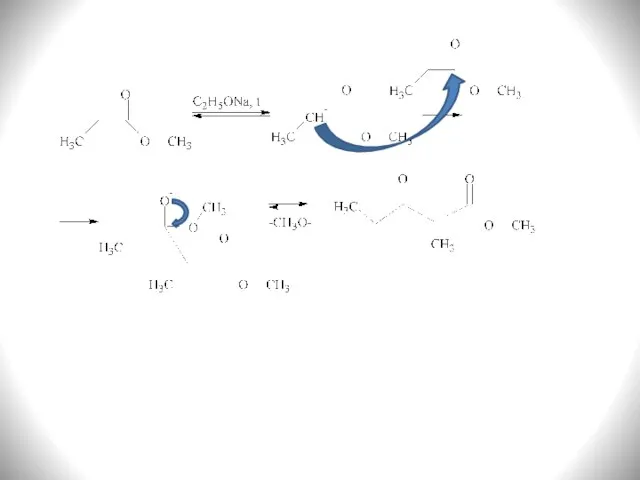
- 19. Химические свойства 1) Гидролиз Процесс обратимый. Катализируется кислотами и основаниями. Требует более жестких условий, чем гидролиз
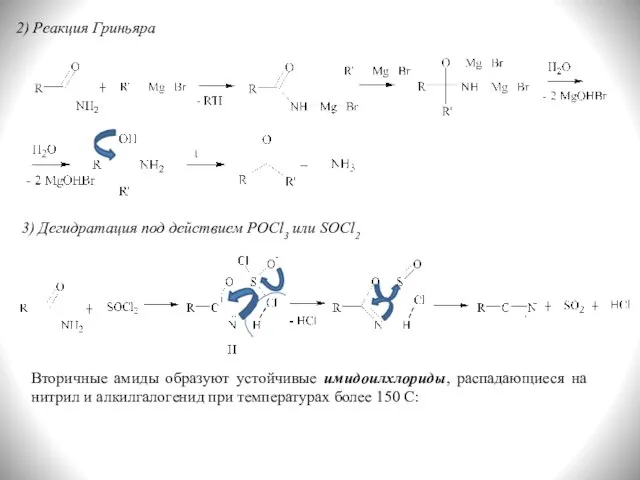
- 20. 2) Реакция Гриньяра 3) Дегидратация под действием POCl3 или SOCl2 Вторичные амиды образуют устойчивые имидоилхлориды, распадающиеся
- 21. имидоилхлорид 4) Нитрозирование Условия: NaNO2, HCl Эта реакция является качественной на первичные амиды (происходит диазотирование с
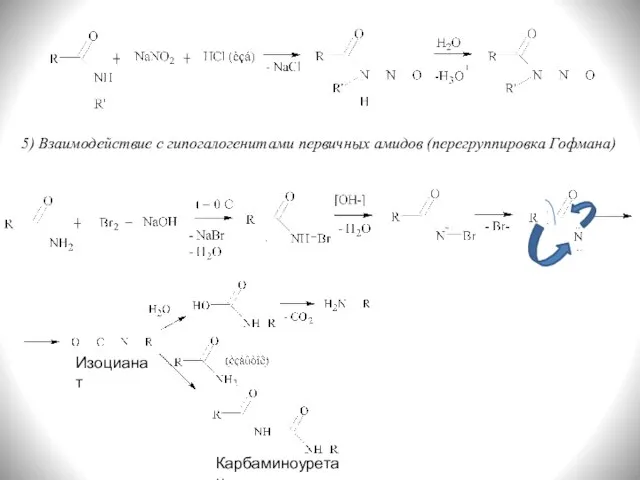
- 22. 5) Взаимодействие с гипогалогенитами первичных амидов (перегруппировка Гофмана) Карбаминоуретан Изоцианат
- 23. 6) Восстановление с Li[AlH4]
- 24. IV Нитрилы Методы получения 1) SN при взаимодействии алкилгалогенидов с цианидом калия 2) Дегидратация оксимов 3)
- 25. Химические свойства 1) Гидролиз Процесс обратимый. Катализируется кислотами и основаниями. Требует еще более жестких условий, чем
- 26. 2) Реакция Гриньяра 3) Восстановление с Li[AlH4]
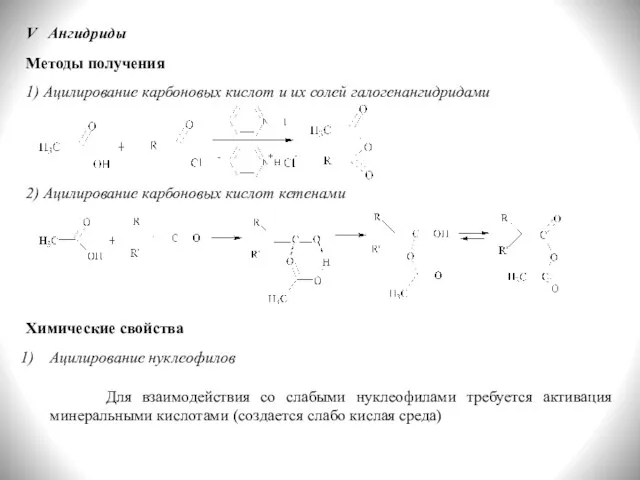
- 27. V Ангидриды Методы получения 1) Ацилирование карбоновых кислот и их солей галогенангидридами 2) Ацилирование карбоновых кислот
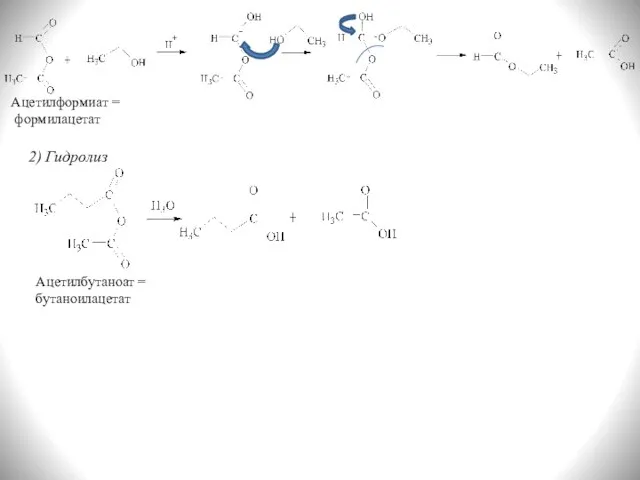
- 28. 2) Гидролиз Ацетилформиат = формилацетат Ацетилбутаноат = бутаноилацетат
- 29. V Галогенангидриды Методы получения Галогенирование карбоновых кислот галогенирующими агентами Галогенирующие агенты: PCl5, PCl3, PBr5, PBr3, SOCl2
- 31. Скачать презентацию










![6) Восстановление с Li[AlH4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/592512/slide-22.jpg)


![2) Реакция Гриньяра 3) Восстановление с Li[AlH4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/592512/slide-25.jpg)

 Валентность
Валентность Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии
Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии Органикалық қосылыстардың жіктелуі
Органикалық қосылыстардың жіктелуі Сопряженное присоединение. Циклоприсоединениеie
Сопряженное присоединение. Циклоприсоединениеie Номенклатура органических соединений
Номенклатура органических соединений Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Применение солей
Применение солей  Классы неорганических соединений. Индивидуальные задания
Классы неорганических соединений. Индивидуальные задания Углеводороды. Свойства алканов
Углеводороды. Свойства алканов Ртуть. Нахождение в природе. Применение
Ртуть. Нахождение в природе. Применение Химические компоненты клетки. Неорганические компоненты
Химические компоненты клетки. Неорганические компоненты Презентация по Химии "Синтетические материалы" - скачать смотреть
Презентация по Химии "Синтетические материалы" - скачать смотреть  Мило. Мийні засоби
Мило. Мийні засоби  Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет
Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет Горные породы: гранит, базальт
Горные породы: гранит, базальт Хочу хорошо сдать ЕГЭ
Хочу хорошо сдать ЕГЭ Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей
Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей  Подготовка к лабораторной работе
Подготовка к лабораторной работе Фосфор, фосфор оксидтері
Фосфор, фосфор оксидтері Биохимия печени
Биохимия печени Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард
Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард  Классификация минералов
Классификация минералов Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид
Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина
Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина Сульфиды и им подобные соединения
Сульфиды и им подобные соединения Текстуры метаморфических пород
Текстуры метаморфических пород Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические