Содержание
- 2. 1. Сформировать понятия об электролитах и неэлектролитах. 2. Рассмотреть механизм диссоциации веществ с ковалентной полярной и
- 3. Растворы (дисперсные системы) Раствор – это однофазная система переменного, или гетерогенного, состава, состоящая из двух или
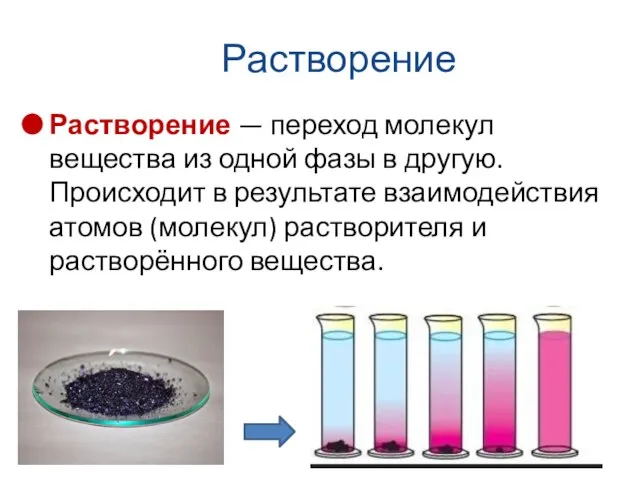
- 28. Растворение Растворение — переход молекул вещества из одной фазы в другую. Происходит в результате взаимодействия атомов
- 29. Растворение При растворении межфазная граница исчезает, при этом меняются физические свойства раствора (например, плотность, вязкость, иногда
- 30. Дисперсная система, фаза, среда Дисперсная система - гетерогенные системы, в которых одна из фаз находится в
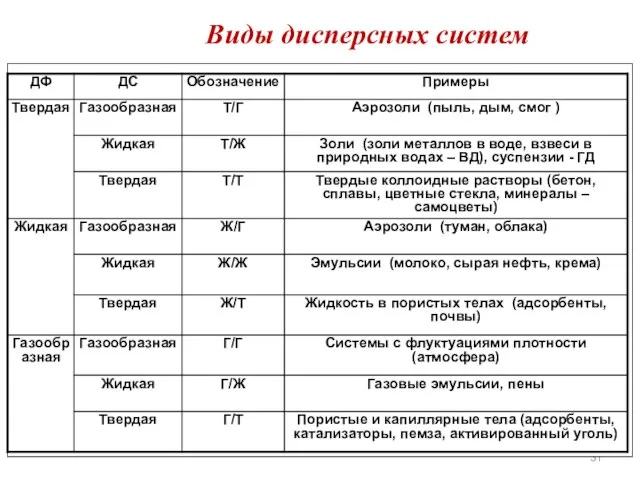
- 31. Виды дисперсных систем
- 32. По величине частиц дисперсной фазы растворы разделяют на: Грубодисперсные системы(взвеси) – это гетерогенные системы (неоднородные). Размеры
- 33. По величине частиц дисперсной фазы растворы разделяют на: Коллоидные растворы (тонкодисперсные системы или золи) – это
- 34. По величине частиц дисперсной фазы растворы разделяют на: Истинные растворы. Размеры частиц составляют 10ˉ8 см (менее
- 35. Растворимость Растворимость выражают при помощи массы вещества, которая может раствориться в 100 г воды при данной
- 36. Растворимость Если молекулы растворителя неполярны или малополярны, то этот растворитель будет хорошо растворять вещества с неполярными
- 37. Растворители К полярным растворителям относят воду и глицерин. К малополярным спирт и ацетон. К неполярным хлороформ,
- 38. Виды растворов В зависимости от растворимости твердых веществ различают следующие виды растворов: Ненасыщенный раствор Раствор, в
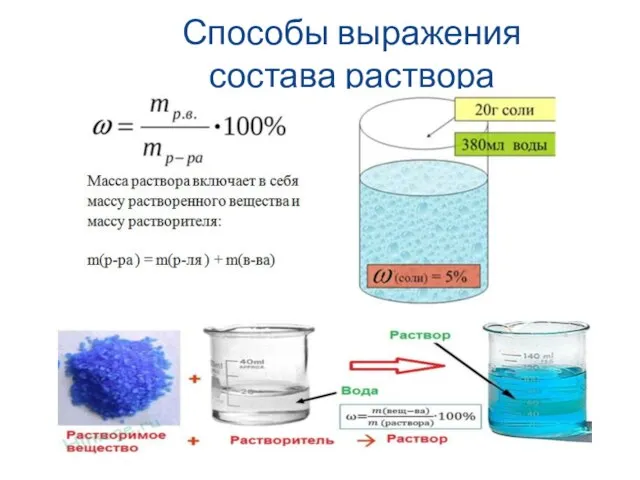
- 39. Способы выражения состава раствора
- 40. Д а н о: m(р-ра) = 100 г; m(ВаСl2) = 20 г. Найти: w%(ВаСl2) Решение: w(BaCl2)=m(ВаСl2)/m(р-ра)=20г/100г=0,2
- 41. Д а н о: m(H2O) = 20 г; m(сахара) = 5 г. Найти: w%(сахара) Решение: 1.
- 42. Выражение концентраций растворов. Молярность - число молей растворенного вещества в 1 л раствора. ʋ - количество
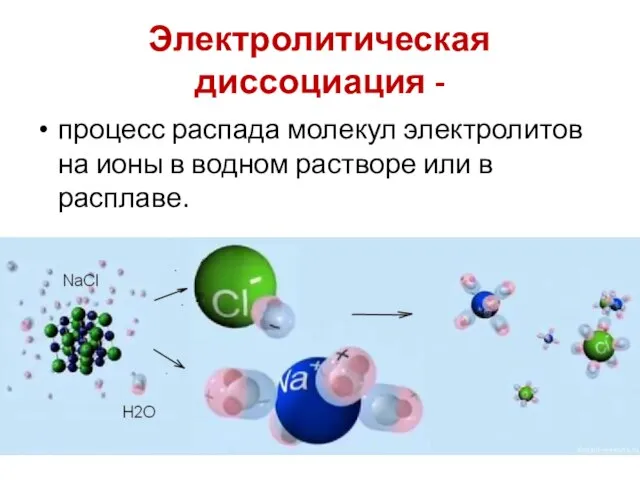
- 43. Электролитическая диссоциация - процесс распада молекул электролитов на ионы в водном растворе или в расплаве.
- 44. В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В
- 45. Что такое электрический ток? Какие вещества способны проводить эл.ток? Какие частицы являются переносчиками эл.тока в металлах,
- 46. Электрический ток - направленное движение заряженных частиц (электроны, ионы) Ионы - атомы или группы атомов, имеющие
- 47. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все вещества по их способности
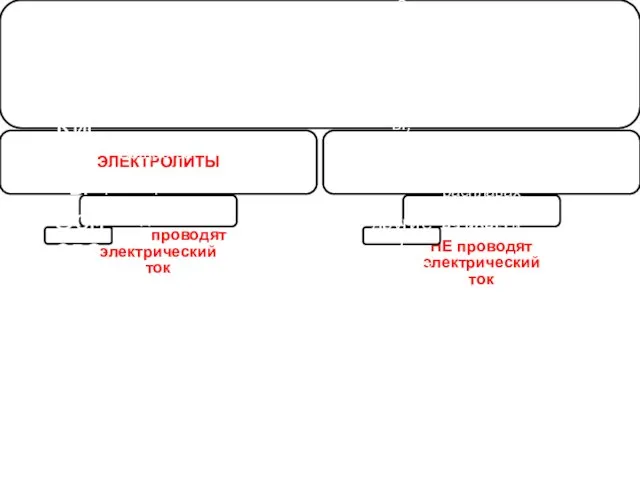
- 48. ВЕЩЕСТВА ЭЛЕКТРОЛИТЫ Вещества, которые в водных растворах или расплавах распадаются на ионы и проводят электрический ток
- 49. Основные положения ТЭД 1. Молекулы электролитов диссоциируют на положительно заряженные ионы (катионы) и отрицательно заряженные ионы
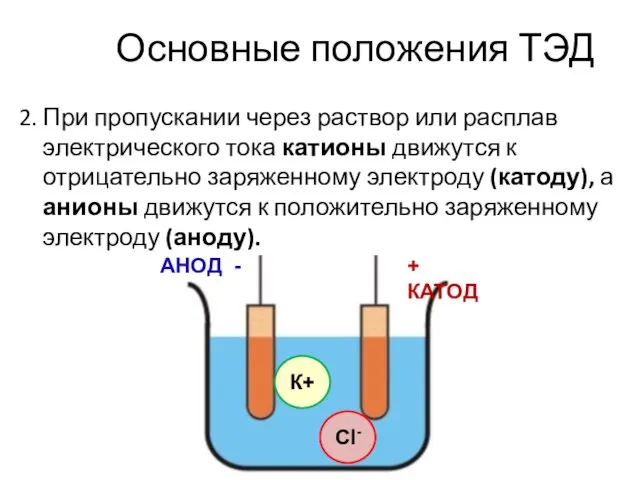
- 50. Основные положения ТЭД 2. При пропускании через раствор или расплав электрического тока катионы движутся к отрицательно
- 51. Основные положения ТЭД Диссоциация многих электролитов —процесс обратимый. Это значит, что одновременно идут два противоположных процесса:
- 52. Уравнение диссоциации Диссоциацию молекул электролитов выражают уравнениями, в которых ставят знак обратимости ( ). Пример, уравнение
- 53. Уравнение диссоциации Общая сумма зарядов катионов равна общей сумме зарядов анионов, так как растворы и расплавы
- 54. Диссоциация оснований Применимo только к водным растворам!!! Основание - электролит, который диссоциирует в водном растворе с
- 55. Гидролиз солей Гидролиз солей – это взаимодействие солей с водой В результате гидролиза соли в растворе
- 56. Закономерности гидролиза разбавленных растворов солей: Протекает: Гидролиз соли слабого основания и сильной кислоты Гидролиз соли слабой
- 57. Домашнее задание:
- 58. Добрый день, уважаемые студенты! Работы с домашним заданием по химии направлять до 07 ноября 2021г. на
- 59. Электролиты Неэлектролиты Диполь Диссоциация Ионизация Гидратированные ионы Процесс распада электролита на ионы. Вещества, растворы которых проводят
- 60. Задания к 1-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества, которые
- 61. Задания ко II-му положению ТЭД Сформулируйте второе положение ТЭД. Что такое электролитическая диссоциация? Что является причиной
- 63. Скачать презентацию






















































 Перечень практических навыков по общей химии для экзамена
Перечень практических навыков по общей химии для экзамена Химия вокруг нас
Химия вокруг нас Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Минералдарды зерттеу әдістері
Минералдарды зерттеу әдістері Биохимия
Биохимия Эколого-геохимическая оценка состояния компонентов природной среды особо охраняемых территорий. Парк Смоленское Поозерье
Эколого-геохимическая оценка состояния компонентов природной среды особо охраняемых территорий. Парк Смоленское Поозерье Типы химических реакций
Типы химических реакций Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Химия және денсаулық
Химия және денсаулық Атомная энергетика
Атомная энергетика Титан как элемент
Титан как элемент Алюминий. Сплавы алюминия. Учитель: Белозерова Татьяна Анатольевна Учени
Алюминий. Сплавы алюминия. Учитель: Белозерова Татьяна Анатольевна Учени Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов
Углеводороды и их природные источники. Гомологический ряд алканов. Строение алканов Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О
Каталитическая активность ферментов Работу выполнили: Кичаева Нина Иванькова Елена Ученицы 10 класса МОУ Сергиевской СОШ №1 «О Метаболизм - обмен веществ
Метаболизм - обмен веществ Химия актиноидов
Химия актиноидов Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ  Лекция №6. Применение закона действующих масс к окислительно-восстановительным равновесиям
Лекция №6. Применение закона действующих масс к окислительно-восстановительным равновесиям Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер
Химиялық термодинамиканың негіздері. Негізгі түсініктері мен аңдары. Термохимиялық есептеулер Кетоновые тела
Кетоновые тела Нанохимия, как наука
Нанохимия, как наука Autoionization of water Hydrolysis of salts
Autoionization of water Hydrolysis of salts Строение гетероциклических соединений
Строение гетероциклических соединений Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Чипсы, вред или польза
Чипсы, вред или польза Бродильні мікроорганізми і бродіння. Лекція 5
Бродильні мікроорганізми і бродіння. Лекція 5