Содержание
- 2. Окислительно-восстановительные реакции Окисление – это процесс, при котором происходит отдача электронов атомом, молекулой или ионом: Na°
- 5. Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и е – в дыхательной цепи
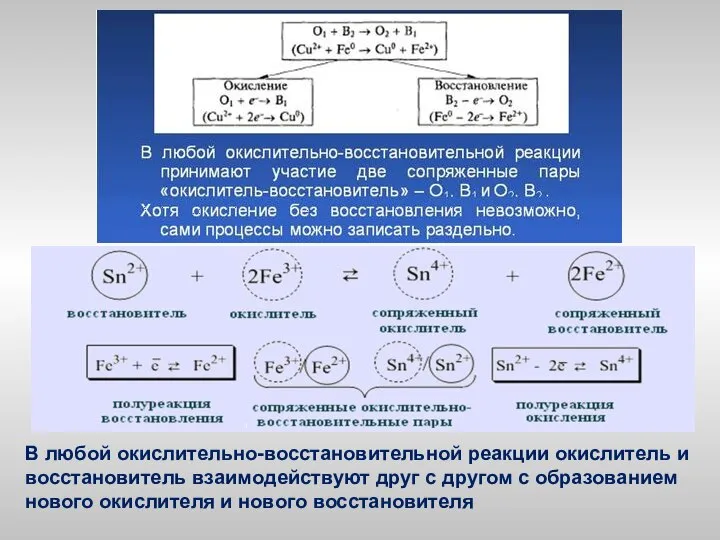
- 6. В любой окислительно-восстановительной реакции окислитель и восстановитель взаимодействуют друг с другом с образованием нового окислителя и
- 8. Количественное описание ОВР Например, чем сильнее основание, тем больше его сродство в протону. Также и сильный
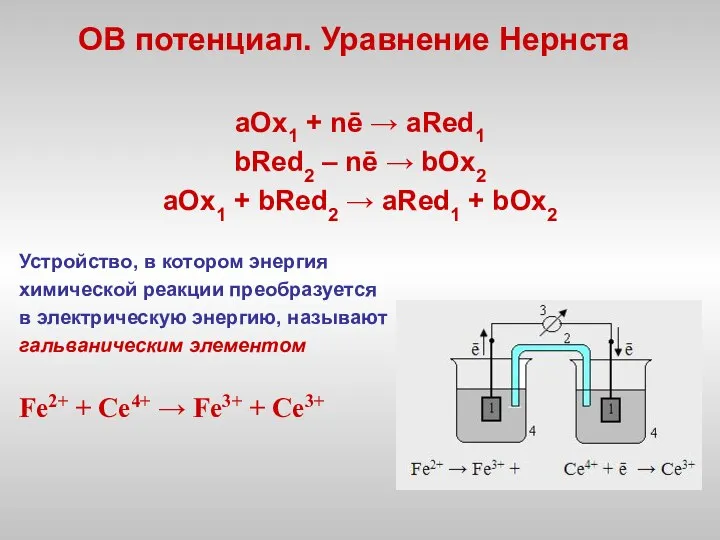
- 9. ОВ потенциал. Уравнение Нернста аОх1 + nē → аRed1 bRed2 – nē → bOx2 aOx1 +
- 10. Стандартный водородный электрод Потенциал отдельной редокс-пары измерить невозможно Потенциал стандартного водородного электрода принимают равным нулю ЭДС
- 11. Направление протекания ОВ реакции Учет знака потенциала ОВ реакции (Е = Е1 – Е2) позволяет определить
- 12. ΔG = -nFE ΔG 0 ΔG > 0, Е ΔG = 0, Е = 0 При
- 13. Константа равновесия ОВ реакции aOx2+ bRed1 → cRed2+ dOx1 Уранения Нернста для ОВ пар n –
- 14. После несложного преобразования получаем Под знаком логарифма находится выражение константы равновесия, поэтому можно записать Приведенные уравнения
- 15. Проведя математические операции, получим: К = 1021
- 16. Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при 20 0С следующее уравнение:
- 17. Например, в цериметрии (окислитель Се4+): Fe2+ + Се4+ = Fe3+ + Се3+ К = 1011,4 =
- 18. Устойчивость водных растворов окислителей и восстановителей Наибольшее практическое значение имеет полуреакция: О2 + 4Н+ + 4ē
- 20. Скачать презентацию















 Ферроцен. Свойства, получение и применение
Ферроцен. Свойства, получение и применение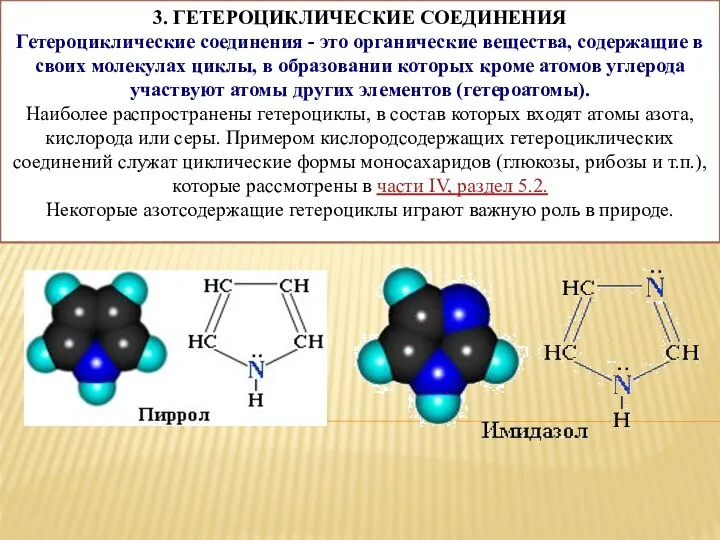 Гетероциклические соединения
Гетероциклические соединения Уравнение материального баланса для элементарного объема проточного химического реактора
Уравнение материального баланса для элементарного объема проточного химического реактора Технология производства и свойства искусственных волокон
Технология производства и свойства искусственных волокон Биохимия нервной ткани. Биологические мембраны
Биохимия нервной ткани. Биологические мембраны Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов
Элементы VIIА-группы (галогены). Группа самых электроотрицательных элементов Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Органические вещества спирты
Органические вещества спирты Тема 3
Тема 3 Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості Каталитический риформинг
Каталитический риформинг Тепловой эффект химических реакций
Тепловой эффект химических реакций Э.М. Спиридонов. Эволюция минералов цинка в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов цинка в зоне гипергенеза Алкадиены
Алкадиены Жидкие кристаллы
Жидкие кристаллы Сероводоро́д, сернистый водород (H2S) (физические свойства)
Сероводоро́д, сернистый водород (H2S) (физические свойства) Химический состав микроорганизмов-деструкторов
Химический состав микроорганизмов-деструкторов Изделия на основе углеволокон
Изделия на основе углеволокон Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ
ЛЕКЦИЯ 2. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ и КЛЕТОЧНЫЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ. ГЕНЕТИЧЕСКИЙ МАТЕРИАЛ и его ХАРАКТЕРИСТИКИ. РЕПЛИКАЦИ Спирти. Феноли. Етери
Спирти. Феноли. Етери Зинин Николай Николаевич
Зинин Николай Николаевич Инструментальные методы анализа
Инструментальные методы анализа Презентация по Химии "Классификация и номенклатура неорганических соединений" - скачать смотреть
Презентация по Химии "Классификация и номенклатура неорганических соединений" - скачать смотреть  Знание химии в строительном деле на бытовом уровне
Знание химии в строительном деле на бытовом уровне Синтез олигомеров этиленгликоля и терефталевой кислоты
Синтез олигомеров этиленгликоля и терефталевой кислоты Нефть в США. История. Запасы и прогноз
Нефть в США. История. Запасы и прогноз Презентация по Химии "Азотная кислота и ее соли" - скачать смотреть
Презентация по Химии "Азотная кислота и ее соли" - скачать смотреть