Содержание
- 2. N, P, As, Sb и Bi - элементы главной подгруппу V группы периодической системы. Электронная конфигурация
- 3. Азот. В природе: NaNO3 (чилийская или натриевая селитра) и калия KNO3 (индийская или калиевая селитра). Осадки
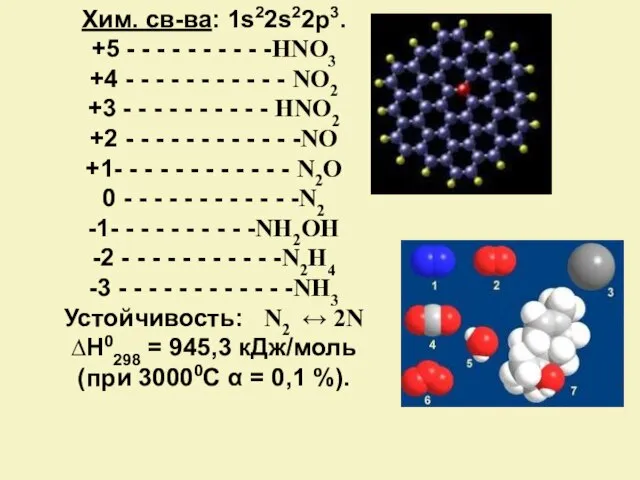
- 4. Хим. св-ва: 1s22s22p3. +5 - - - - - - - - - -HNO3 +4 -
- 5. Ст.ок. -3 Нитриды: основные (Na3N, Mg3N2), амфотерные (AlN), кислотные (Si3N4). Необратимый гидролиз: Li3N + 3H2O →
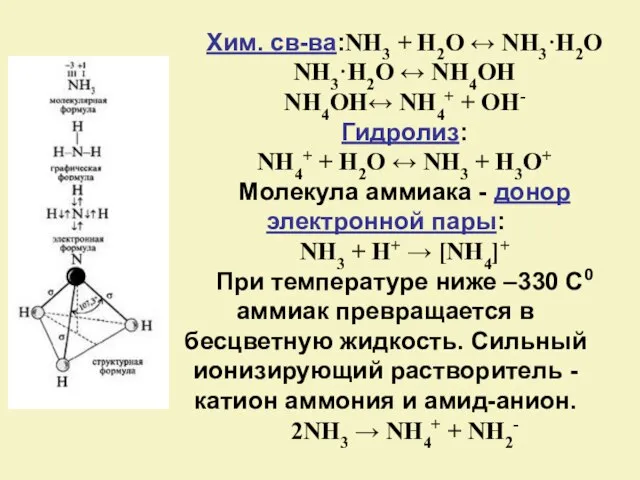
- 6. Хим. св-ва:NH3 + H2O ↔ NH3·H2O NH3·H2O ↔ NH4OH NH4OH↔ NH4+ + OH- Гидролиз: NH4+ +
- 7. Производные NH4OH (NH4Cl, NH4NO3) - кислотные свойства, а производные NH2- амиды, как основания: KNH2 + NH4Cl
- 8. C щелоч. и щел-зем. Ме образует амиды металлов: 2Na + 2NH3 → 2NaNH2 + H2 Соли
- 9. Соли аммония - реакционноспособны. NH4Cl (нашатырь) - для удаления оксидных пленок:4CuO + 2NH4Cl → 3Cu +
- 10. N2H4 – ионизир. растворитель, щелочная реакция: N2H4 + H2O = N2H5+ + OH- N2H5+ + H2O
- 11. Получают а). Пропуская NO и H2 через Pt: 2NO + 3H2 → 2NH2OH б). Восстановление путем
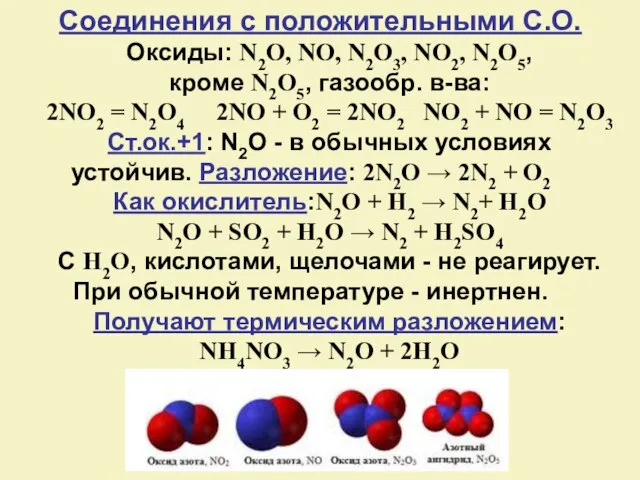
- 12. Оксиды: N2O, NO, N2O3, NO2, N2O5, кроме N2O5, газообр. в-ва: 2NO2 = N2O4 2NO + O2
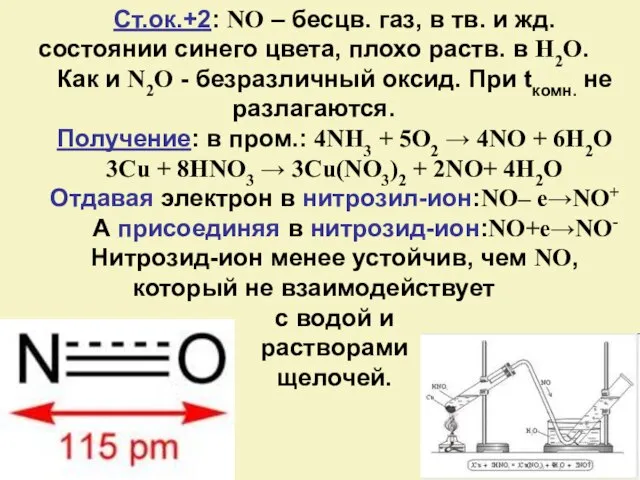
- 13. Ст.ок.+2: NO – бесцв. газ, в тв. и жд. состоянии синего цвета, плохо раств. в H2O.
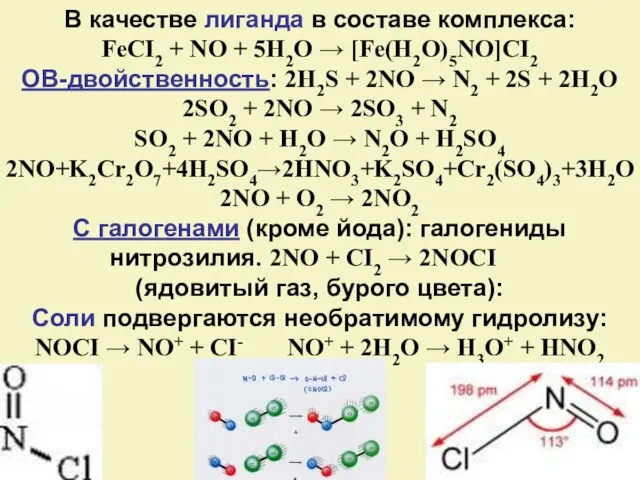
- 14. В качестве лиганда в составе комплекса: FeCI2 + NO + 5H2O → [Fe(H2O)5NO]CI2 ОВ-двойственность: 2H2S +
- 15. Ст.ок.+3: оксид N2O3, HNO2 и ее солях. N2O3 - бурый яд. газ, при t ниже –400С
- 16. В конц. р-ах или при высоких температурах распадается: 3HNO2 → HNO3 + 2NO + H2O Разлагается:
- 17. Нитриты щел. Ме плавятся, а остальные разлагаются: Ca(NO2)2 → CaO + NO2 + NO AgNO2 →
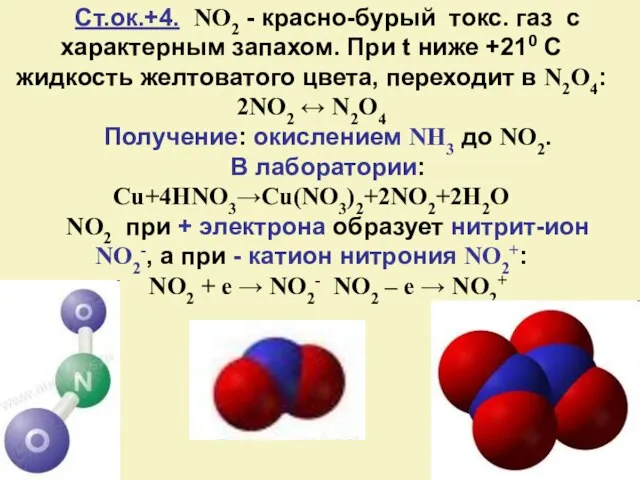
- 18. Ст.ок.+4. NO2 - красно-бурый токс. газ с характерным запахом. При t ниже +210 С жидкость желтоватого
- 19. Диспропорционирование: 2NO2+H2O→HNO2+HNO3 2NO2 + 2KOH → KNO2 + KNO3 + H2O C водой: 4NO2 + O2
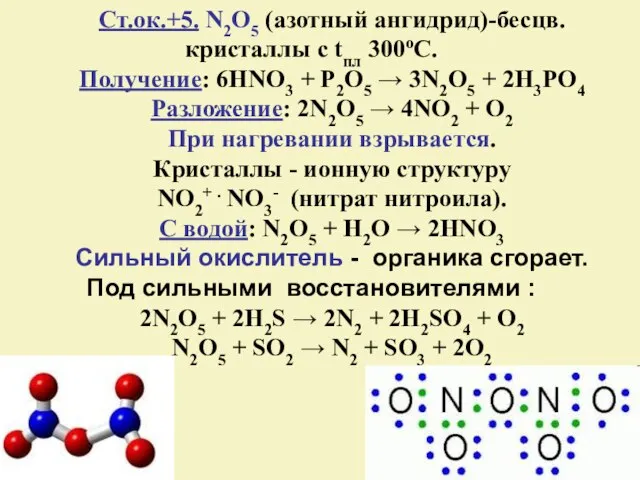
- 20. Ст.ок.+5. N2O5 (азотный ангидрид)-бесцв. кристаллы с tпл 300оС. Получение: 6HNO3 + P2O5 → 3N2O5 + 2H3PO4
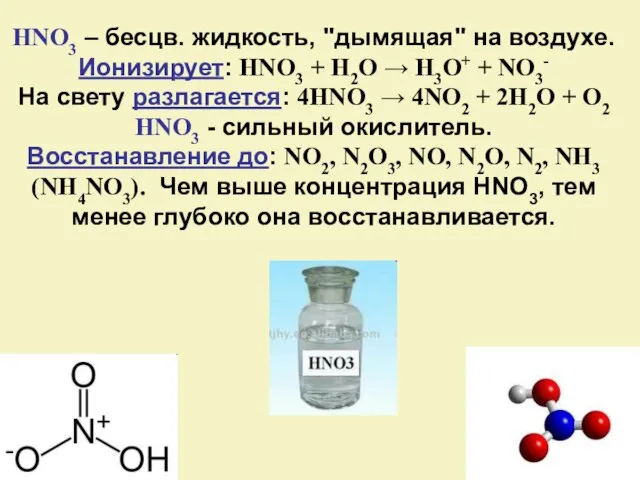
- 21. HNO3 – бесцв. жидкость, "дымящая" на воздухе. Ионизирует: HNO3 + H2O → H3O+ + NO3- На
- 22. При взаимодействии Ме с HNO3 водород не выделяется. Окисляясь, он образует воду. Конц. HNO3 (W =
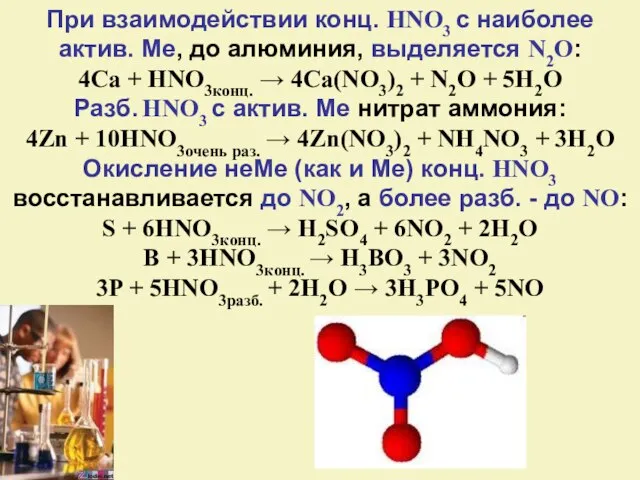
- 23. При взаимодействии конц. HNO3 с наиболее актив. Ме, до алюминия, выделяется N2O: 4Ca + HNO3конц. →
- 24. Смесь конц. HCl и конц. HNO3 3:1 - "царская водка“, т.к. растворяет Au и Pt. Более
- 25. Окисление Ме с избытком HCl – комплексы: H[AuCl4] и H2[PtCl6]. Соли азотной кислоты:нитраты – бесцв. кристалл.
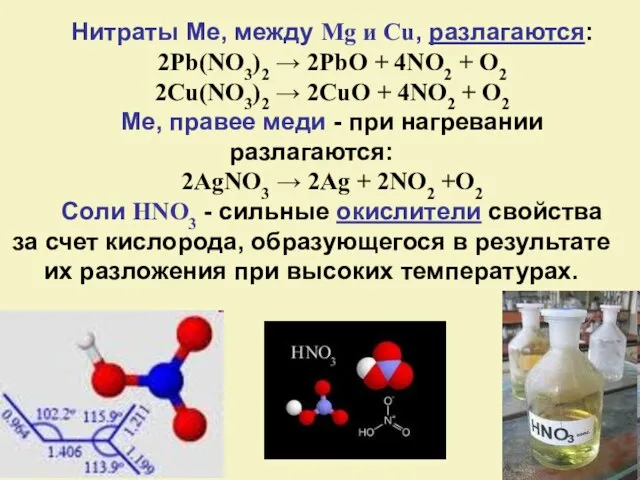
- 26. Нитраты Ме, между Mg и Cu, разлагаются: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 2Cu(NO3)2 →
- 27. Нитраты применяют для легко воспламеняющихся и взрывчатых смесей (например, черного пороха: 68% KNO3, 15% S u
- 29. Скачать презентацию













![Окисление Ме с избытком HCl – комплексы: H[AuCl4] и H2[PtCl6]. Соли](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/545977/slide-24.jpg)

 Значение химии в жизни человека
Значение химии в жизни человека Химическое действие света
Химическое действие света Химия высокомолекулярных соединений
Химия высокомолекулярных соединений Представители солей. Важнейшие соли, используемые человеком в жизни. МОУ лицей №18 Иванова И. Учитель химии Калинина Л.А.
Представители солей. Важнейшие соли, используемые человеком в жизни. МОУ лицей №18 Иванова И. Учитель химии Калинина Л.А. Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И.Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И.Менделеева  Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Химия и сельское хозяйство
Химия и сельское хозяйство Нефть и способы её переработки
Нефть и способы её переработки Неорганические вещества. Минеральные соли и кислоты
Неорганические вещества. Минеральные соли и кислоты Исследовательска работа Чем полезна жевательная резинка?
Исследовательска работа Чем полезна жевательная резинка? Водорастворимые витамины
Водорастворимые витамины Полимерные реагенты в бурении
Полимерные реагенты в бурении Химические свойства алкинов
Химические свойства алкинов Органические вяжущие. (Лекция 12)
Органические вяжущие. (Лекция 12) Биохимия мозга
Биохимия мозга Роль розчинiв
Роль розчинiв Внесение удобрений разбрасыванием
Внесение удобрений разбрасыванием Презентация по Химии "Использование ИКТ в преподавании химии" - скачать смотреть бесплатно
Презентация по Химии "Использование ИКТ в преподавании химии" - скачать смотреть бесплатно Полимеры. Каучуки. Резина
Полимеры. Каучуки. Резина Гомеопатические лекарственные средства минерального происхождения. Часть І (группа щелочных и щелочно-земельных металлов)
Гомеопатические лекарственные средства минерального происхождения. Часть І (группа щелочных и щелочно-земельных металлов) Знание химии в строительном деле на бытовом уровне
Знание химии в строительном деле на бытовом уровне Минеральные удобрения
Минеральные удобрения Практическое применение метанола
Практическое применение метанола Общие способы получения металлов
Общие способы получения металлов Reactions and equations lab
Reactions and equations lab Алкены. Свойства. 10 класс
Алкены. Свойства. 10 класс ОВР в органической химии
ОВР в органической химии Презентация по Химии "Феноли" - скачать смотреть бесплатно
Презентация по Химии "Феноли" - скачать смотреть бесплатно