Содержание
- 2. История: Сероводород (Н2S) -бесцветный газ с запахом тухлых яиц. При — 60 град. С он переходит
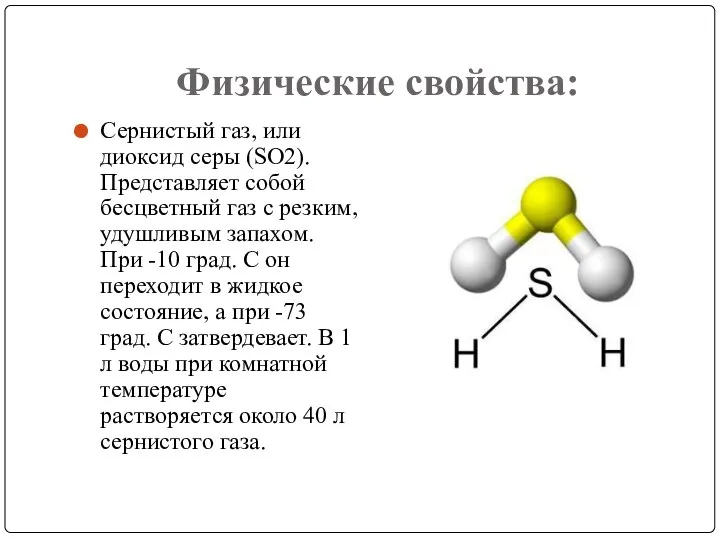
- 3. Физические свойства: Сернистый газ, или диоксид серы (SO2). Представляет собой бесцветный газ с резким, удушливым запахом.
- 4. Химические свойства: Кислота реагирует с : а) оснόвными оксидами (СаО); б) основаниями (NaOH); в) солями (CuSO4);
- 5. Получение: Реакция разбавленной соляной кислоты с сульфидом железа (II) FeS + 2HCl = FeCl2 + H2S
- 6. Применение: В аналитической химии сероводород и сероводородная вода используются как реагенты для осаждения тяжёлых металлов, сульфиды
- 8. Скачать презентацию




 Введение. Основные понятия химии
Введение. Основные понятия химии I закон термодинамики, его применение для расчёта тепловых эффектов
I закон термодинамики, его применение для расчёта тепловых эффектов Дозиметрия ионизирующих излучений. Влияние радиации на организм человека
Дозиметрия ионизирующих излучений. Влияние радиации на организм человека Камни и Рак
Камни и Рак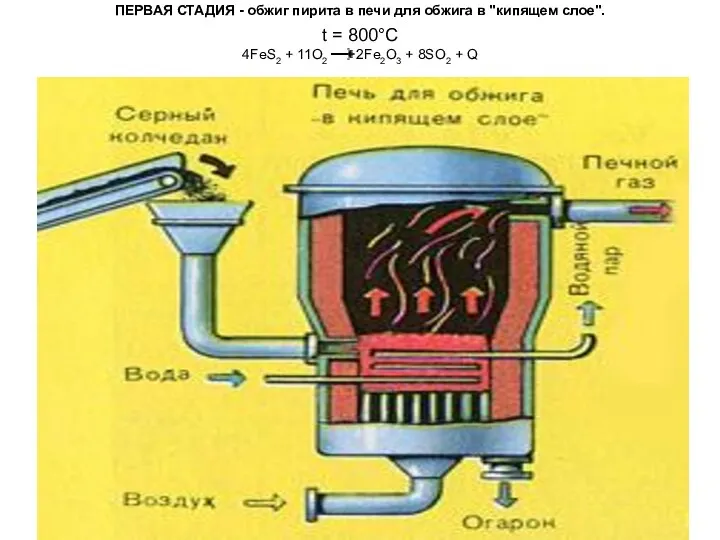 Получение серной кислоты
Получение серной кислоты Презентация Спирты
Презентация Спирты Глицерин Свойства - применение Выполнила учитель химии МОУ «Средняя школа №7» г. Балаково Саратовской области Трибунская Е
Глицерин Свойства - применение Выполнила учитель химии МОУ «Средняя школа №7» г. Балаково Саратовской области Трибунская Е Получение водорода в промышленности и его применение Химия 8 класс
Получение водорода в промышленности и его применение Химия 8 класс  Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое
Исследование влияния концентрации наночастиц никеля в водных растворах на генерацию активных форм кислорода при лазерном пробое Классификация химических элементтов
Классификация химических элементтов Презентация по Химии "Нитраты - минеральные удобрения" - скачать смотреть
Презентация по Химии "Нитраты - минеральные удобрения" - скачать смотреть  Фізичні та хімічні явища. (7 клас)
Фізичні та хімічні явища. (7 клас) Каучук. История открытия
Каучук. История открытия Материаловедение. Теория термической обработки стали. (Тема 8)
Материаловедение. Теория термической обработки стали. (Тема 8) Органические вещества. Валентность. Теория химического строения
Органические вещества. Валентность. Теория химического строения Основы общей химии
Основы общей химии Важнейшие химические понятия и законы
Важнейшие химические понятия и законы Презентация по химии Неорганические и органические основания.
Презентация по химии Неорганические и органические основания.  Особенности строения, реакционной способности и методы синтеза алкенов
Особенности строения, реакционной способности и методы синтеза алкенов Водород, нахождение в природе. Получение водорода и его физические свойства
Водород, нахождение в природе. Получение водорода и его физические свойства Классификация оснований
Классификация оснований PSKhE
PSKhE Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Деструкция углеводородов
Деструкция углеводородов Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Физические, химические свойства предельных и непредельных карбоновых кислот, получение Классификация силикатов
Классификация силикатов - Это оружие массового поражения, действие которого основано на токсических свойствах химических веществ. - Это оружие массового
- Это оружие массового поражения, действие которого основано на токсических свойствах химических веществ. - Это оружие массового  Алюминий и его органические производные
Алюминий и его органические производные