Содержание
- 2. Если на систему, находящуюся в состоянии истинного равновесия, оказывается внешнее воздействие, то в системе возникает самопроизвольный
- 3. Л.5 Кинетика химических реакций Законы химической термодинамики позволяют определить направление и предел протекания возможного при данных
- 4. СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени
- 5. Наиболее часто в химии рассматривается зависимость концентрации реагентов от времени. В случае односторонних (необратимых) химических реакций
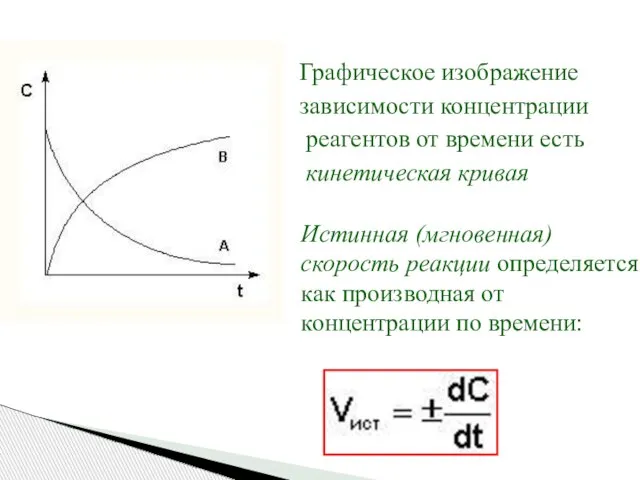
- 6. Графическое изображение зависимости концентрации реагентов от времени есть кинетическая кривая Истинная (мгновенная) скорость реакции определяется как
- 7. Истинную скорость реакции можно определить графически, проведя касательную к кинетической кривой. Истинная скорость реакции в данный
- 8. Если стехиометрические коэффициенты в уравнении химической реакции неодинаковы, величина скорости реакции будет зависеть от того, изменение
- 9. Скорость химической реакции зависит от множества факторов: природы реагирующих веществ, их концентрации, температуры, природы растворителя и
- 10. Кинетическое уравнение химической реакции. Порядок реакции. Одной из задач, стоящих перед химической кинетикой, является определение состава
- 11. Для реакции аА + bВ + dD + ... ––> еЕ + ... можно записать: Коэффициент
- 12. Зависимость скорости реакции от концентраций реагирующих веществ определяется экспериментально и называется кинетическим уравнением химической реакции. Для
- 13. Сумма показателей степени в кинетическом уравнении химической реакции (x + y + z) представляет собой общий
- 14. В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ
- 15. Реакции нулевого порядка Для реакций нулевого порядка кинетическое уравнение имеет следующий вид: Скорость реакции нулевого порядка
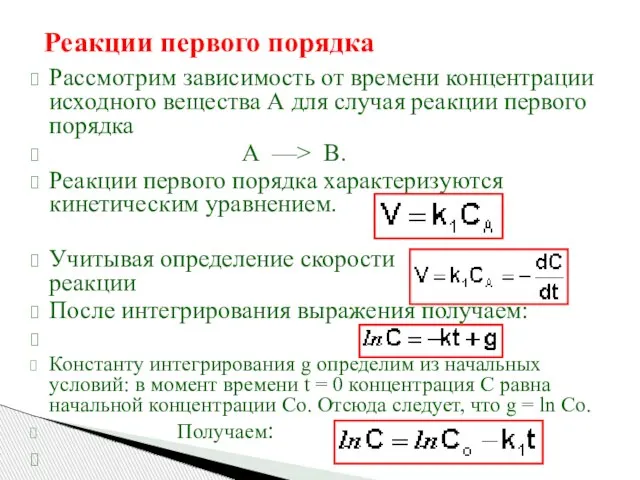
- 16. Реакции первого порядка Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка
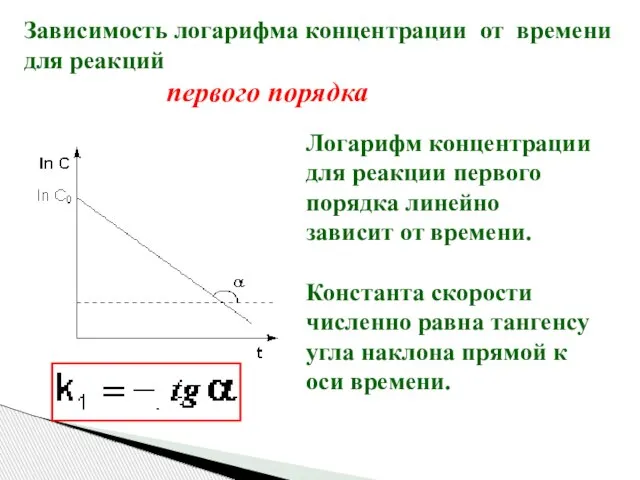
- 17. Зависимость логарифма концентрации от времени для реакций первого порядка Логарифм концентрации для реакции первого порядка линейно
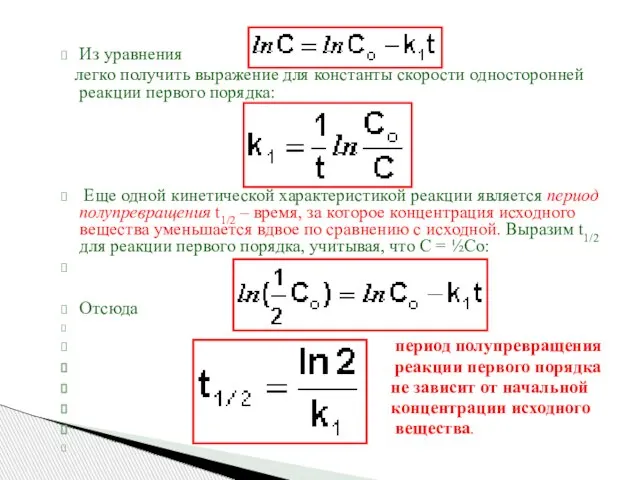
- 18. Из уравнения легко получить выражение для константы скорости односторонней реакции первого порядка: Еще одной кинетической характеристикой
- 19. Реакции второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид: либо Рассмотрим простейший случай,
- 20. После разделения переменных и интегрирования получаем: Постоянную интегрирования g, как и в предыдущем случае, определим из
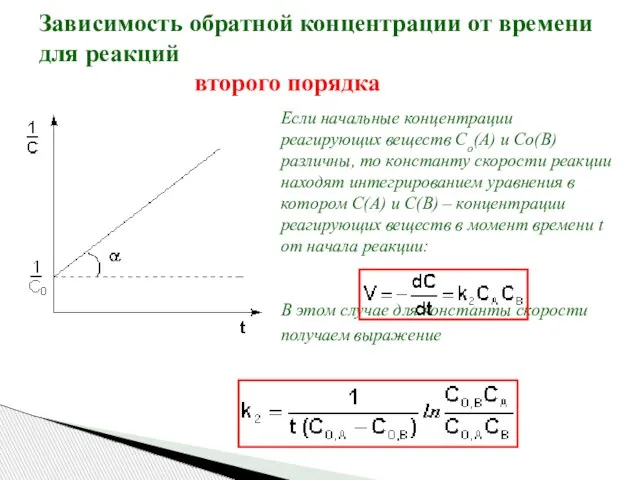
- 21. Зависимость обратной концентрации от времени для реакций второго порядка Если начальные концентрации реагирующих веществ Cо(А) и
- 22. Порядок химической реакции есть формально-кинетическое понятие, физический смысл которого для элементарных (одностадийных) реакций заключается в следующем:
- 23. Л.6 Рассмотрим пример: Рассмотрим в качестве примера элементарную реакцию гидролиза этилового эфира уксусной кислоты (этилацетата), кинетика
- 24. При проведении этой же реакции в условиях большого избытка одного из реагентов (воды или этилацетата) концентрация
- 25. Методы определения порядка реакции Проведение реакции в условиях, когда концентрация одного из реагентов много меньше концентрации
- 26. Графический метод заключается в построении графика зависимости концентрации реагента от времени в различных координатах. Для различных
- 27. Если построить графики этих зависимостей на основании опытных данных, то лишь одна из них будет являться
- 28. Метод подбора кинетического уравнения заключается в подстановке экспериментальных данных изучения зависимости концентрации вещества от времени в
- 30. Метод определения времени полупревращения заключается в определении t1/2 для нескольких начальных концентраций. Как видно из приведённых
- 31. По характеру зависимости t1/2 от Co нетрудно сделать вывод о порядке реакции по данному веществу. Данный
- 32. Молекулярность элементарных реакций Элементарными (простыми) называют реакции, идущие в одну стадию. Их принято классифицировать по молекулярности:
- 33. Мономолекулярные – реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.): I2
- 34. Бимолекулярные – реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных): СН3Вr +
- 35. Тримолекулярные – реакции, элементарный акт которых осуществляется при столкновении трех частиц: О2 + NО + NО
- 36. Для элементарных реакций, проводимых при близких концентрациях исходных веществ, величины молекулярности и порядка реакции совпадают. Тем
- 37. Сложные реакции Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера
- 38. Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики.
- 39. Классификация сложных реакций Последовательные реакции. Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в
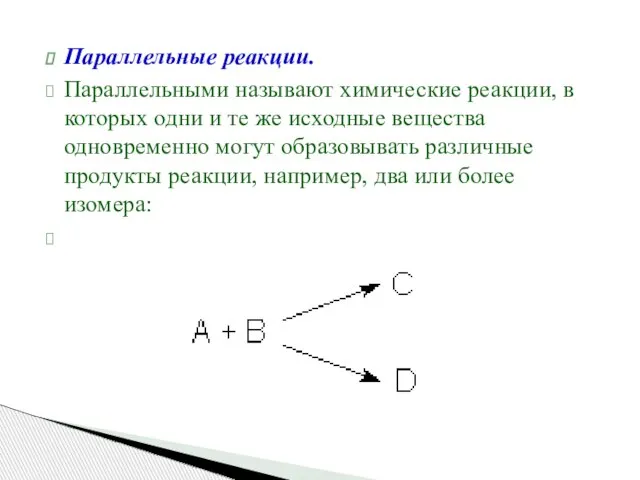
- 40. Параллельные реакции. Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут
- 41. Сопряжённые реакции. Сопряжёнными принято называть сложные реакции, протекающие следующим образом: 1) А + В ––> С
- 42. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение
- 43. Цепные реакции. Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой
- 44. Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция,
- 45. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей,
- 46. Влияние температуры на константу скорости реакции Константа скорости реакции есть функция от температуры; повышение температуры, как
- 47. Величина, показывающая, во сколько раз увеличивается константа скорости при повышении температуры на 10 градусов, есть температурный
- 48. Уравнение Аррениуса Взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико и, если
- 49. Рассмотрим путь некоторой элементарной реакции А + В ––> С Поскольку химическое взаимодействие частиц связано с
- 50. Образование активированного комплекса всегда требует затраты некоторого количества энергии, что вызвано, во-первых, отталкиванием электронных оболочек и
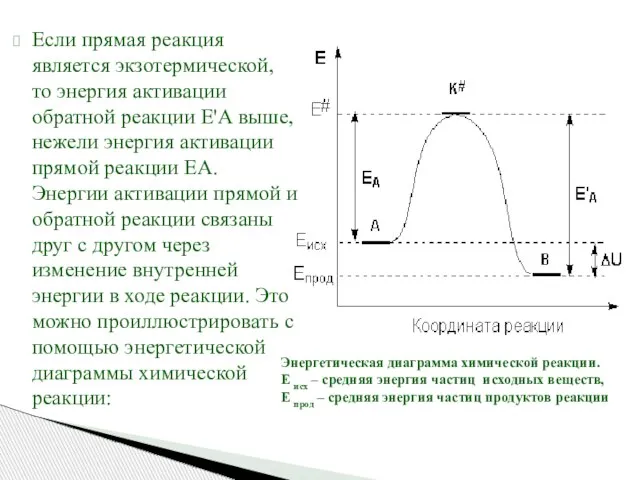
- 51. Если прямая реакция является экзотермической, то энергия активации обратной реакции Е'А выше, нежели энергия активации прямой
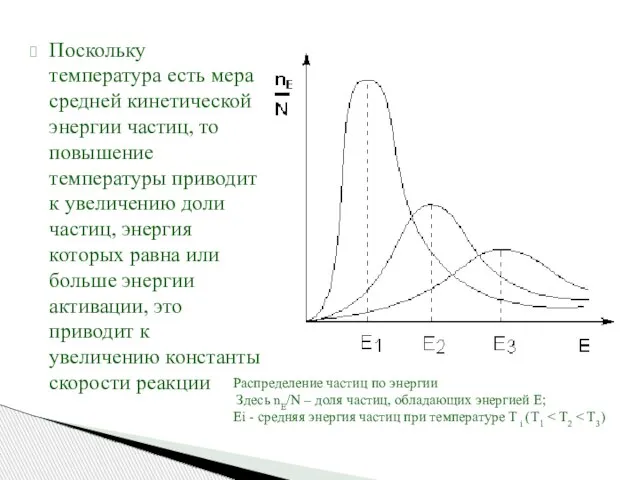
- 52. Поскольку температура есть мера средней кинетической энергии частиц, то повышение температуры приводит к увеличению доли частиц,
- 53. Термодинамический вывод выражения, описывающего зависимость константы скорости реакции от температуры и величины энергии активации – уравнения
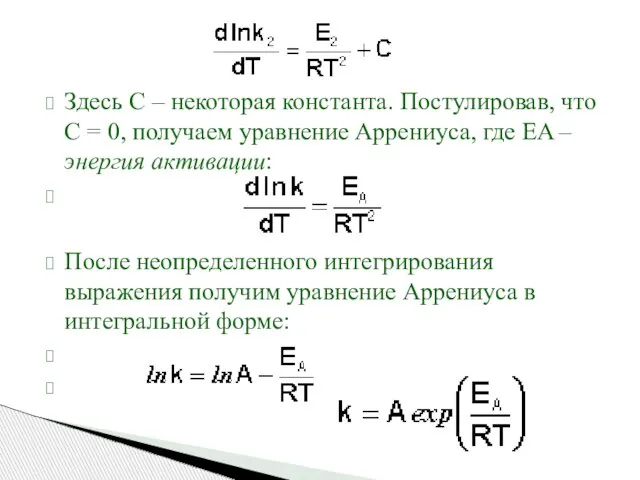
- 54. Здесь С – некоторая константа. Постулировав, что С = 0, получаем уравнение Аррениуса, где EA –
- 55. Зависимость логарифма константы скорости химической реакции от обратной температуры Здесь A – постоянная интегрирования. Из уравнения
- 56. Зная энергию активации реакции и константу скорости при какой-либо температуре T1, по уравнению Аррениуса можно рассчитать
- 57. Кинетика двусторонних (обратимых) реакций Химические реакции часто являются двусторонними (обратимыми), т.е. могут протекать при данных условиях
- 58. Общая скорость двусторонней реакции в любой момент времени равна разности скоростей прямой и обратной реакции: По
- 59. Кинетика гетерогенных химических реакций Когда реакция совершается между веществами, находящимися в разных фазах гетерогенной системы, основной
- 60. Стадии 1 и 5 называются диффузионными, стадии 2, 3 и 4 – кинетическими. Универсального выражения для
- 61. ФОТОХИМИЧЕСКИЕ РЕАКЦИИ Передача энергии для активации вступающих во взаимодействие молекул может осуществляться либо в форме теплоты
- 62. Излучение, отражённое веществом, а также прошедшее сквозь него, не вызывают никаких химических превращений. Иногда фотохимические процессы
- 63. Взаимодействие света с веществом может идти по трём возможным направлениям: 1. Возбуждение частиц (переход электронов на
- 64. Между количеством лучистой энергии, поглощенной молекулами вещества, и количеством фотохимически прореагировавших молекул существует соотношение, выражаемое законом
- 65. Поскольку фотохимическая реакция, как правило, включает в себя и т.н. вторичные процессы (например, в случае цепного
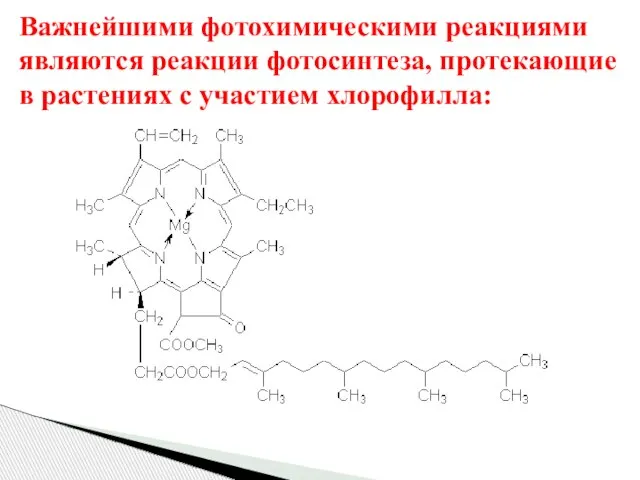
- 66. Важнейшими фотохимическими реакциями являются реакции фотосинтеза, протекающие в растениях с участием хлорофилла:
- 67. Процесс фотосинтеза составляют две стадии: световая, связанная с поглощением фотонов, и значительно более медленная темновая, представляющая
- 68. Протекание данного окислительно-восстановительного процесса (связанного с переносом электронов) возможно благодаря наличию в реакционном центре хлорофилла Сhl
- 69. КАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ Скорость химической реакции при данной температуре определяется скоростью образования активированного комплекса, которая, в свою
- 70. Различают положительный и отрицательный катализ (соответственно увеличение и уменьшение скорости реакции), хотя часто под термином "катализ"
- 71. Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не
- 72. Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно,
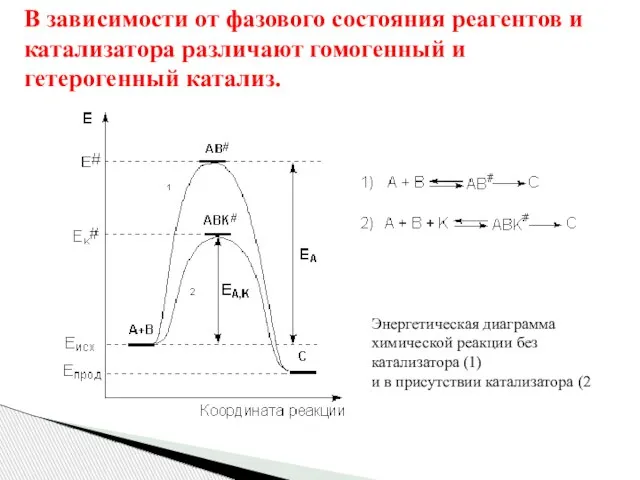
- 73. Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции через активированный
- 74. Действительно, если предположить, что предэкспоненциальные множители в уравнении Аррениуса для каталитической и некаталитической реакций близки, то
- 75. Наличие катализатора не влияет на величину изменения термодинамического потенциала в результате процесса и, следовательно, никакой катализатор
- 76. В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ. Энергетическая диаграмма химической
- 77. Гомогенный катализ. Гомогенный катализ – каталитические реакции, в которых реагенты и катализатор находятся в одной фазе.
- 78. Примером такого процесса может служить реакция разложения ацетальдегида, энергия активации которой EA = 190 кДж/моль: СН3СНО
- 79. Автокатализ. Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов. В качестве примера можно
- 80. Гетерогенный катализ. Гетерогенный катализ – каталитические реакции, идущие на поверхности раздела фаз, образуемых катализатором и реагирующими
- 81. Специфической особенностью гетерокаталитических процессов является способность катализатора к промотированию и отравлению. Промотирование – увеличение активности катализатора
- 82. Для объяснения этих особенностей гетерогенно-каталитических процессов Г. Тэйлором было высказано следующее предположение: каталитически активной является не
- 83. 1. Активный центр катализатора представляет собой совокупность определенного числа адсорбционных центров, расположенных на поверхности катализатора в
- 85. Скачать презентацию







































































 Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Химические реакторы
Химические реакторы Атом, который отдает электроны называется восстановителем. Атом, который отдает электроны называется восстановителем. Атом, к
Атом, который отдает электроны называется восстановителем. Атом, который отдает электроны называется восстановителем. Атом, к Дисперсные системы. Поверхностная энергия
Дисперсные системы. Поверхностная энергия Смолисто-асфальтеновые вещества
Смолисто-асфальтеновые вещества Металлы в природе. Общие способы получения металлов
Металлы в природе. Общие способы получения металлов Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина друга) Аттестационная работа. Программа регионального компонента образовательной области «Химия»
Аттестационная работа. Программа регионального компонента образовательной области «Химия» Загальна характеристика рослинних кормiв. (Тема 1)
Загальна характеристика рослинних кормiв. (Тема 1) Исследование соединений со структурой слоистого перовскита
Исследование соединений со структурой слоистого перовскита Коррозия металлов
Коррозия металлов Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть
Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть  Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Наука о веществе - химия
Наука о веществе - химия Застосування арт-терапевтичних технік на уроках хімії
Застосування арт-терапевтичних технік на уроках хімії Презентация по биологии Круговорот серы, фосфора и азота в биосфере
Презентация по биологии Круговорот серы, фосфора и азота в биосфере Дмитрий Иванович Менделеев и его периодический закон
Дмитрий Иванович Менделеев и его периодический закон Методы исследования и характеризации поверхностей. Поверхностное и межфазное натяжение. Тензиометрия и эллипсометрия
Методы исследования и характеризации поверхностей. Поверхностное и межфазное натяжение. Тензиометрия и эллипсометрия Гидролиз солей
Гидролиз солей Возраст в геологии
Возраст в геологии Оксиды углероды
Оксиды углероды Презентация по Химии "Кераміка. Скло. Порцеляна" - скачать смотреть бесплатно
Презентация по Химии "Кераміка. Скло. Порцеляна" - скачать смотреть бесплатно Ионные уравнения
Ионные уравнения Способы получения металлов
Способы получения металлов Альдегиды. Получение и применение
Альдегиды. Получение и применение Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов Горение жидкостей
Горение жидкостей Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония
Изучение десорбции лантаноидов и иттирия из сульфокатионита КУ-2 с применением сульфата аммония