Содержание
- 2. Задание 1 Дайте характеристику Rb и Сs по его положению в Периодической системе по плану: а)положение
- 3. Щелочные металлы. Химические свойства. Важнейшие соединения щелочных металлов.
- 4. Щелочные металлы - хорошие восстановители Взаимодействуют с окислителями: Неметаллами Водой Кислотами
- 5. Взаимодействие с простыми веществами-неметаллами С кислородом Li + O2 → Li2O оксид лития Na + O2
- 6. С галогенами 2Li + Cl2 → 2LiCl Хлорид лития 2Na + Cl2 → 2NaCl Хлорид натрия
- 7. Взаимодействие со сложными веществами С водой 2Li + 2H2O → 2LiOH +H2 Гидроксид лития 2Na +2H2O
- 8. Важнейшие соединения щелочных металлов Оксиды Me2O - твердые вещества. Имеют ярко выраженные основные свойства: взаимодействуют с
- 9. KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Гидроксиды щелочных металлов Какова
- 10. Соли щелочных металлов – твердые кристаллические вещества ионного строения. NaCl – каменная соль Na2CO3 – карбонат
- 12. Способы получения Электролиз расплава МеСl эл.ток Ме+ + Сl- на катоде: Ме+ + 1е Ме0 на
- 13. О каком элементе идет речь? Хранят обычно в керосине, и бегает он по воде, В природе,
- 14. Задание 2: Запишите уравнения реакций взаимодействия калия с кислородом, с бромом, с фосфором, с водой. Напишите
- 15. 1.Что нового вы сегодня узнали на уроке, чему научились? 2.Что еще хотели бы узнать, изучить? 3.Что
- 17. Скачать презентацию














 Химическая связь в кристаллах
Химическая связь в кристаллах Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Ацетилен. Физические и химические свойства
Ацетилен. Физические и химические свойства Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А.
Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А. Синтетичні та органічні волокна Виконали: Дорош Таня Мартинко Марина
Синтетичні та органічні волокна Виконали: Дорош Таня Мартинко Марина  Щавелевая кислота
Щавелевая кислота Топливо и топливосжигающие устройства. Горение топлива
Топливо и топливосжигающие устройства. Горение топлива Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Особая роль углерода в наномире
Особая роль углерода в наномире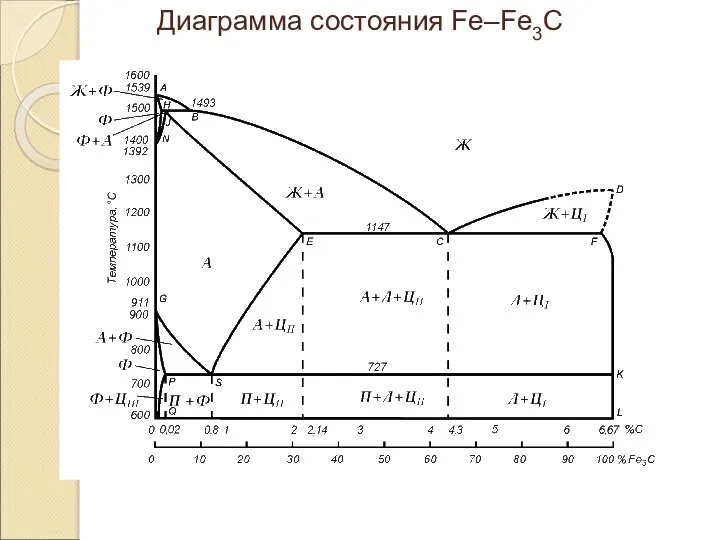 Диаграмма состояния Fe–Fe3C
Диаграмма состояния Fe–Fe3C ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО
ОЧКАСОВ ЕВГЕНИЙ МИХАЙЛОВИЧ ПРЕПОДАВАТЕЛЬ ХИМИИ И БИОЛОГИИ ГОСУДАРСТВЕННОГО АВТОНОМНОГО ОБРАЗОВАТЕЛЬНОГО УЧРЕЖДЕНИЯ СРЕДНЕГО Нефть и способы её переработки
Нефть и способы её переработки Презентация на тему : «Уксусная кислота» Выполнила: ученица 11-Б класса Зануда Т.А Проверила: учитель химии Тисленко Л.А
Презентация на тему : «Уксусная кислота» Выполнила: ученица 11-Б класса Зануда Т.А Проверила: учитель химии Тисленко Л.А  Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._
Кислоты, основания, соли в свете ТЭД подготовила: Мартынова Е.Ю._ Углеводороды
Углеводороды Природні джерела органічних речовин Підготувала Учениця 11-Б класу Білик Вікторія
Природні джерела органічних речовин Підготувала Учениця 11-Б класу Білик Вікторія  Алкандар. (қаныққан көмірсутектер)
Алкандар. (қаныққан көмірсутектер) Фазовые равновесия в двухкомпонентных системах: зависимость растворимости вещества от температуры, криоскопия, эбулиоскопия
Фазовые равновесия в двухкомпонентных системах: зависимость растворимости вещества от температуры, криоскопия, эбулиоскопия Органическая химия. История развития
Органическая химия. История развития каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами
каталитические системы на основе металлоценов и метилалюмоксана в реакциях непредельных соединений с изобутиланами Методы выращивания кристаллов
Методы выращивания кристаллов Самовосстанавливающиеся материалы
Самовосстанавливающиеся материалы Золь. Свойства золи
Золь. Свойства золи Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Химическая реакция – превращение одних веществ в другие
Химическая реакция – превращение одних веществ в другие Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру
Химические знаки и химические формулы Задачи урока: Познакомиться с химическими знаками химических элементов. Рассмотреть стру Химические волокна
Химические волокна Высокомолекулярные соединения (ВМС)
Высокомолекулярные соединения (ВМС)