Содержание
- 2. КЛАССИФИКАЦИЯ в эту группу соединений объединяют несколько классов: Амины Амиды Имиды Аминокислоты Нитросоединения Нитрозосоединения Азосоединения Диазосоединения.
- 3. АМИНЫ Амины могут быть рассмотрены как производные аммиака. Аминами называют органические соединения, которые получают замещением атомов
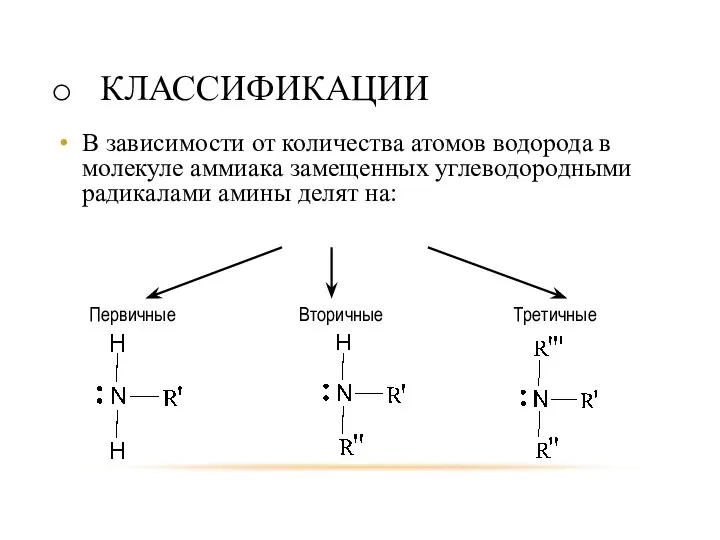
- 4. КЛАССИФИКАЦИИ В зависимости от количества атомов водорода в молекуле аммиака замещенных углеводородными радикалами амины делят на:
- 5. По типу радикалов амины делят на: Предельные; Непредельные; Ароматические. По количеству аминогрупп амины делят на: Моноамины;
- 6. НОМЕНКЛАТУРА Рациональная. Название амина строят из двух слов: названия углеводородных радикалов по радикальной номенклатуре и слова
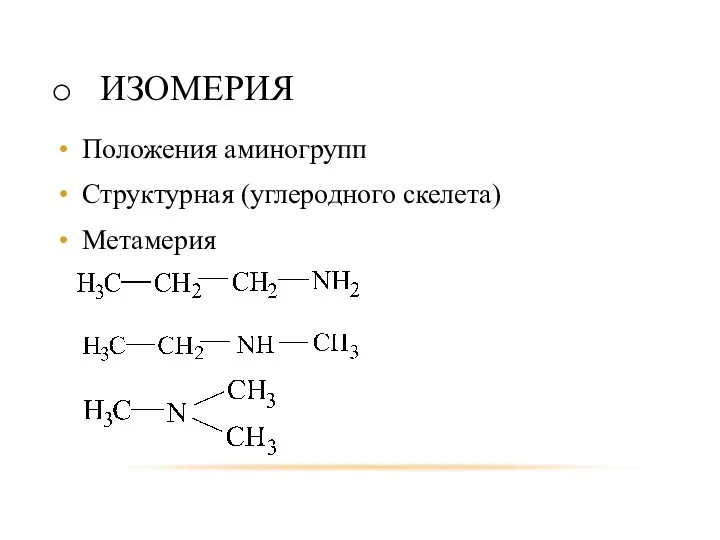
- 10. ИЗОМЕРИЯ Положения аминогрупп Структурная (углеродного скелета) Метамерия
- 11. ФИЗИЧЕСКИЕ СВОЙСТВА Метиламин, диметиламин, триметиламин представляют собой газы. Остальные низшие амины – жидкости. Высшие амины –
- 12. СПОСОБЫ ПОЛУЧЕНИЯ В 1850 году немецкий ученый Гофман впервые получил амин в результате химической реакции взаимодействия
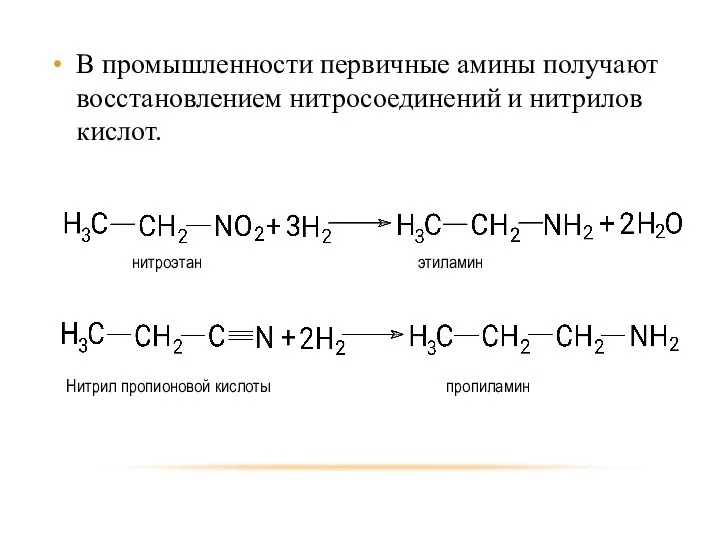
- 14. Наиболее биологически активными являются первичные амины. Их получили разложением амидов кислот (перегруппировка Гофмана). Этот способ широко
- 15. В промышленности первичные амины получают восстановлением нитросоединений и нитрилов кислот.
- 16. Алкилирование спиртов
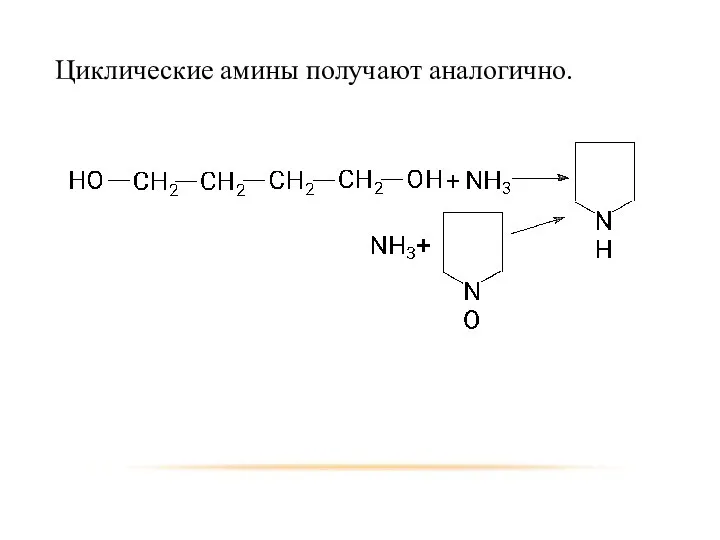
- 17. Циклические амины получают аналогично.
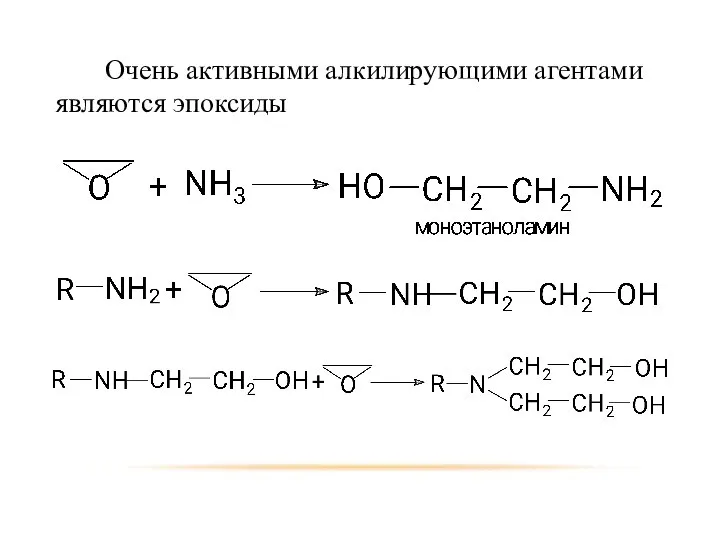
- 18. Очень активными алкилирующими агентами являются эпоксиды
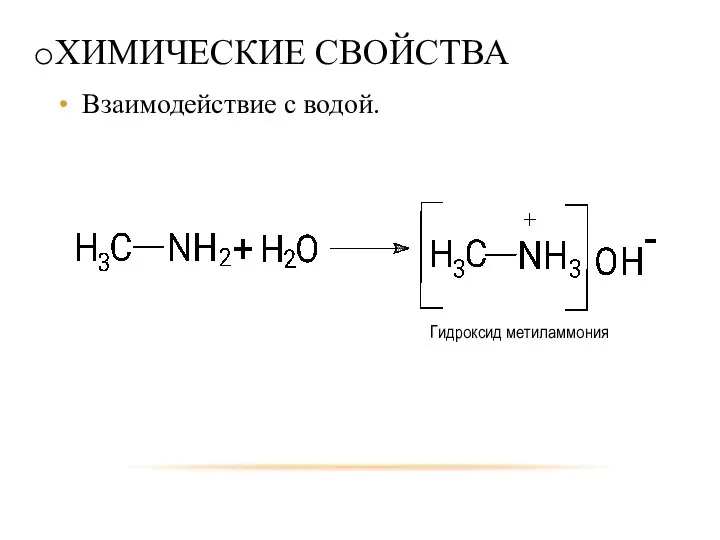
- 19. ХИМИЧЕСКИЕ СВОЙСТВА Взаимодействие с водой. Гидроксид метиламмония
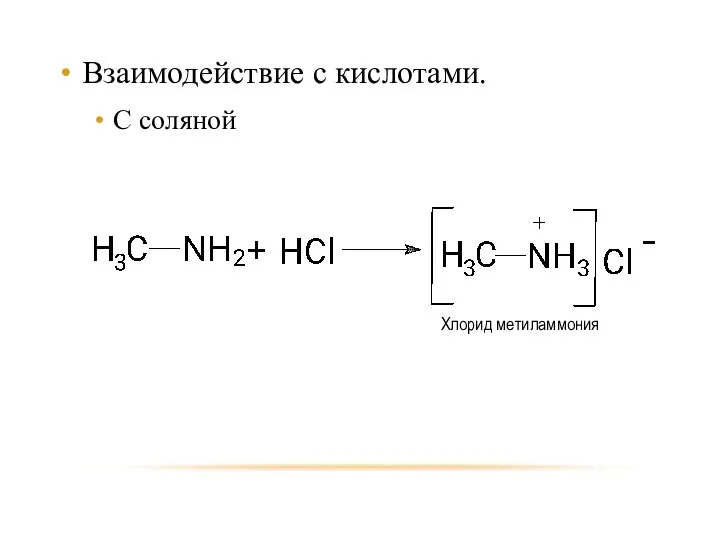
- 20. Взаимодействие с кислотами. С соляной
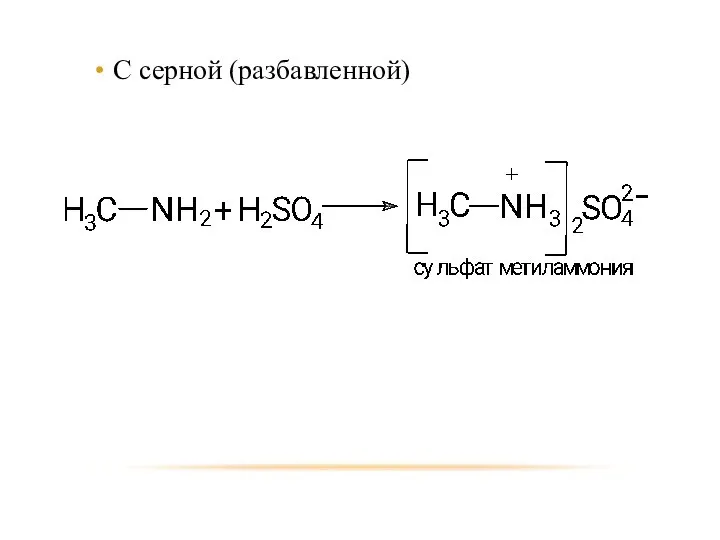
- 21. С серной (разбавленной)
- 22. Взаимодействие с азотистой кислотой При взаимодействии первичных аминов с азотистой кислотой образуются первичные спирты.
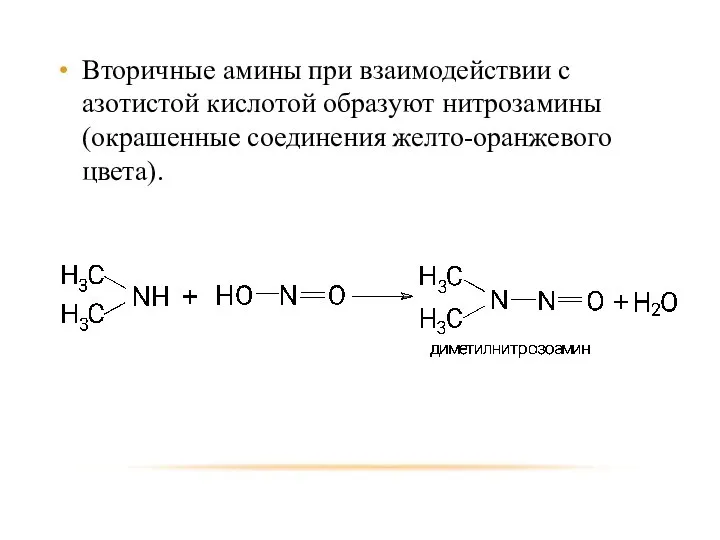
- 23. Вторичные амины при взаимодействии с азотистой кислотой образуют нитрозамины (окрашенные соединения желто-оранжевого цвета).
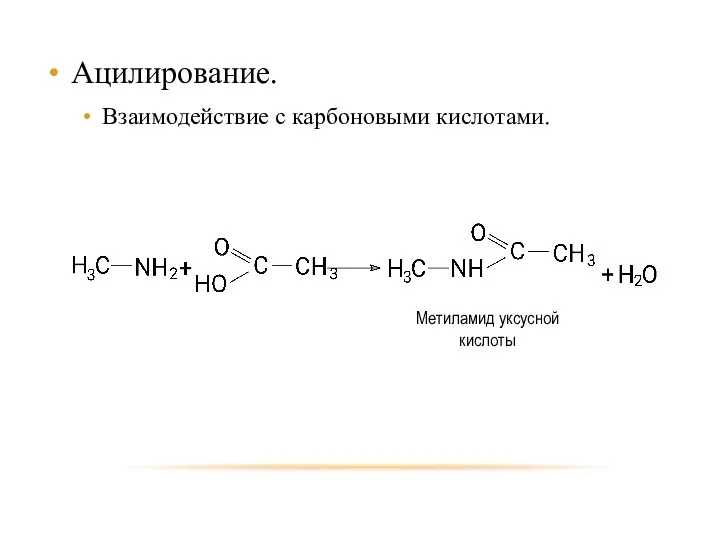
- 24. Ацилирование. Взаимодействие с карбоновыми кислотами.
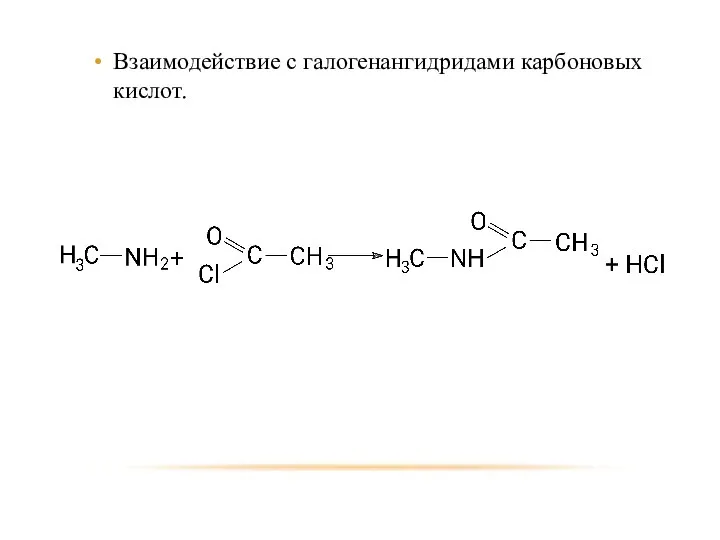
- 25. Взаимодействие с галогенангидридами карбоновых кислот.
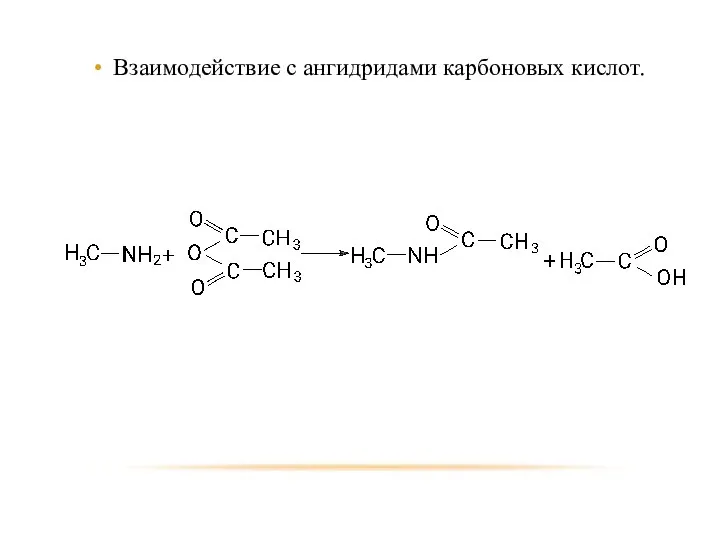
- 26. Взаимодействие с ангидридами карбоновых кислот.
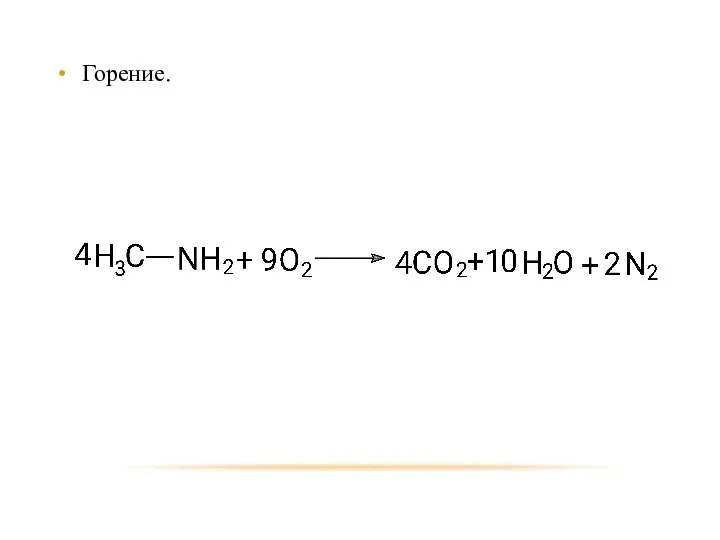
- 27. Горение.
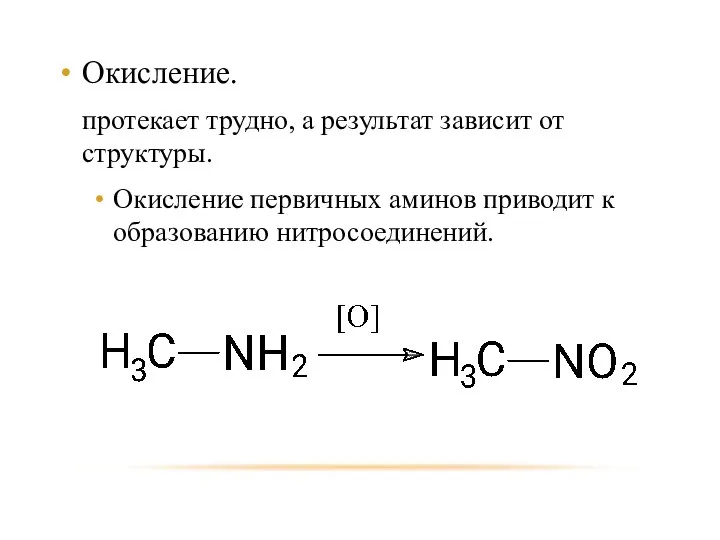
- 28. Окисление. протекает трудно, а результат зависит от структуры. Окисление первичных аминов приводит к образованию нитросоединений.
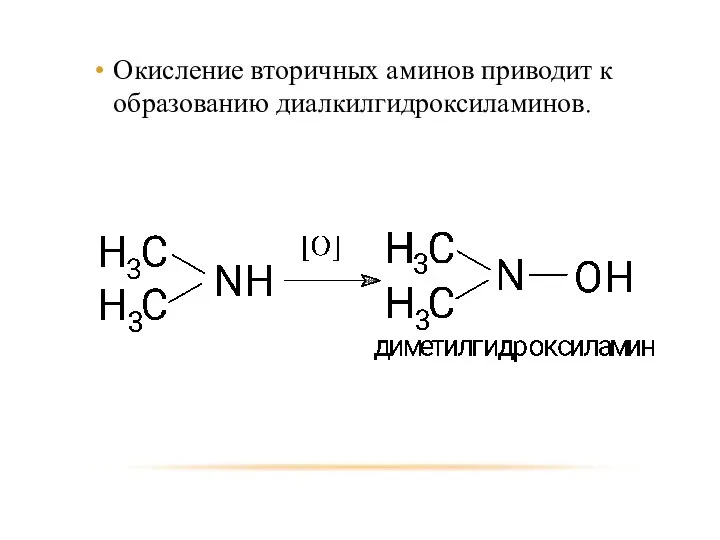
- 29. Окисление вторичных аминов приводит к образованию диалкилгидроксиламинов.
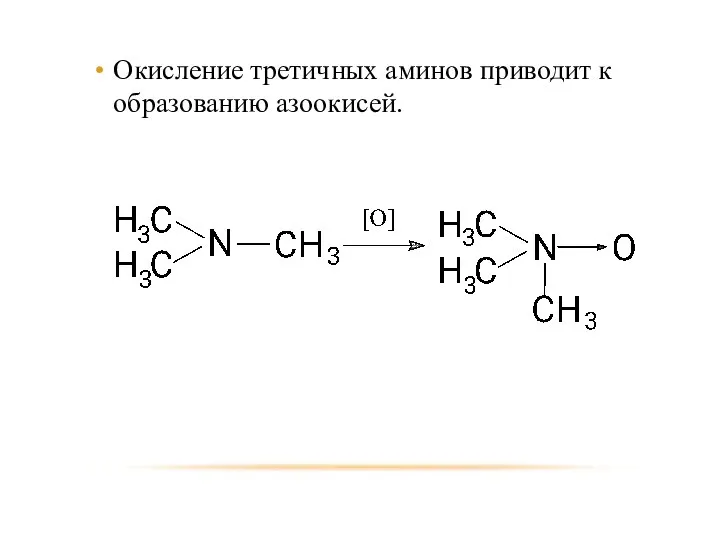
- 30. Окисление третичных аминов приводит к образованию азоокисей.
- 31. АРОМАТИЧЕСКИЕ АМИНЫ
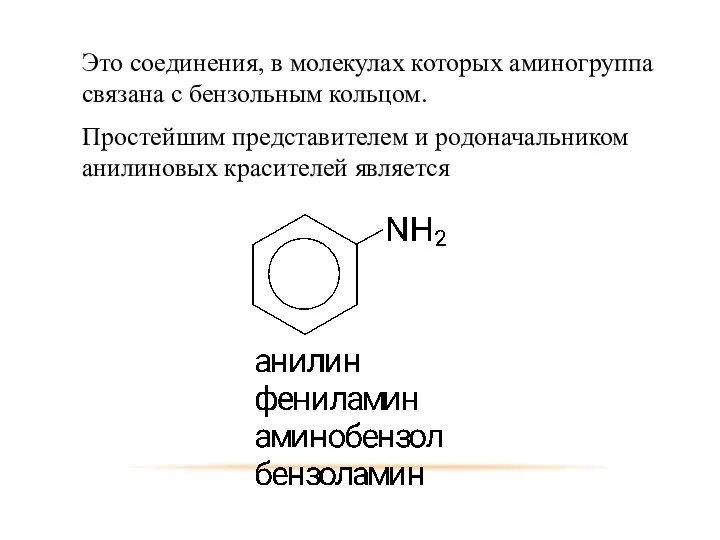
- 32. Это соединения, в молекулах которых аминогруппа связана с бензольным кольцом. Простейшим представителем и родоначальником анилиновых красителей
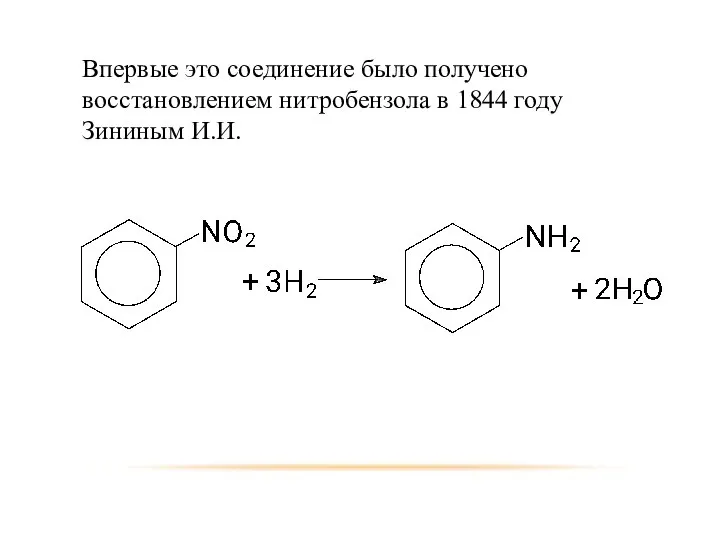
- 33. Впервые это соединение было получено восстановлением нитробензола в 1844 году Зининым И.И.
- 34. ФИЗИЧЕСКИЕ СВОЙСТВА Анилин – бесцветная, быстро буреющая на воздухе, жидкость. Плохо растворяется в воде.
- 35. ХИМИЧЕСКИЕ СВОЙСТВА обусловлены как аминогруппой, так и бензольным кольцом. Аминогруппа – заместитель электроннодонорный и свойства анилина
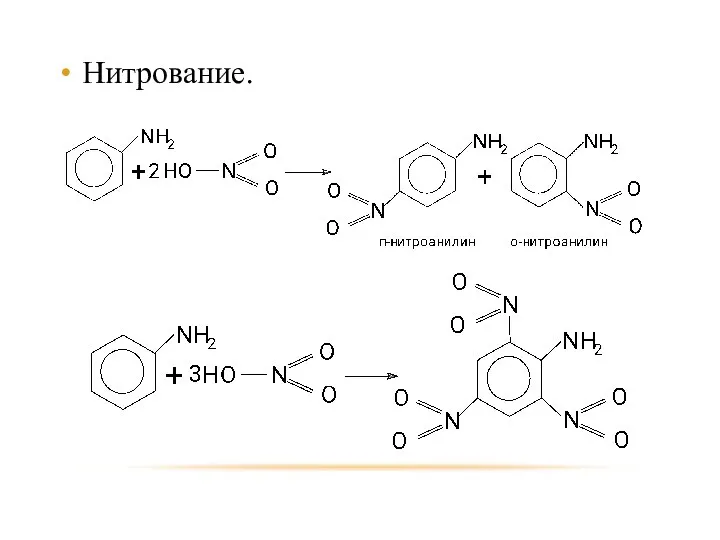
- 36. Нитрование.
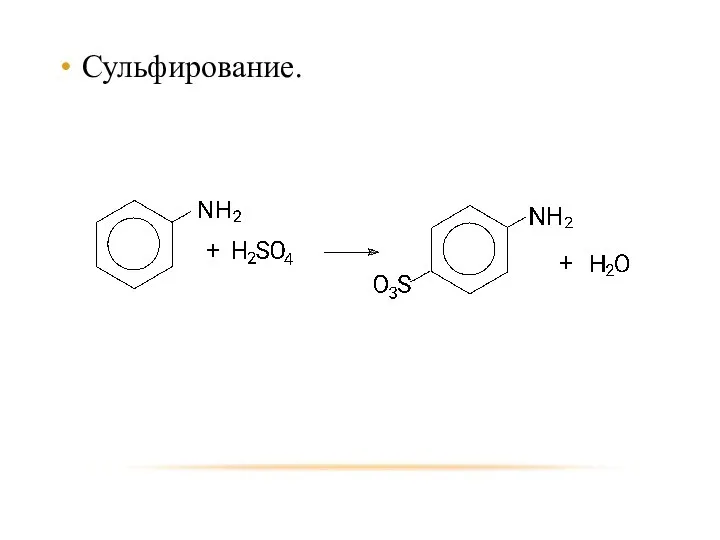
- 37. Сульфирование.
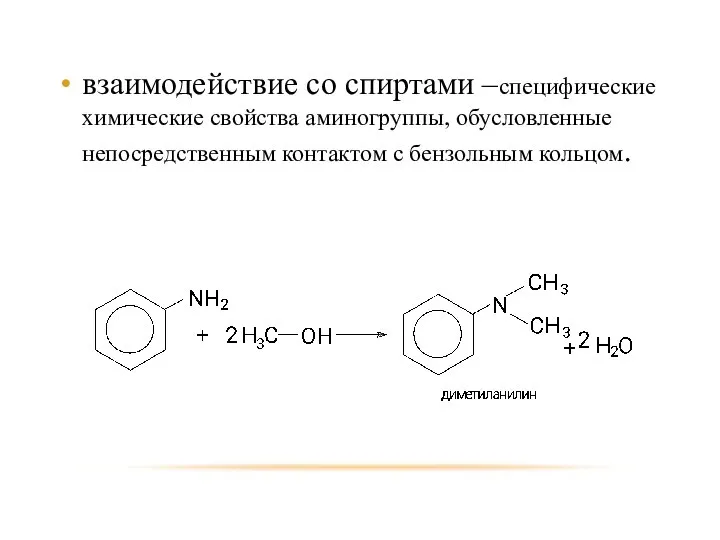
- 38. взаимодействие со спиртами –специфические химические свойства аминогруппы, обусловленные непосредственным контактом с бензольным кольцом.
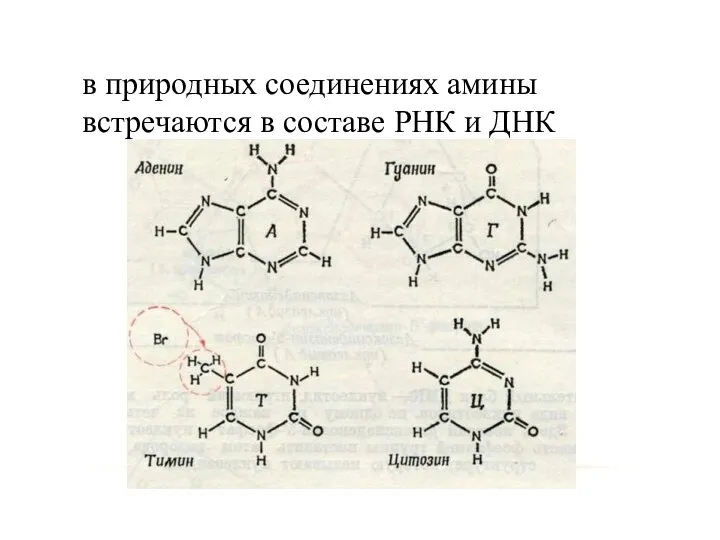
- 39. в природных соединениях амины встречаются в составе РНК и ДНК
- 40. принципиально РНК и ДНК
- 41. Кроме того амины входят в состав некоторых других соединений.
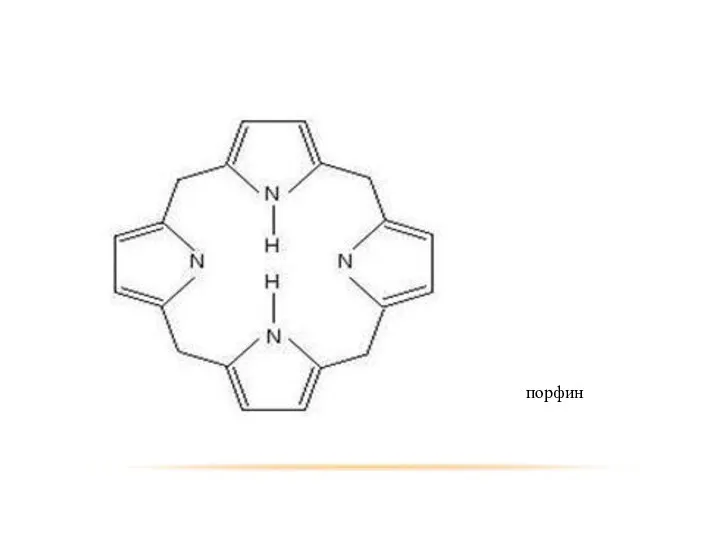
- 42. порфин
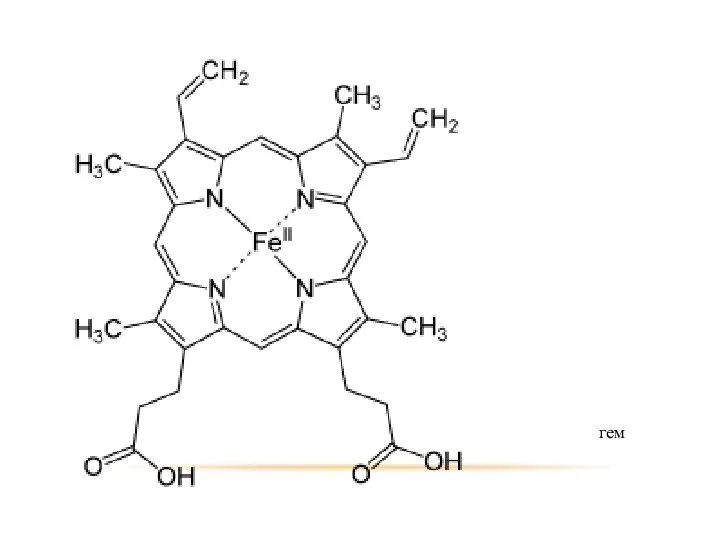
- 43. гем
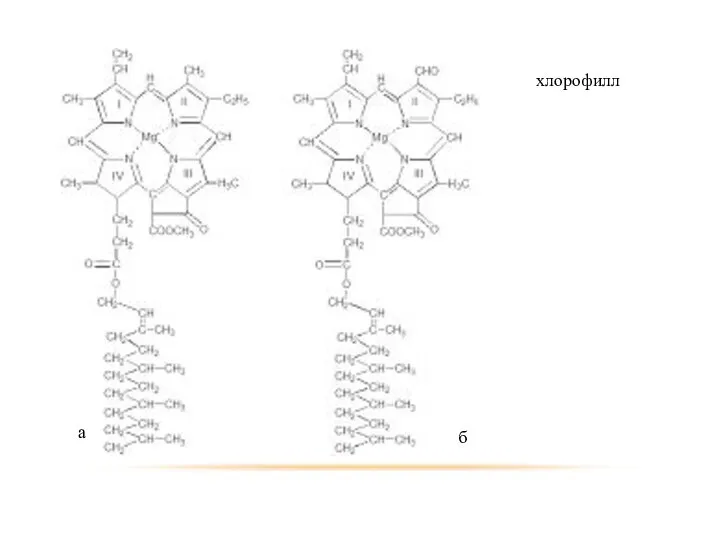
- 44. хлорофилл а б
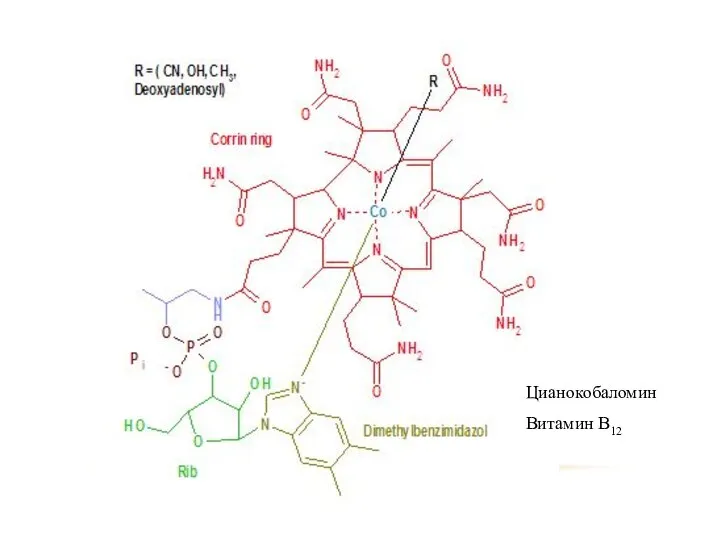
- 45. Цианокобаломин Витамин В12
- 46. АМИДЫ
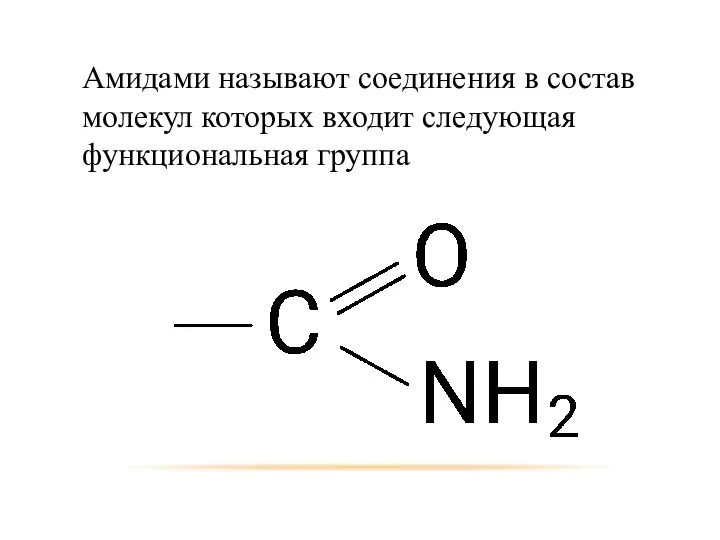
- 47. Амидами называют соединения в состав молекул которых входит следующая функциональная группа
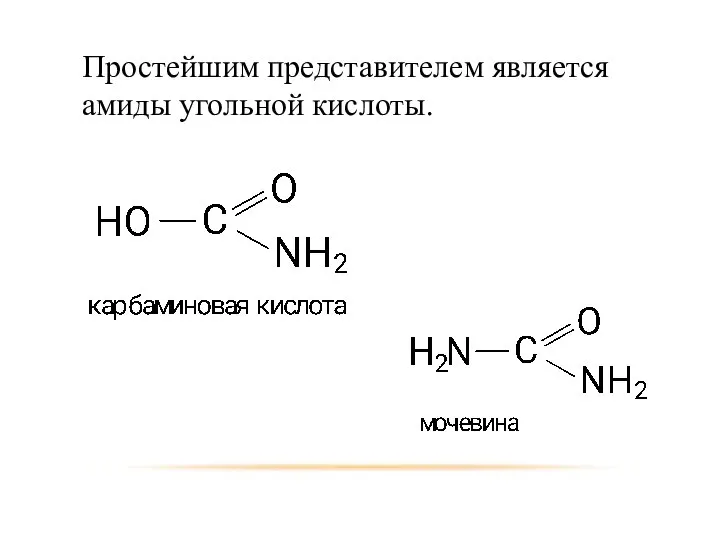
- 48. Простейшим представителем является амиды угольной кислоты.
- 49. МОЧЕВИНА является полным амидом угольной кислоты. Широко распространена в природе. Является конечным продуктом белкового обмена. При
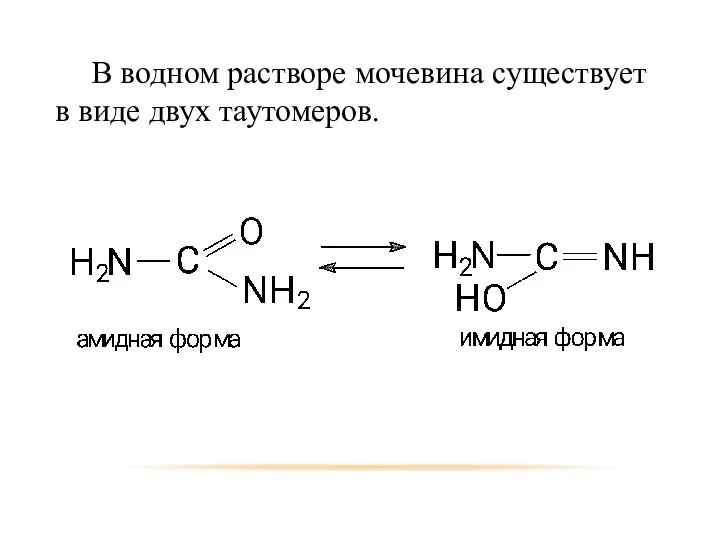
- 50. В водном растворе мочевина существует в виде двух таутомеров.
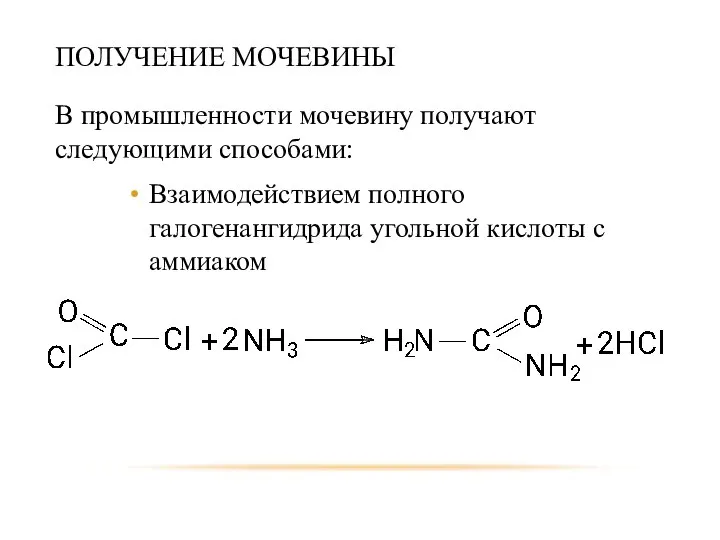
- 51. ПОЛУЧЕНИЕ МОЧЕВИНЫ В промышленности мочевину получают следующими способами: Взаимодействием полного галогенангидрида угольной кислоты с аммиаком
- 52. Взаимодействием аммиака с углекислым газом.
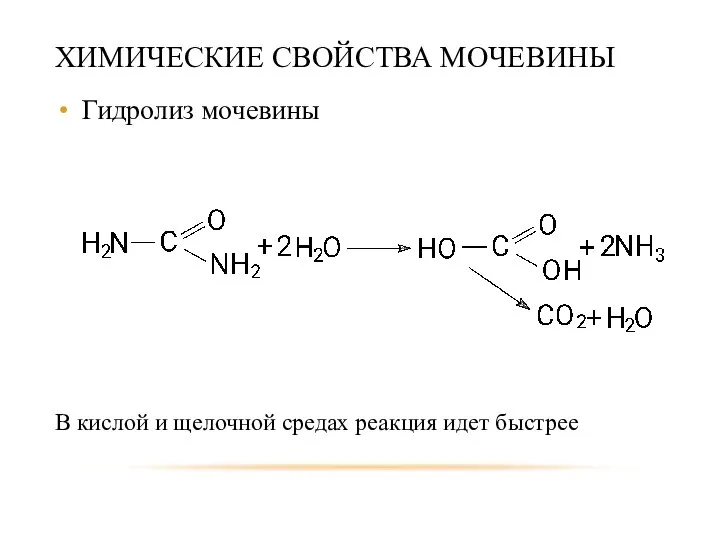
- 53. ХИМИЧЕСКИЕ СВОЙСТВА МОЧЕВИНЫ Гидролиз мочевины В кислой и щелочной средах реакция идет быстрее
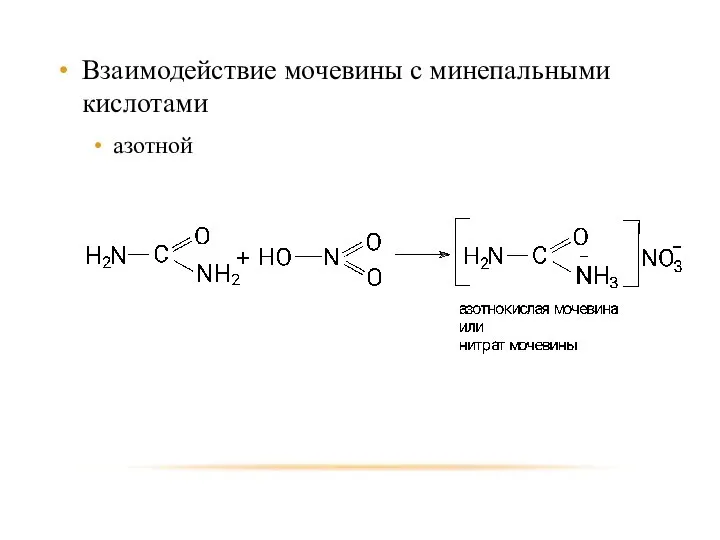
- 54. Взаимодействие мочевины с минепальными кислотами азотной
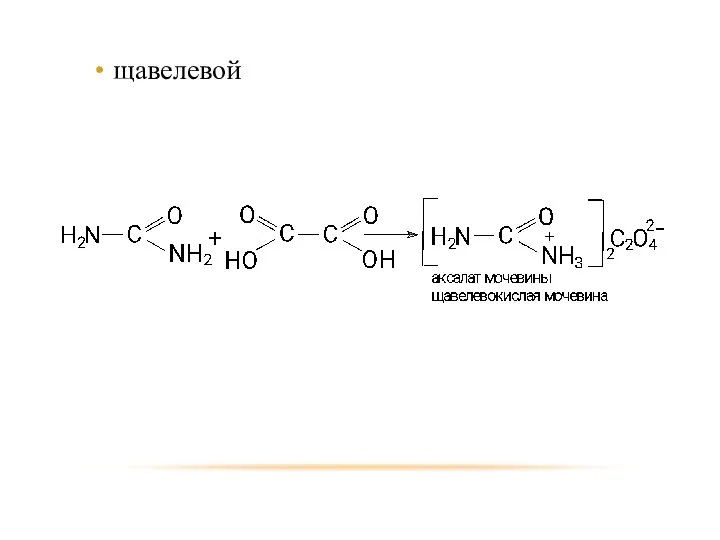
- 55. щавелевой
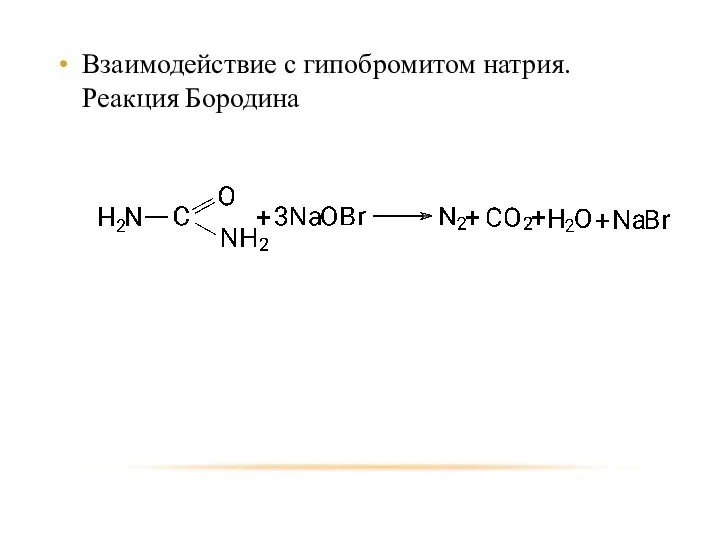
- 56. Взаимодействие с гипобромитом натрия. Реакция Бородина.
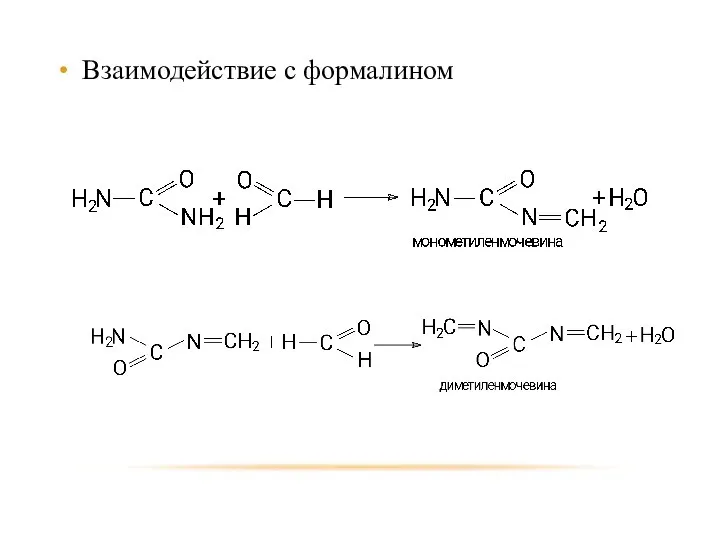
- 57. Взаимодействие с формалином
- 58. За счет разрыва двойных связей диметиленмочевина подвергается полимеризации с образованием мочевино-формальдегидных смол.
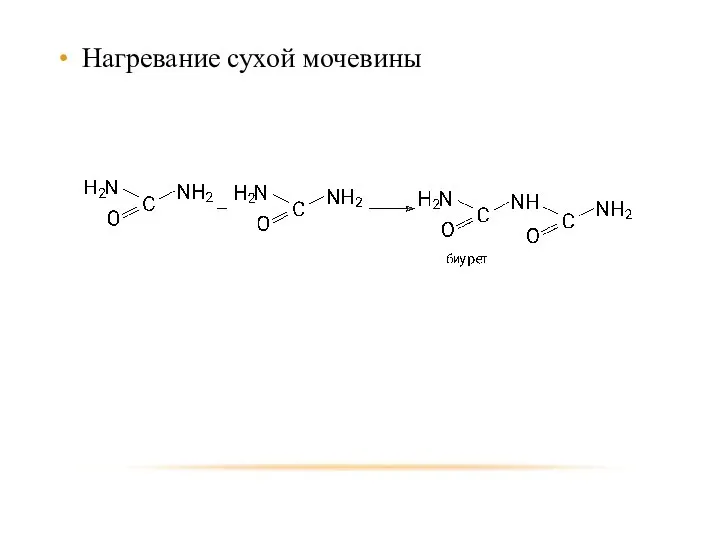
- 59. Нагревание сухой мочевины
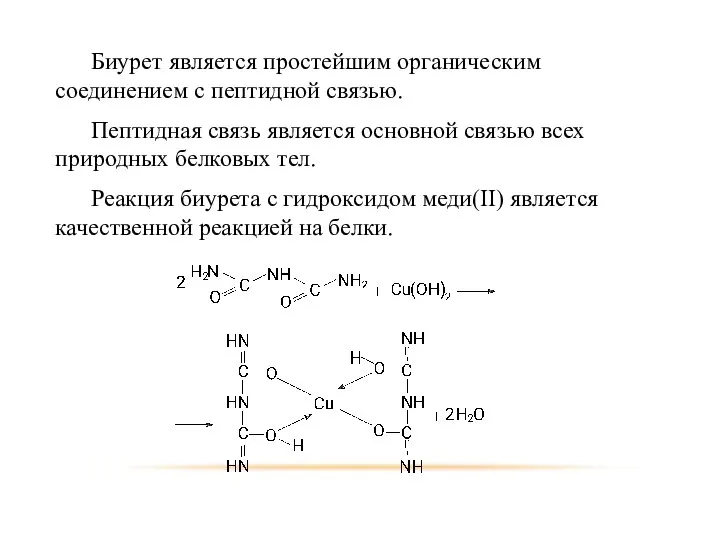
- 60. Биурет является простейшим органическим соединением с пептидной связью. Пептидная связь является основной связью всех природных белковых
- 61. Образование уреидов кислот
- 62. АМИНОКИСЛОТЫ
- 63. Аминокислотами называют такие производные карбоновых кислот, которые можно получить замещением одного или нескольких атомов водорода в
- 64. КЛАССИФИКАЦИИ В зависимости от количества карбоксильных групп: Одноосновные Двухосновные Многоосновные
- 65. В зависимости от количества аминогрупп: Моно-аминокислоты Ди-аминокислоты Три-аминокислоты В зависимости от строения радикала: С открытой цепью
- 66. НОМЕНКЛАТУРА УНИВЕРСАЛЬНАЯ: правила построения названий такие же как для карбоновых кислот только с указанием в префиксе
- 67. ИЗОМЕРИЯ Изомерия положения аминогруппы относительно карбоксильной группы. Различают α-, β-, γ-, δ-, ε- и т.д. Структурная
- 68. ПОЛУЧЕНИЕ α-Аминокислоты получают из природных веществ и синтетически Белки при гидролизе в водных растворах в присутствии
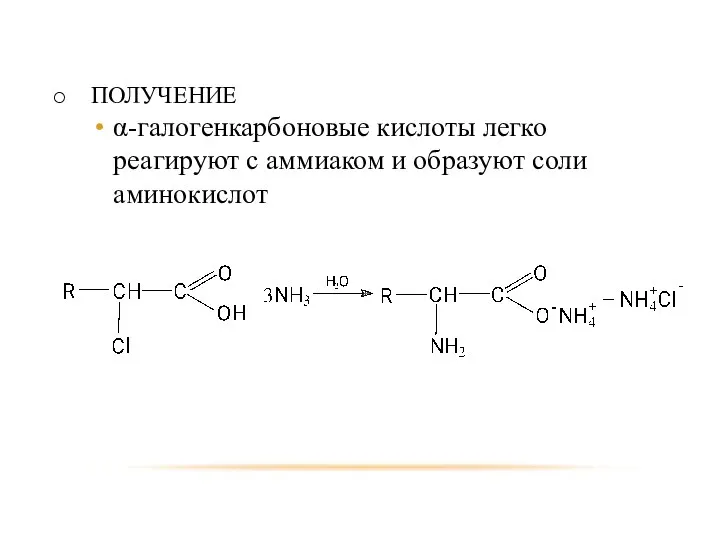
- 69. ПОЛУЧЕНИЕ α-галогенкарбоновые кислоты легко реагируют с аммиаком и образуют соли аминокислот
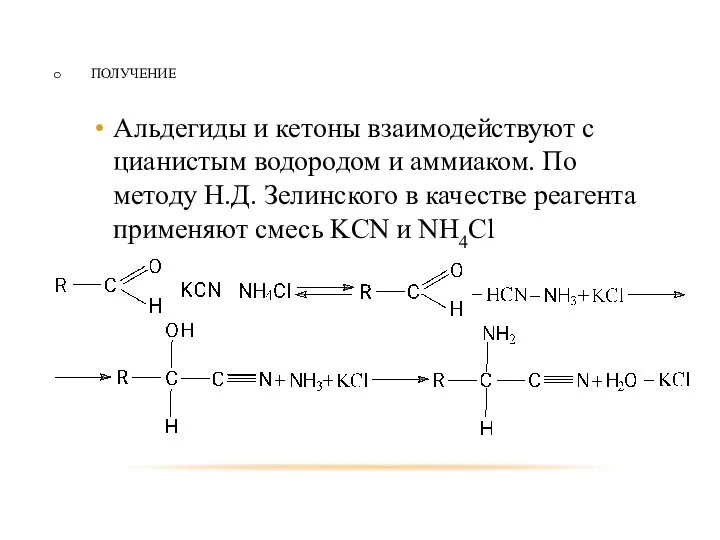
- 70. ПОЛУЧЕНИЕ Альдегиды и кетоны взаимодействуют с цианистым водородом и аммиаком. По методу Н.Д. Зелинского в качестве
- 71. ПОЛУЧЕНИЕ из альдегидов и кетонов Гидролиз нитрила приводит к образованию α-аминокислоты
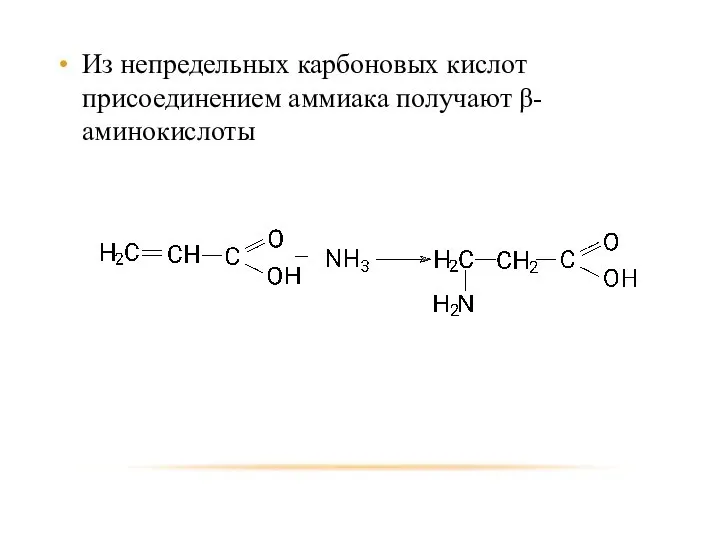
- 72. Из непредельных карбоновых кислот присоединением аммиака получают β-аминокислоты
- 73. ФИЗИЧЕСКИЕ СВОЙСТВА Аминокислоты – бесцветные кристаллические вещества, обладающие высокими показателями температуры плавления. Не летучи. Плавятся с
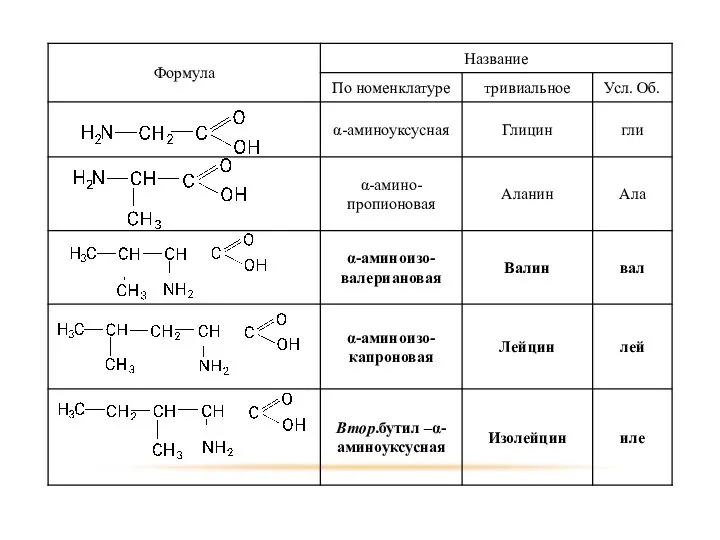
- 74. МОНОАМИНОКИСЛОТЫ
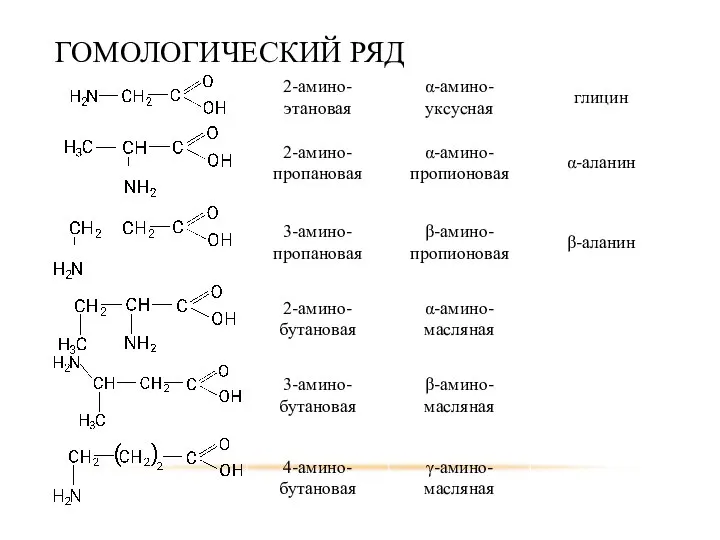
- 75. ГОМОЛОГИЧЕСКИЙ РЯД
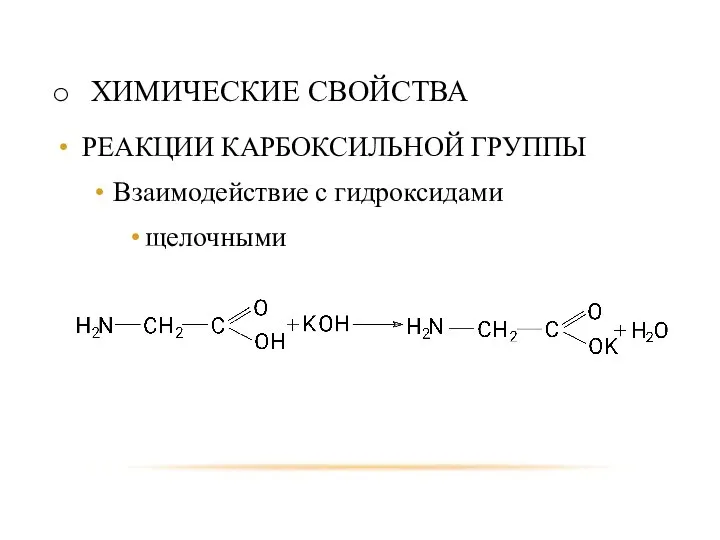
- 76. ХИМИЧЕСКИЕ СВОЙСТВА РЕАКЦИИ КАРБОКСИЛЬНОЙ ГРУППЫ Взаимодействие с гидроксидами щелочными
- 77. D-элементов
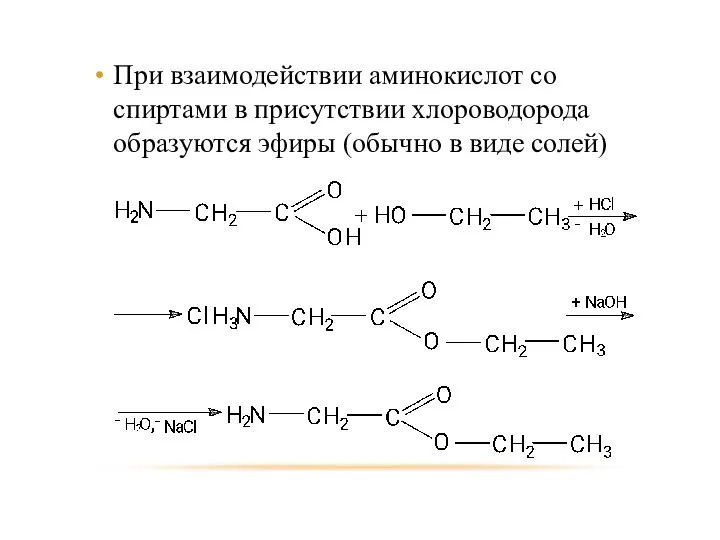
- 78. При взаимодействии аминокислот со спиртами в присутствии хлороводорода образуются эфиры (обычно в виде солей)
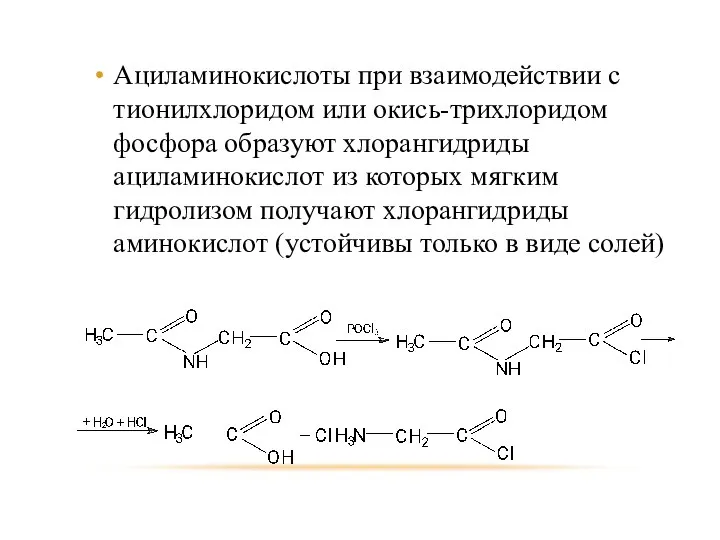
- 79. Ациламинокислоты при взаимодействии с тионилхлоридом или окись-трихлоридом фосфора образуют хлорангидриды ациламинокислот из которых мягким гидролизом получают
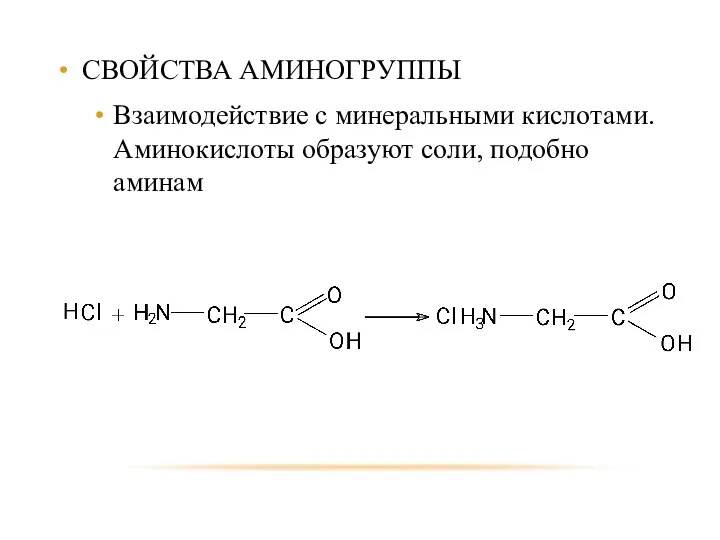
- 80. СВОЙСТВА АМИНОГРУППЫ Взаимодействие с минеральными кислотами. Аминокислоты образуют соли, подобно аминам
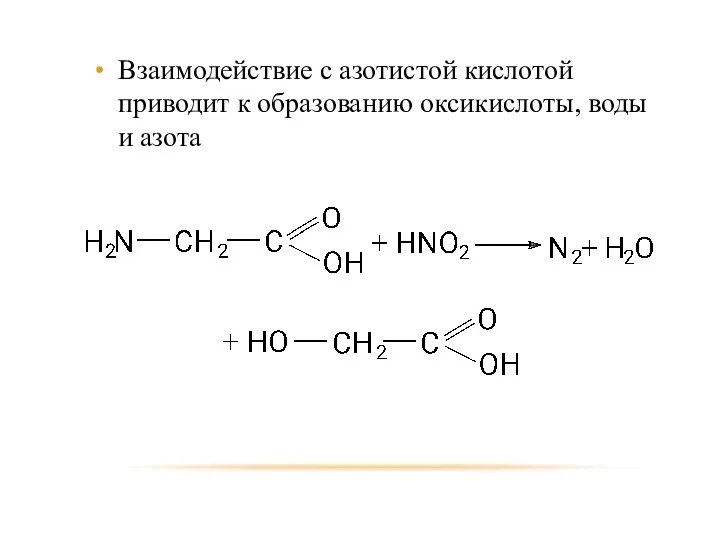
- 81. Взаимодействие с азотистой кислотой приводит к образованию оксикислоты, воды и азота
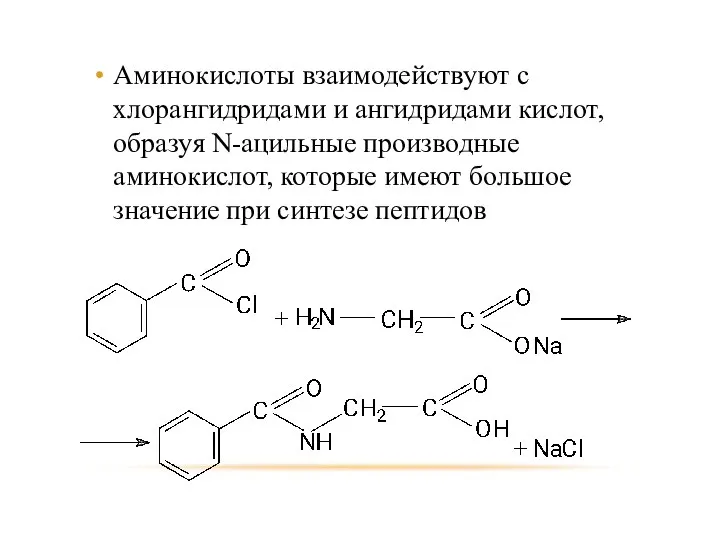
- 82. Аминокислоты взаимодействуют с хлорангидридами и ангидридами кислот, образуя N-ацильные производные аминокислот, которые имеют большое значение при
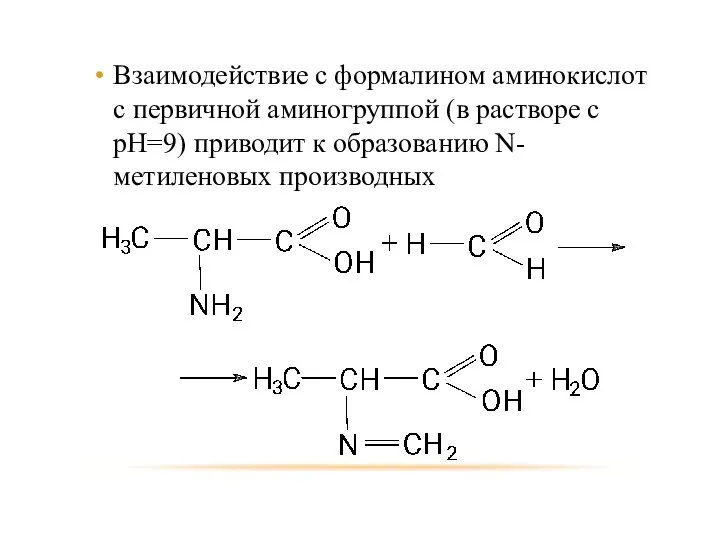
- 83. Взаимодействие с формалином аминокислот с первичной аминогруппой (в растворе с pH=9) приводит к образованию N-метиленовых производных
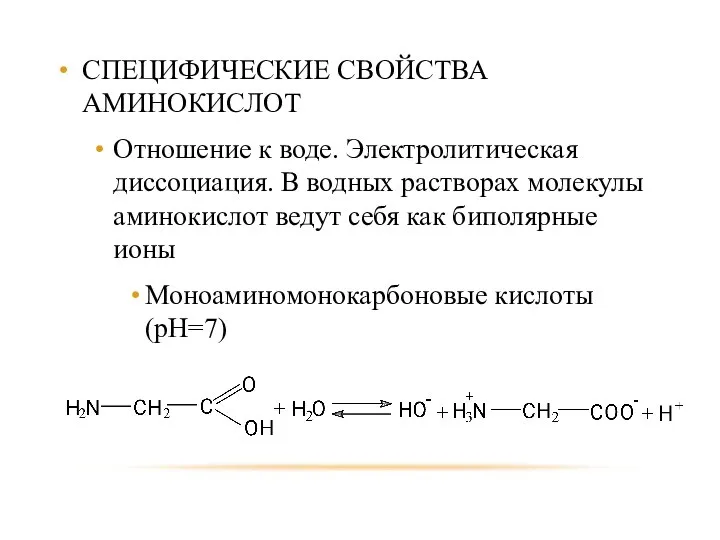
- 84. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Электролитическая диссоциация. В водных растворах молекулы аминокислот ведут себя как
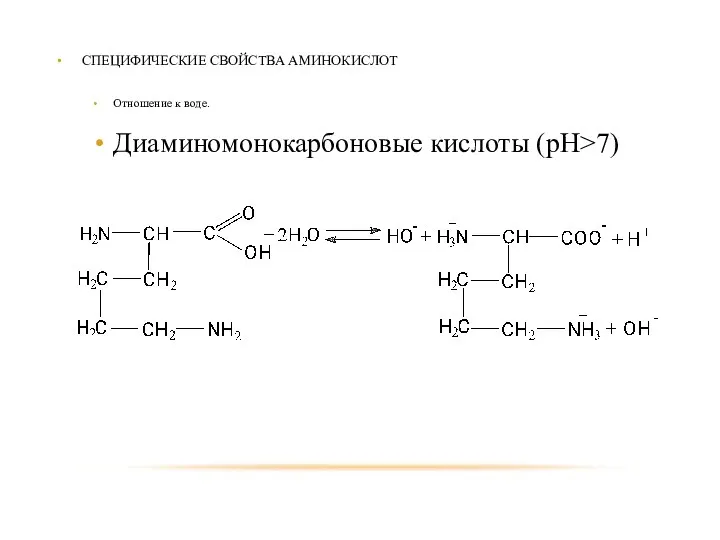
- 85. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Диаминомонокарбоновые кислоты (рН>7)
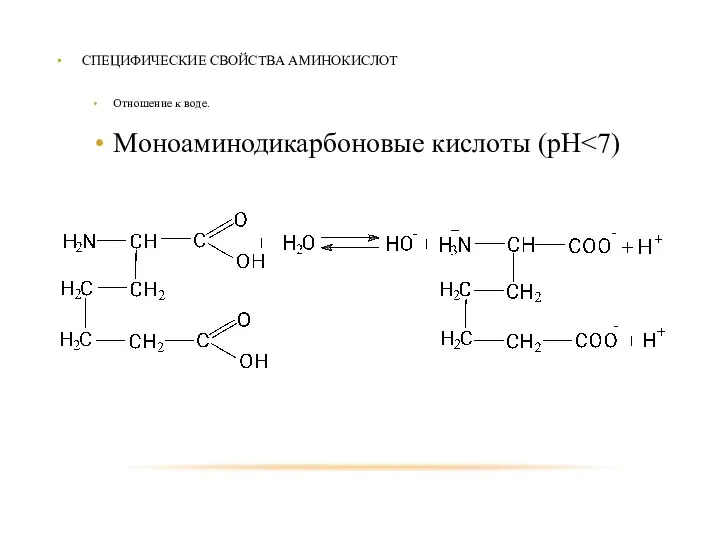
- 86. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к воде. Моноаминодикарбоновые кислоты (рН
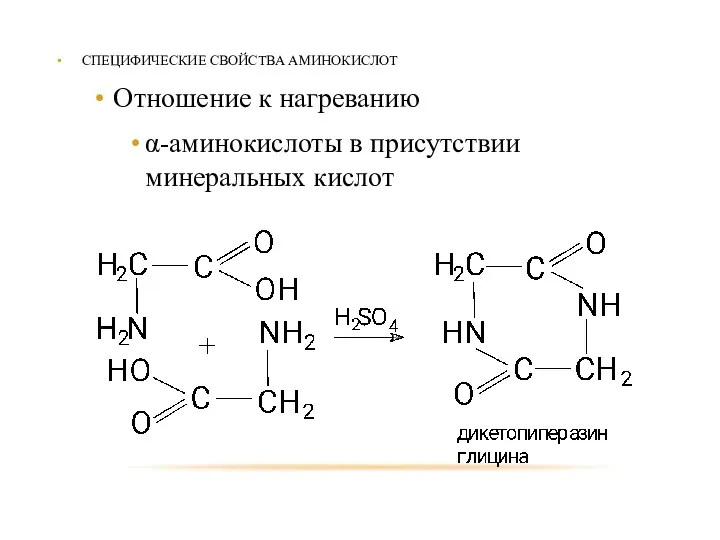
- 87. СПЕЦИФИЧЕСКИЕ СВОЙСТВА АМИНОКИСЛОТ Отношение к нагреванию α-аминокислоты в присутствии минеральных кислот
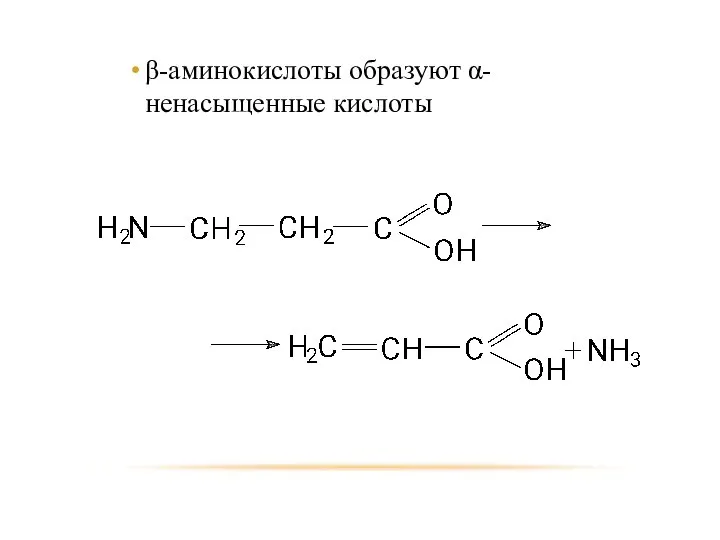
- 88. β-аминокислоты образуют α-ненасыщенные кислоты
- 89. γ- и δ-кислоты легко отщепляют воду и циклизуются, образуя внутренние амиды - лактамы
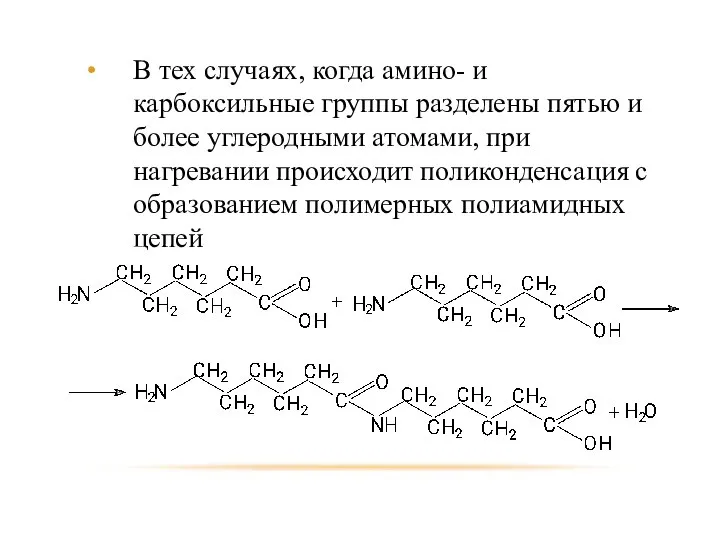
- 90. В тех случаях, когда амино- и карбоксильные группы разделены пятью и более углеродными атомами, при нагревании
- 91. Реакции, характерные для α-аминокислот. Декарбоксилирование. Под действием особых ферментов – декарбоксилаз или некоторых микроорганизмов α-аминокислоты превращаятся
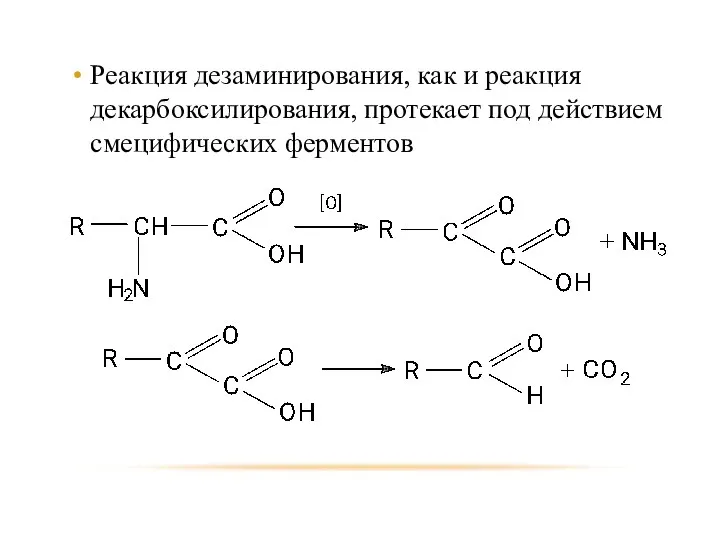
- 92. Реакция дезаминирования, как и реакция декарбоксилирования, протекает под действием смецифических ферментов
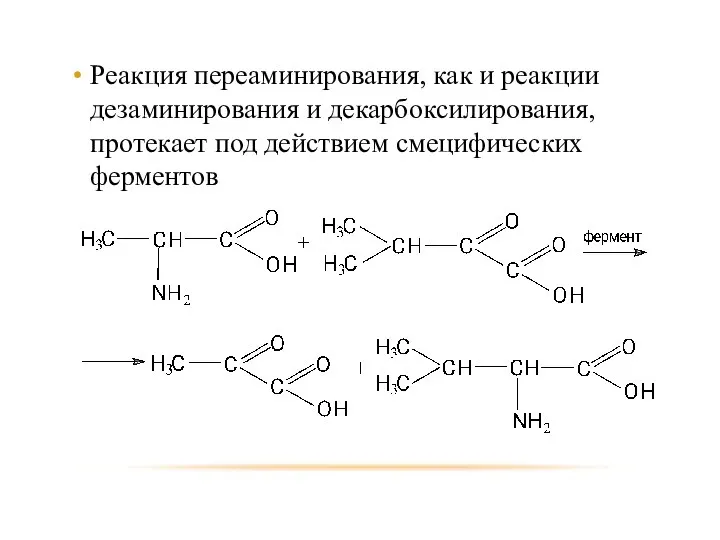
- 93. Реакция переаминирования, как и реакции дезаминирования и декарбоксилирования, протекает под действием смецифических ферментов
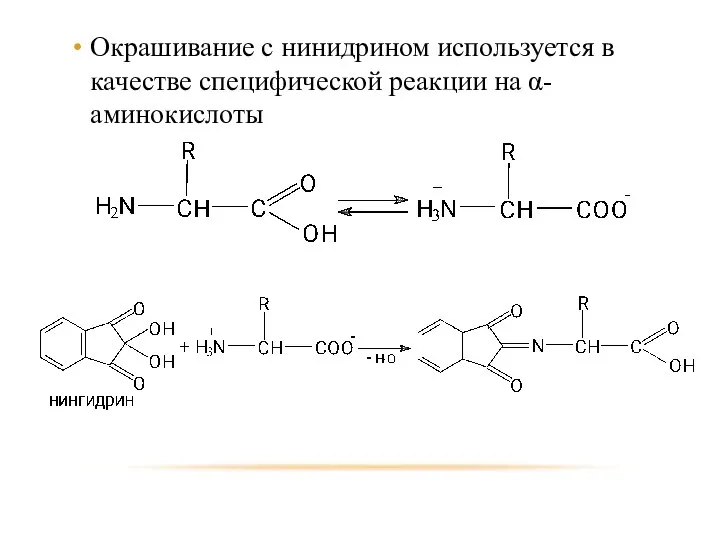
- 94. Окрашивание с нинидрином используется в качестве специфической реакции на α-аминокислоты
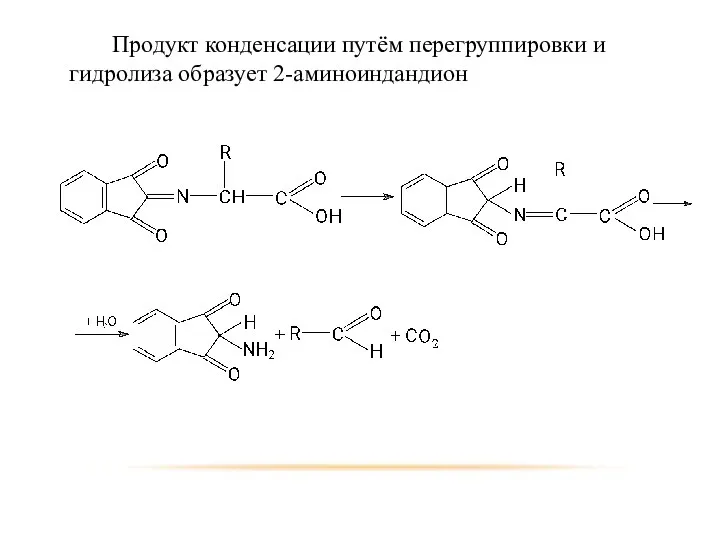
- 95. Продукт конденсации путём перегруппировки и гидролиза образует 2-аминоиндандион
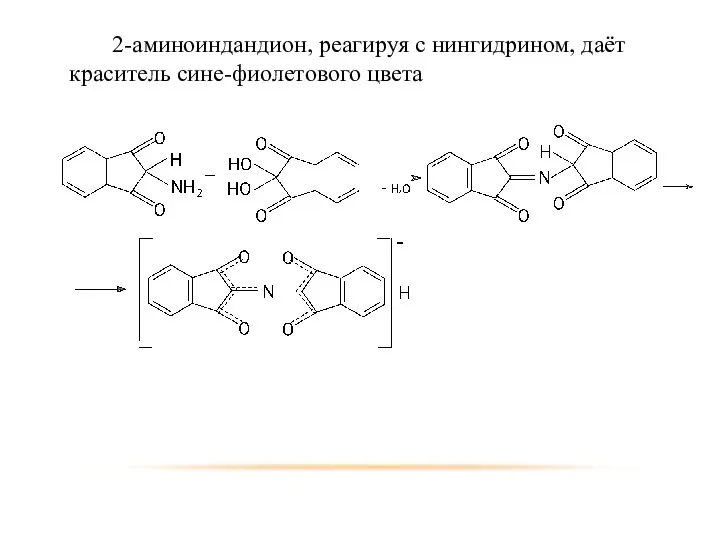
- 96. 2-аминоиндандион, реагируя с нингидрином, даёт краситель сине-фиолетового цвета
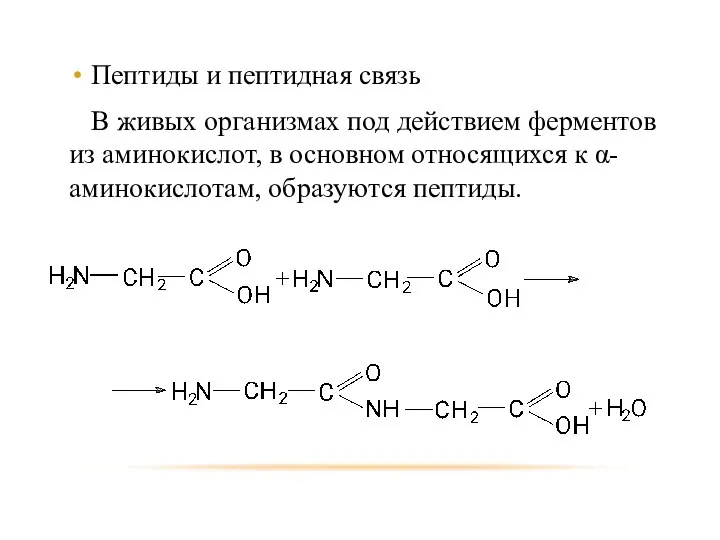
- 97. Пептиды и пептидная связь В живых организмах под действием ферментов из аминокислот, в основном относящихся к
- 98. Пептид состоящий из двух молекул аминокислот называют дипептидом, из трёх – трипептидом, из четырёх – тетропептидом
- 99. Чтобы соединить две аминокислоты пептидной связью, необходимо: а) защитить карбоксильную группу одной кислоты (например: превратив её
- 100. ДВУХОСНОВНЫЕ АМИНОКИСЛОТЫ
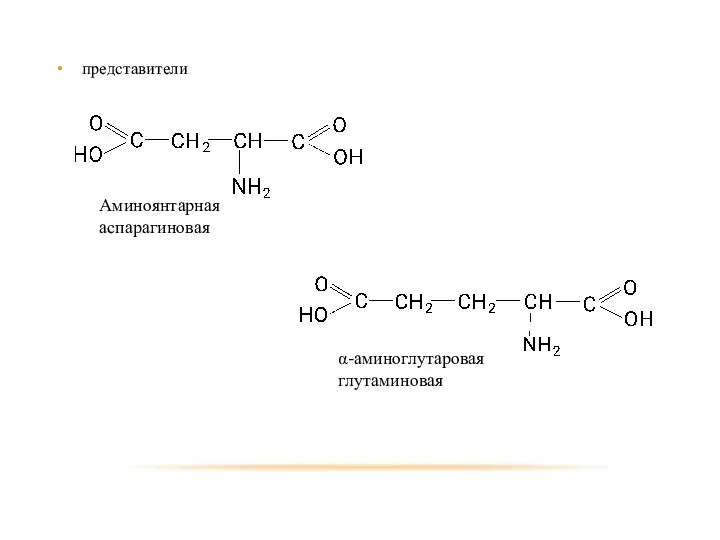
- 101. представители
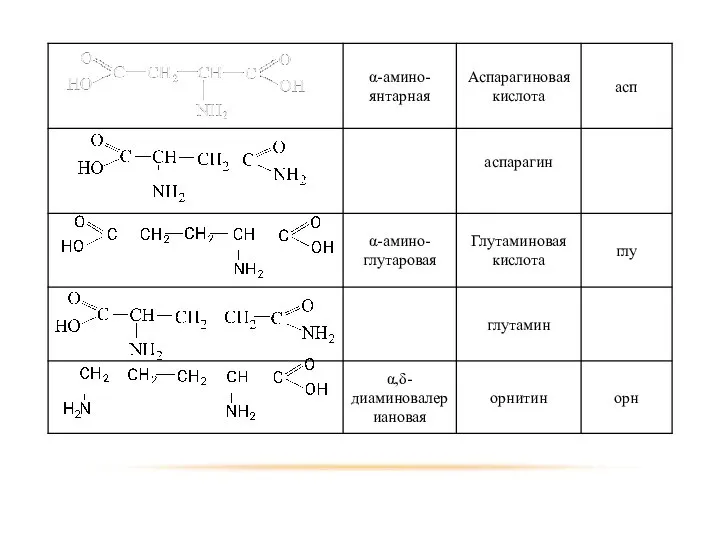
- 102. Двухосновные аминокислоты способны образовывать внутренние соли. Обе встречаются среди продуктов гидролиза белковых тел. Аспарагиновая кислота в
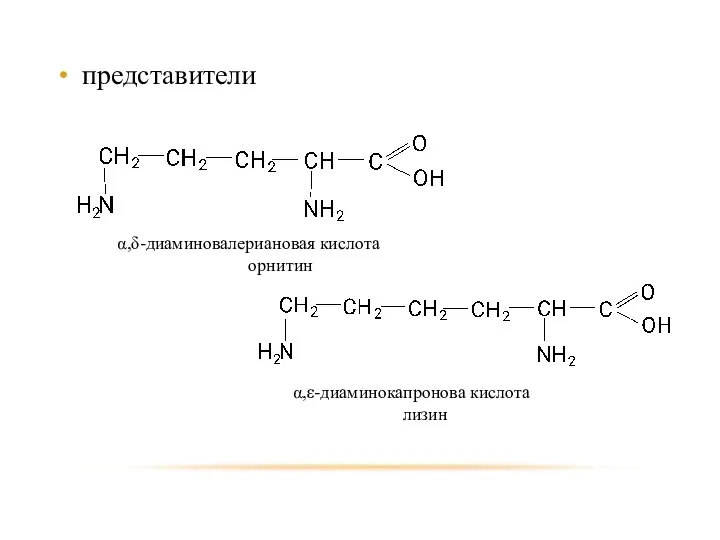
- 103. ДИАМИНОКИСЛОТЫ
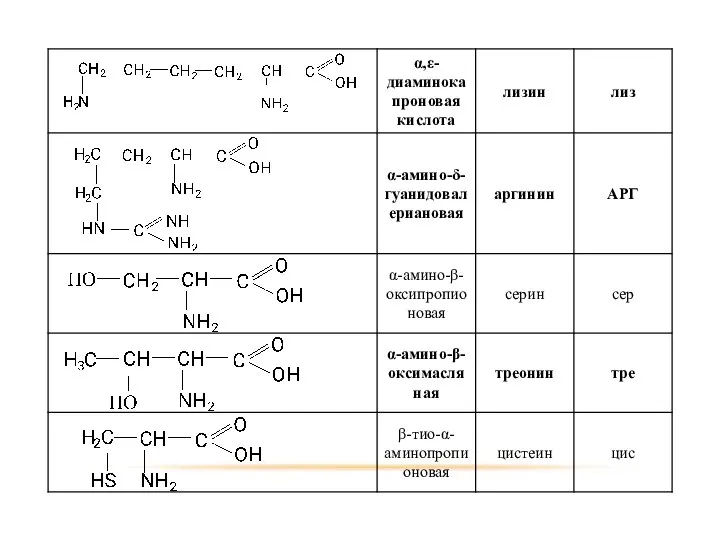
- 104. представители α,δ-диаминовалериановая кислота орнитин α,ε-диаминокапронова кислота лизин
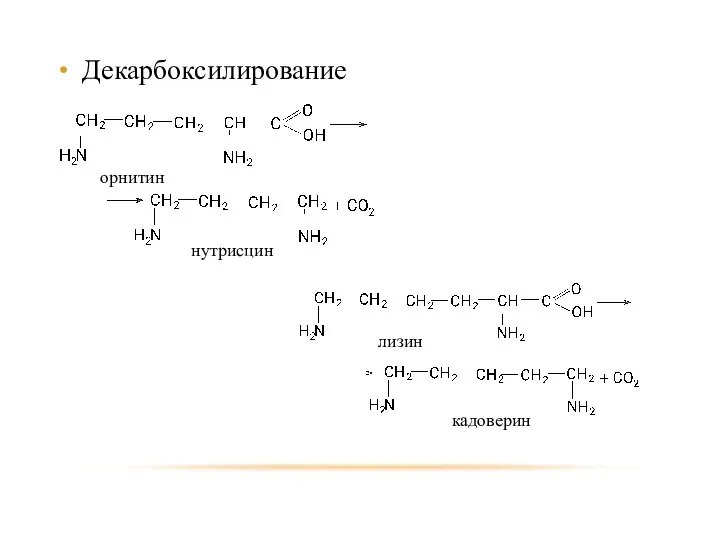
- 105. Декарбоксилирование орнитин лизин
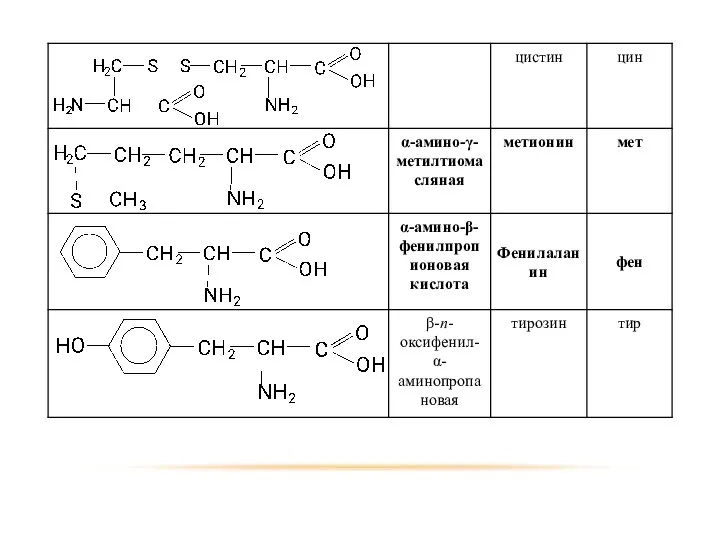
- 106. α-аминокислоты участвуют в синтезе белка. В состав белковых тел входят и такие аминокислоты, которые кроме аминогрупп
- 112. БЕЛКИ Белками, или белковыми веществами, называют высокомолекулярные органические соединения, молекулы которых построены из остатков α-аминокислот, связанных
- 113. БЕЛКИ Различают первичную, вторичную, третичную и четвертичную структуры белковых молекул. Все белки, независимо от того к
- 114. БЕЛКИ Глобулины – не растворимы в чистой воде, но растворимы в теплом 10%-ном растворе NaCl. Проламины
- 116. Скачать презентацию














































 Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Майлардың анықтамасы
Майлардың анықтамасы Общая радиохимия. Свойства радиоколлоидов
Общая радиохимия. Свойства радиоколлоидов Строение атома углерода
Строение атома углерода Да здравствует мыло душистое
Да здравствует мыло душистое Химические и физико-химические методы анализа. Сущность и методы качественного анализа
Химические и физико-химические методы анализа. Сущность и методы качественного анализа Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Уравнения химических реакций
Уравнения химических реакций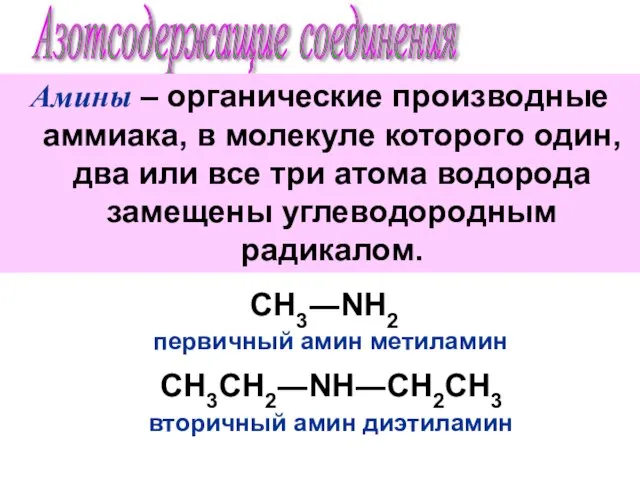 Азотсодержащие соединения. Амины
Азотсодержащие соединения. Амины Оборудование для дистилляции мисцеллы
Оборудование для дистилляции мисцеллы Гидролиз. Сущность процесса гидролиза
Гидролиз. Сущность процесса гидролиза Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Исследовательский проект «Кристаллы»
Исследовательский проект «Кристаллы» Минералы. Классы минералов
Минералы. Классы минералов Спирты
Спирты Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Пищевые добавки
Пищевые добавки Основания и кислоты. Тема 2
Основания и кислоты. Тема 2 Зміна ліпідів за технологічної обробки
Зміна ліпідів за технологічної обробки Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_
Презентация по Химии "Степень окисления" - скачать смотреть бесплатно_ Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть
Презентация по Химии "Высшие природные полимеры - Белки и Нуклеиновые кислоты" - скачать смотреть  Области применения спиртов
Области применения спиртов Применение синтетических полимеров в вооружении
Применение синтетических полимеров в вооружении Пластик, пластмасса
Пластик, пластмасса Распознавание химических соединений
Распознавание химических соединений Основы безопасности при уничтожении химического оружия
Основы безопасности при уничтожении химического оружия Сера и ее аллотропные модификации. (9 класс)
Сера и ее аллотропные модификации. (9 класс) Виды химической связи
Виды химической связи