Щелочные металлы Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных пре
Содержание
- 2. Строение и свойства атомов
- 3. ЛИТИЙ РУБИДИЙ НАТРИЙ ЦЕЗИЙ КАЛИЙ
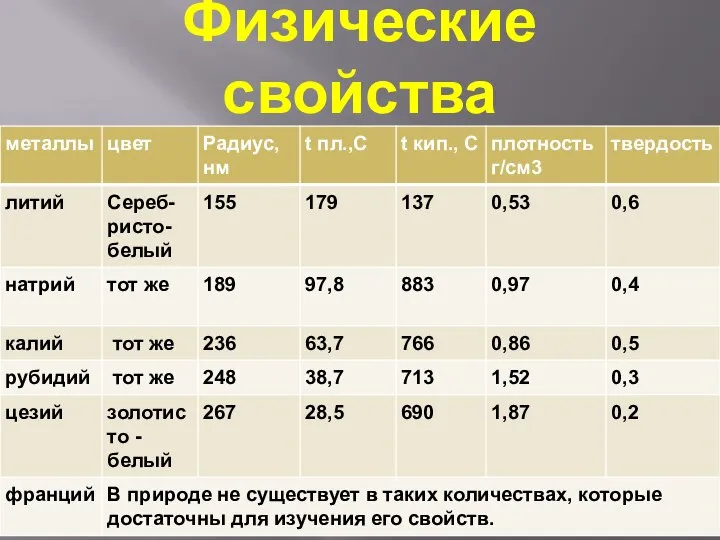
- 4. Физические свойства
- 5. Физические свойства Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их
- 6. ХИМИЧЕСКИЕ СВОЙСТВА Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже
- 7. 1. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Важное свойство щелочных металлов — их высокая активность по отношению к воде.
- 8. 2. С неметаллами С водородом образуют гидриды. Бурно реагируют с хлором и серой.
- 9. С кислородом реакция протекает по-разному: Только литий сгорает на воздухе с образованием оксида стехиометрического состава: При
- 10. Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в
- 11. Гидроксиды щелочных металлов Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями.
- 12. Карбонат натрия Карбонат натрия используется в стекольном производстве, мыловарении, в производстве стиральных и чистящих порошков, эмалей,
- 13. Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий. Хлорид натрия известен в
- 15. Скачать презентацию











 Соединения алюминия
Соединения алюминия Метаболизм. Энергетический обмен. Презентация к уроку биологии в 9 классе. Подготовила учитель биологии первой категории Медве
Метаболизм. Энергетический обмен. Презентация к уроку биологии в 9 классе. Подготовила учитель биологии первой категории Медве Насыщенный пар. Зависимость давления насыщенного пара от температуры. Кипение
Насыщенный пар. Зависимость давления насыщенного пара от температуры. Кипение Оценка солености воды реки Цны и питьевой бутилированной воды
Оценка солености воды реки Цны и питьевой бутилированной воды Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Подготовка к лабораторной работе
Подготовка к лабораторной работе Сверхпроводимость. Основные свойства
Сверхпроводимость. Основные свойства Определение реакции среды солей при гидролизе
Определение реакции среды солей при гидролизе Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Алкогольді мастықты талдаудың физико-химиялық әдістері
Алкогольді мастықты талдаудың физико-химиялық әдістері Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Строение атома
Строение атома Физикалық химия бағыты бойынша жеке бағдарланған индивидуалды ғылыми жұмыс
Физикалық химия бағыты бойынша жеке бағдарланған индивидуалды ғылыми жұмыс Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Химия гетероциклических соединений. Трехчленные циклы
Химия гетероциклических соединений. Трехчленные циклы Презентация по Химии "Классификация химических реакций" - скачать смотреть
Презентация по Химии "Классификация химических реакций" - скачать смотреть  Презентация по Химии "Кислоты" - скачать смотреть
Презентация по Химии "Кислоты" - скачать смотреть  Некоторые аспекты физической и коллоидной химии
Некоторые аспекты физической и коллоидной химии Отравляющие вещества
Отравляющие вещества  Атом – сложная частица
Атом – сложная частица Тонколистовой металл и проволока
Тонколистовой металл и проволока Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Спирты и их влияние на здоровье человека
Спирты и их влияние на здоровье человека Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про
Зеленая химия и проблемы устойчивого развития Член-корреспондент РАН Н.П.Тарасова РХТУ им.Д.И.Менделеева Институт химии и про Средства ухода за зубами 2011 МОУ «Лицей№3»
Средства ухода за зубами 2011 МОУ «Лицей№3» Ароматические углеводороды
Ароматические углеводороды Очистка рабочих электродов
Очистка рабочих электродов Органическая химия: Жиры
Органическая химия: Жиры