Содержание
- 2. Координационное число 4 1. Если комплексообразователь 3d – элемент и лиганды слабого поля ⇒ тетраэдрическое расщепление.
- 3. комплекс [Au(NH3)4]3+ Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4 комплексообразователь 5d- элемент ⇒ все
- 4. комплекс [NiCl4]2- комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. 4 Т.к. комп-тель 3d-элемент => по
- 5. Спектр видимого излучения и дополнительные цвета
- 6. Окраска комплексных соединений При поглощении кванта света (hν) электрон переходит с подуровня d, имеющего более низкую
- 7. Гексаакватитан (III) [Ti(H2O)6]3+ Комплекс поглощает свет в желто-зеленой области спектра (20300 см-1, λ≈ 500 нм). Это
- 8. комплекс [Сu(NH3)4]2+ Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4 комплексообразователь 3d- элемент ⇒ для
- 9. Ионная химическая связь А - nē→ Аn+ (катионы) А + nē→ Аn- (анионы) Электростатическое взаимодействие между
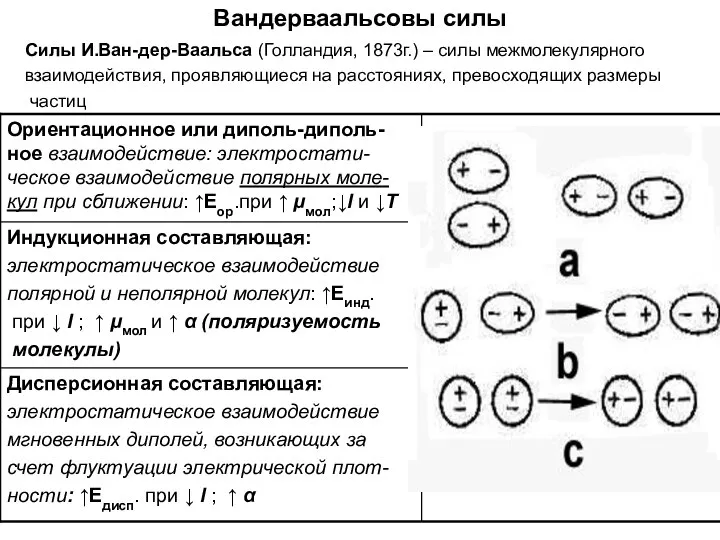
- 10. Вандерваальсовы силы Силы И.Ван-дер-Ваальса (Голландия, 1873г.) – силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры частиц
- 11. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия Е дисп. > Е ор. > Е инд. Е
- 12. ВОДОРОДНАЯ СВЯЗЬ Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы) и электроотри- цательным
- 13. ► Е(н-связи) возрастает с ↑ ЭО и ↓ размеров атомов В -Н ... F- > -Н
- 14. Изменение Т кип. в ряду однотипных молекул Н2О, НF и NН3 - аномально высокие Ткип и
- 16. Скачать презентацию

![комплекс [Au(NH3)4]3+ Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1408541/slide-2.jpg)
![комплекс [NiCl4]2- комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1408541/slide-3.jpg)


![Гексаакватитан (III) [Ti(H2O)6]3+ Комплекс поглощает свет в желто-зеленой области спектра (20300](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1408541/slide-6.jpg)
![комплекс [Сu(NH3)4]2+ Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1408541/slide-7.jpg)





 Задания на ЕГЭ
Задания на ЕГЭ Аттестационная работа. Образовательная программа элективного курса Химия вокруг нас
Аттестационная работа. Образовательная программа элективного курса Химия вокруг нас Классификация химических веществ СГС
Классификация химических веществ СГС Биохимия почвообразования. Кора выветривания. Круговорот веществ в природе. Гранулометрический состав почвы. (Лекция 2)
Биохимия почвообразования. Кора выветривания. Круговорот веществ в природе. Гранулометрический состав почвы. (Лекция 2) Глюкоза. Загальна схема виробництва цукру. Підготували Учениці 9-б класу Василенко Алла Коваленко Катя Сердюк Яна
Глюкоза. Загальна схема виробництва цукру. Підготували Учениці 9-б класу Василенко Алла Коваленко Катя Сердюк Яна  Презентация по Химии "Малахіт" - скачать смотреть
Презентация по Химии "Малахіт" - скачать смотреть  Реакции, которые необходимо знать выпускнику средней школы, сдающему ЕГЭ по химии
Реакции, которые необходимо знать выпускнику средней школы, сдающему ЕГЭ по химии Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Непрерывные реакторы для гомогенных гомофазных процессов
Непрерывные реакторы для гомогенных гомофазных процессов Циклоалканы. Лекция 4
Циклоалканы. Лекция 4 Муравьиная и уксусная кислоты
Муравьиная и уксусная кислоты Dzeramā ūdens sagatavošanas shēma
Dzeramā ūdens sagatavošanas shēma Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть
Презентация по Химии "Соединения серы (11 класс)" - скачать смотреть  Технология производства и свойства искусственных волокон
Технология производства и свойства искусственных волокон Уголь. Виды угля
Уголь. Виды угля Окислительно-восстановительные процессы. Лекция 8
Окислительно-восстановительные процессы. Лекция 8 Фосфор и его соединения
Фосфор и его соединения Кислотність твердих тіл. Основні методи дослідження. Суперкислотність
Кислотність твердих тіл. Основні методи дослідження. Суперкислотність Презентация по Химии "Железо" - скачать смотреть бесплатно
Презентация по Химии "Железо" - скачать смотреть бесплатно Хімія числа Е в продуктах харчування
Хімія числа Е в продуктах харчування  Презентация по Химии "Фосфорные удобрения" - скачать смотреть бесплатно
Презентация по Химии "Фосфорные удобрения" - скачать смотреть бесплатно Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Химия элементов VIIIA группы
Химия элементов VIIIA группы Органическая химия
Органическая химия Ионные уравнения
Ионные уравнения Reactions and equations lab
Reactions and equations lab Углерод и его соединения
Углерод и его соединения Коррозия металлов Учитель химии: Ильязова Р. Т.
Коррозия металлов Учитель химии: Ильязова Р. Т.