Содержание
- 2. Оригінальні лікарські засоби У зв’язку з динамічним розвитком фармацевтичного ринку дедалі частіше постає питання щодо оригінальних
- 3. Розробка та впровадження Процес розробки та впровадження нового лікарського препарату потребує участі багатьох висококваліфікованих спеціалістів, великих
- 4. Суб’єкти створення лікарських засобів Лікарські засоби можуть створюватись підприємствами, установами, організаціями та громадянами. Автором лікарського засобу
- 5. Етапи створення нових лікарських засобів Першим етапом є пошук та отримання нових речовин (синтезованих або виділених
- 6. Доклінічні дослідження Наступний етап доклінічного вивчення передбачає: • з’ясування специфічної фармакологічної дії на різних моделях захворювань
- 7. Клінічні випробування Якщо результати доклінічних досліджень, на етапі яких майбутні ліки мають назву «фармакологічних препаратів», переконують
- 8. Препарат має затверджену при реєстрації міжнародну непатентовану назву (МНН) і торгову (фірмову) назву, під якою його
- 9. Генериком (дженериком) називається непатентований лікарський препарат, який є відтворенням оригінального препарату, на діючі речовини якого збіг
- 10. Центральним питанням проблеми порівняння генериків із оригінальним препаратом є гарантована взаємозамінність. Вона, у свою чергу, базується
- 11. Фармакокінетична еквівалентність (біоеквівалентність), або ступінь схожості за фармакокінетичними параметрами фармацевтично еквівалентного препарату з референтним, означає, що
- 12. Роздрібні ціни на препарати амлодипіну станом на 01.11.2016 р
- 13. Актуальність проблеми вартості лікарських препаратів для України не потребує обговорення. Так, згідно з результатами соціологічного опитування,
- 14. ЗАКОН УКРАЇНИ «Про лікарські засоби” № 124/96-ВР від 04.04.96, ВВР, 1996, № 22, ст. 87 Розділ
- 15. В рамках НВО «Фарматрон» вперше в Україні налагоджено промисловий випуск «Тіотріазоліну» в таблетках, ампульних розчинах, ін’єкційних
- 16. Державні та міжнародні стандарти якості, як основа запобігання розповсюдженню неякісних та фальсифікованих лікарських засобів У відповідності
- 17. Стандартизація лікарських засобів - діяльність щодо встановлення правил, норм і характеристик для загального і багаторазового використання
- 18. Державна фармакопея України головний стандарт фармацевтичної галузі Державна Фармакопея України - Відповідно до Закону України «Про
- 19. Державна Фармакопея України 2.0 ДФУ 2 - це перша національна фармакопея України як повноправного члена ЄФ.
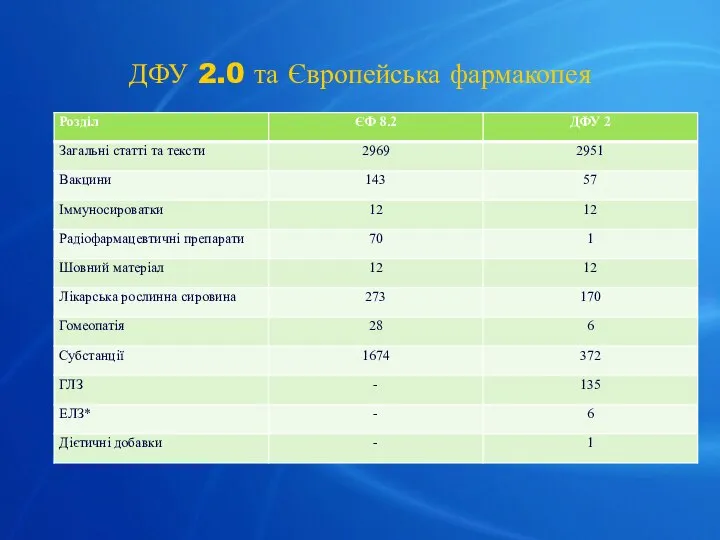
- 20. ДФУ 2.0 та Європейська фармакопея
- 21. Загальний обсяг ДФУ 2 перевищує 2000 сторінок, тому вона видається в трьох томах
- 23. Скачать презентацию



















 Тема: “Загальна характеристика основ”.
Тема: “Загальна характеристика основ”.  Природні гази
Природні гази Метаболизм этанола
Метаболизм этанола Химическое уравнение
Химическое уравнение Презентация по Химии "Углеводы" - скачать смотреть
Презентация по Химии "Углеводы" - скачать смотреть  Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Взаимодействие веществ
Взаимодействие веществ Інсектициди для захисту сливи та персеку
Інсектициди для захисту сливи та персеку ПРИРОДНЫЕ ЯДЫ
ПРИРОДНЫЕ ЯДЫ Введение в химическую термодинамику
Введение в химическую термодинамику Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов
Особенности гигиенического нормирования экзогенных химических веществ в воде водоемов Кислород
Кислород Ароматичні вуглеводні
Ароматичні вуглеводні Применение нитратов
Применение нитратов Кетоновые тела
Кетоновые тела Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы" - скачать смотреть бесплат Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа
Аттестационная работа. Методическая разработка индивидуальной исследовательской работы по химии педагогического колледжа Кремний и его соединения
Кремний и его соединения Сополимеризация. Основные количественные характеристики процесса сополимеризации
Сополимеризация. Основные количественные характеристики процесса сополимеризации Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона
Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона Условная оптимизация методом классического математического анализа с применением множителей
Условная оптимизация методом классического математического анализа с применением множителей Презентация по Химии "«Кислоты" - скачать смотреть бесплатно
Презентация по Химии "«Кислоты" - скачать смотреть бесплатно Аминокислоты, белки
Аминокислоты, белки Метанол. Фізичні властивості
Метанол. Фізичні властивості Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза
Выделение нефтегазоматеринских пород по данным пиролиза. Построение геохимического разреза