Содержание
- 2. Что называется химической реакцией? С какими типами химических реакций вы уже знакомы? Какие ещё способы классификации
- 3. Что такое скорость химической реакции? Какое значение имеет это понятие для химического производства? Цель урока: Изучение
- 4. Определение: Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в единице объёма.
- 5. Пояснение: Иными словами, скорость реакции – это изменение концентрации одного из реагирующих веществ в единицу времени.
- 6. Работа с книгой. Ответьте на вопрос: От чего зависит скорость химической реакции?
- 7. Скорость реакции, факторы: Фактор внутренних химических связей: Природа реагирующих веществ (прочность химических связей в веществе) def
- 8. Скорость реакции, факторы: Фактор температуры (энергии активации): def : Энергия активации – энергия промежуточного состояния, выше
- 9. Скорость реакции, факторы: Правило Вант-Гоффа: Здесь rТ2 и rТ1 – скорости реакции соответственно при температурах T2
- 10. Скорость реакции, факторы: Фактор Катализатора: def : Катализатор – промежуточный реагент, понижающий энергию активации химической реакции,
- 11. Скорость реакции, факторы: Фактор Ингибитора: def : Ингибитор — вещество, замедляющие или предотвращающие течение различных химических
- 12. Скорость реакции, факторы: Фактор Концентрации (Закон действующих масс) def : Закон действующих масс устанавливает соотношение между
- 13. Скорость реакции, факторы: Фактор Концентрации (Закон действующих масс) def : Константа равновесия – постоянная величина, полученная
- 14. Скорость реакции, факторы: Фактор поверхность соприкосновения реагирующих веществ. Чем мельче твёрдые частицы, тем больше поверхность соприкосновения
- 15. Скорость реакции, заключение: Итак: скорость химической реакции определяется как изменение молярной концентрации одного из реагирующих веществ
- 16. Причиной увеличения скорости реакции при повышениии концентрации веществ является: 1) увеличение числа столкновения молекул; 2)увеличение энергии
- 17. При обычных условиях с наименьшей скоростью происходит реакция между: 1)Fe и O2; 2)Na и O2; 3)CaCO3
- 18. Скорость химической реакции: Al(OH)3(тв.) +3H =Al +3H2O Не зависит от: 1)Природы взятой кислоты; 2)Концентрации ионов алюминия;
- 19. Скорость химической реакции окисления оксида серы(4) уменьшается при: 1)использовании катализатора; 2)понижения температуры; 3)увеличения концентрации кислорода; 4)увеличения
- 21. Скачать презентацию


















 Градуировка спектральных приборов
Градуировка спектральных приборов CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4)
Ферменты,структура и механизм действия. Классификация и номенклатура. (Лекция 4) Хімія для розвитку біо- та нанотехнологій
Хімія для розвитку біо- та нанотехнологій Каталитикалық риформинг
Каталитикалық риформинг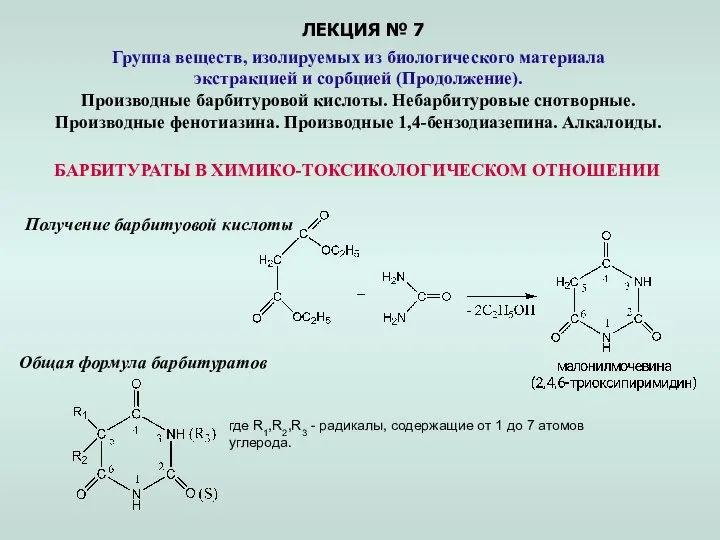 Группа веществ, изолируемых из биологического материала экстракцией и сорбцией. (Лекция 7)
Группа веществ, изолируемых из биологического материала экстракцией и сорбцией. (Лекция 7) Уравнение состояния идеального газа
Уравнение состояния идеального газа Наглядное пособие «Динамические модели». Химическое равновесие в растворах
Наглядное пособие «Динамические модели». Химическое равновесие в растворах Квантовая химия
Квантовая химия Презентация по Химии "Хлор" - скачать смотреть
Презентация по Химии "Хлор" - скачать смотреть  Штучні і синтетичні волокна
Штучні і синтетичні волокна  Презентация по Химии "Биатлон" - скачать смотреть бесплатно
Презентация по Химии "Биатлон" - скачать смотреть бесплатно Методы получения органических галогенидов
Методы получения органических галогенидов Химические свойства кислот
Химические свойства кислот Аттестационная работа. Химия в продуктах питания
Аттестационная работа. Химия в продуктах питания Химические войска в годы Великой Отечественной войны (1941-1945)
Химические войска в годы Великой Отечественной войны (1941-1945) Повторительное обобщение по неорганической химии, подготовка к ГИА
Повторительное обобщение по неорганической химии, подготовка к ГИА Биологическая химия с основами физической и коллоидной химии
Биологическая химия с основами физической и коллоидной химии Химический элемент - бром
Химический элемент - бром Пожар, как комплекс физических и химических процессов и явлений. Параметры развития пожара
Пожар, как комплекс физических и химических процессов и явлений. Параметры развития пожара Презентация по Химии "Видатні хіміки" - скачать смотреть бесплатно
Презентация по Химии "Видатні хіміки" - скачать смотреть бесплатно Тема урока: «Факторы, влияющие на скорость химических реакций».
Тема урока: «Факторы, влияющие на скорость химических реакций».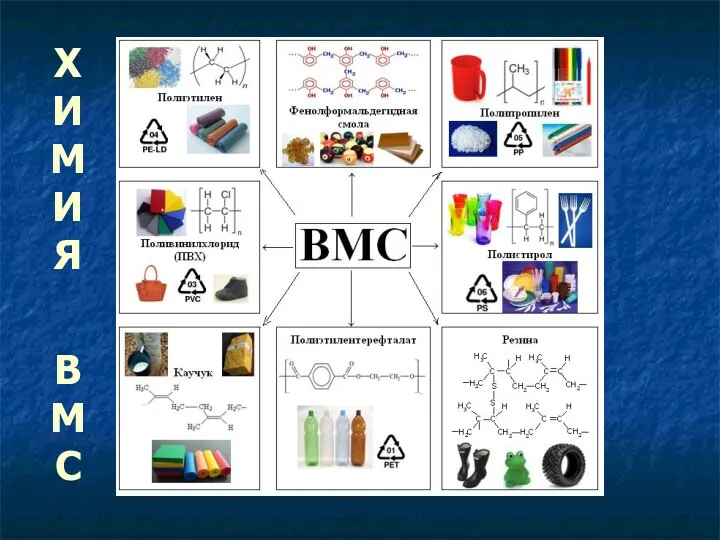 Химия высокомолекулярных соединений (ВМС)
Химия высокомолекулярных соединений (ВМС) Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері
Коллоидтық химия және беттік құбылыстар химиясының негізгі түсініктемелері Симметрия в химии. Кристаллы
Симметрия в химии. Кристаллы Классификация сталей
Классификация сталей Полимеры в стоматологии. Ингредиенты полимерных стоматологических материалов
Полимеры в стоматологии. Ингредиенты полимерных стоматологических материалов Алкадиены. Каучуки
Алкадиены. Каучуки