Содержание
- 2. СОДЕРЖАНИЕ: Что такое соль Классификация солей Способы получения Физические свойства Химические свойства солей Применение солей в
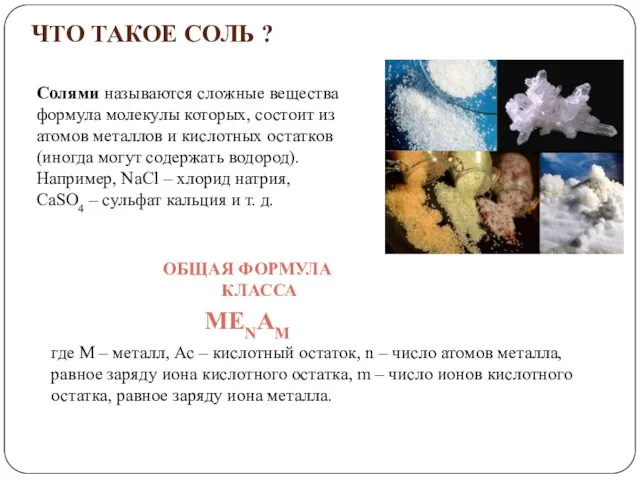
- 3. Солями называются сложные вещества формула молекулы которых, состоит из атомов металлов и кислотных остатков (иногда могут
- 5. Исключением являются соли аммония, в которых с кислотными остатками связаны не атомы металла, а частицы NH4+.
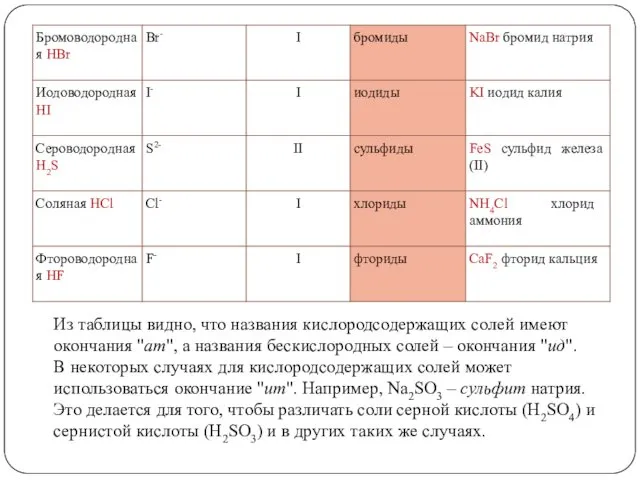
- 6. Названия солей составляются из названия кислотного остатка и названия металла. Главным в названии является кислотный остаток.
- 7. Из таблицы видно, что названия кислородсодержащих солей имеют окончания "ат", а названия бескислородных солей – окончания
- 8. КЛАССИФИКАЦИЯ СОЛЕЙ Средние (нормальные) соли — все атомы водорода в молекулах кислоты замещены на атомы металла.
- 9. Смешанные соли — состоят из общего металла и различных кислотных остатков . Пример. CuOHNO3 + CH3COOH
- 10. СПОСОБЫ ПОЛУЧЕНИЯ Соли получают при химическом взаимодействии соединений различных классов и простых веществ. 1. Реакция нейтрализации:
- 11. 4. Взаимодействие основных оксидов с кислотными оксидами. CaO + SiO2 = CaSiO3 5. Взаимодействие оснований с
- 12. ФИЗИЧЕСКИЕ СВОЙСТВА СОЛЕЙ Соли, за небольшим исключением, являются твёрдыми кристаллическими веществами различного цвета. По растворимости в
- 13. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ Соли взаимодействуют: C простыми веществами – металлами и неметаллами. со сложными – кислотами,
- 14. 3. С кислотами: 2NaCl + H2SO4 = = Na2SO4 + 2HCl 4. С щелочами: FeCl2 +
- 15. ПРИМЕНЕНИЕ СОЛЕЙ В НАРОДНОМ ХОЗЯЙСТВЕ Соли соляной кислоты. Из хлоридов больше всего используют хлорид натрия и
- 16. Соли азотной кислоты. Нитраты больше всего используют в качестве удобрений в сельском хозяйстве. Важнейшим из них
- 18. Скачать презентацию













 Миметик глицина на основе производного Гераниола
Миметик глицина на основе производного Гераниола Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Химические процессы
Химические процессы Бор (Borum)
Бор (Borum) Химия и стирка
Химия и стирка  Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть
Презентация по Химии "Электролиз расплавов и растворов" - скачать смотреть  Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии д.з.051
д.з.051 Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3)
Химические и физико-химические методы стандартизации и контроля качества лекарственных. (Лекция 3) Азотная кислота
Азотная кислота Окислительно-восстановительные реакции. (Лекция 18)
Окислительно-восстановительные реакции. (Лекция 18) Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6)
Переваривание углеводов в пищеварительном тракте. Гликолиз. Окислительное декарбоксилирование пирувата. (Тема 6) Майда еритін витаминдер. А,D,E,K витаминдері
Майда еритін витаминдер. А,D,E,K витаминдері Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Презентация Соли
Презентация Соли Lekcii_ - 2017-lech_ped 11
Lekcii_ - 2017-lech_ped 11 V група періодичної системи Менделєєва
V група періодичної системи Менделєєва Химико-технологические процессы современных производств
Химико-технологические процессы современных производств Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа Химическая идентификация
Химическая идентификация Почему протекают химические реакции
Почему протекают химические реакции Презентация по Химии "Солі в природі" - скачать смотреть бесплатно
Презентация по Химии "Солі в природі" - скачать смотреть бесплатно Пегматитовые месторождения
Пегматитовые месторождения Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан
Ароматичні вуглеводні Арени Підготував Учень 11-А класу Пазуханич Руслан 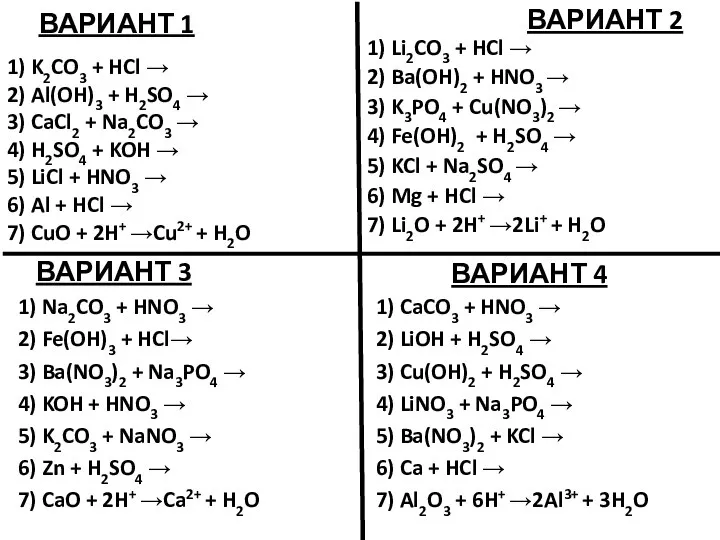 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)
Методы измерения и приборное обеспечение радиационно-экологического мониторинга. (Лекция 6)