Содержание
- 2. Химия – фундаментальная наука и необходимый инструмент исследования и познания процессов в различных системах, в том
- 3. Роль химической подготовки в системе подготовки врача Современная химия – фундаментальная наука об окружающем мире, научная
- 4. Такие медицинские проблемы как влияние загрязнений окружающей среды, техногенных катастроф, производства удобрений, пестицидов, отравляющих веществ, наркотиков,
- 5. Изучение химии включает постоянное установление причинно-следственных связей, что увеличивает развивающий потенциал этой дисциплины; решение химических задач
- 6. МОДУЛИ КУРСА ХИМИИ Основы общей химии Закономерности протекания реакций, Типы реакций в живых организмах Основы БОХ
- 7. Основные понятия химии ВЕЩЕСТВО: Состав, структура, термодинамическая характеристика, свойства, биологическая роль ПРОЦЕСС: Термодинамическая характеристика, кинетическая характеристика,
- 8. Энергетическая характеристика вещества и химических процессов Термодинамика изучает: соотношение между тепловой и другими формами энергии в
- 9. Основные понятия Если система обменивается с окружающей средой массой и теплом, она называется открытой (человек). Если
- 10. Стационарное состояние отрытой системы характеризуется постоянством свойств во времени, которое поддерживается за счет непрерывного обмена веществом
- 11. Состояние системы определяется совокупностью ее свойств и характеризуется термодинамическими параметрами: Масса Объем Количество вещества Экстенсив- ные
- 12. Для характеристики состояния системы используют кроме термодинамических параметров, также функции состояния. Функции состояния системы – всегда
- 13. Внутренняя энергия системы U равна сумме потенциальной и кинетической энергии всех частиц этой системы U =
- 14. U + pV = H – энтальпия Энтальпия эквивалентна внутренней энергии системы при постоянном давлении (кДж/моль)
- 15. То число микросостояний, через которое реализуется данное макросостояние, называется термодинамической вероятностью (W) состояния данной системы. Людвиг
- 16. Могила Больцмана в Вене с бюстом и формулой энтропии Энтропия (S) зависит от количества энергии (Q),подводимой
- 17. Энергетическая характеристика вещества Энтальпия образования сложного вещества: 2Сгр + 3Н2(г) + 0,5 О2 (г) = С2Н5ОН
- 18. Энтальпия сгорания (ΔН °сгор ) – тепловой эффект реакции окисления кислородом 1 моль вещества до образования
- 19. Процесс – переход системы из одного состояния в другое Δ = конечное значение (параметра, функции) —
- 20. мера Работа (А) - направленных это энергетическая форм движения частиц процессе взаимодействия в системы с окружающей
- 21. I закон термодинамики рассматривает обмен энергией между системой и окружающей средой в форме работы и теплоты.
- 22. Q = ΔU + A Энергия не исчезает и не возникает из ничего, а только превращается
- 23. ΔQ = ΔU + р⋅ΔV U + pV = H – энтальпия Q = Δ Н
- 24. 24 p−const Qр = −ΔH экзотермическийпроцесс − Qр = +ΔH эндотермическийпроцесс Q = ΔU + pΔV
- 25. Энтальпия тепловой реакции, т.е. эффект реакции при р,T=const , зависит от природы и состояния исходных веществ
- 26. Следствия из закона Гесса ΔН °р-ции =Σni ΔН°обр (кон.прод) — Σni ΔН°обр (исх.в-в) ΔН °р-ции =Σni
- 27. В каком направлении должна самопроизвольно протекать химическая реакция? Самопроизвольный процесс совершается в системе без затраты энергии
- 28. Менее устойчивое состояние Е Более устойчивое состояние ум-ся Капля воды (система) состоит из большого количества молекул
- 29. Не Ne V1 = V2 p1=p2 T1 = T2 Не Nе Увеличился беспорядок
- 30. Второй закон термодинамики ΔS= Q/T > 0 Любая система, предоставленная сама себе, в среднем будет изменяться
- 31. Если в процессе степень беспорядка не изменяется (ΔS = 0), то направление процесса определяется изменением энтальпии,
- 32. Критерии самопроизвольного протекания процесса Энтальпийный фактор (ΔН) - характеризует стремление поскольку системы к процесс упорядочению, сопровождается
- 33. Дж. Гиббс (1839-1903) В качестве критерия самопроизвольности процессов целесообразно ввести новую функцию состояния, которая учитывает влияние
- 34. Второе начало термодинамики (определение Гиббса) В изотермических условиях в самопроизвольно могут осуществляться системе только такие процессы,
- 35. ΔН ΔS + - - - + + + - Возможность самопроизвольного процесса Возможен при любой
- 36. 1. Принцип энергетического сопряжения: АТФ + Н2О → АДФ + нФ (а) Глюкоза + фруктоза →
- 37. Особенности биохимических процессов: 2.Обратимость биохимических процессов, стремление к равновесию (G ⇒ min, энергетическая выгодность) G нач
- 38. Особенности биохимических процессов: 3. Многостадийность (саморегуляция) Gнач Gкон ∆G Для каждой стадии ∆G
- 39. Особенности биохимических процессов: 4. Принцип И. Пригожина: в открытой системе в стационарном состоянии прирост энтропии в
- 40. Особенности биохимических процессов Hb-Fe2+ Устойчивость живых организмов Длительная работоспособность Гомеостаз + O2 Hb-Fe2+-O2 (легкие) Hb-Fe2+-O2 Остеобласты
- 41. Химическая кинетика Кинетика – наука о механизмах, скоростях химических реакций и факторах, влияющих на скорость реакций
- 42. Гомогенные реакции а) в растворе NH4Cl(р-р) NH3(г) + HCl (р-р) б) в газовой фазе 2SO2(г) +
- 43. Простые(одностадийные) реакции Мономолекулярные А продукты I2 2I Бимолекулярные А + В NO(г) + O3(г) продукты NO2(г)
- 44. Тримолекулярные 2NO(г) + H2(г) = N2O(г) + H2O(г) Важно, чтобы столкновение произошло теми частями молекулы, которые
- 45. Сложные реакции – протекают в несколько стадий, каждая из A В С D Цикл Кребса которых
- 46. Последовательные реакции А → B → C → … Белки полипептиды пептиды аминокислоты Параллельные реакции A
- 47. Сопряженные реакции C6H12O6 + 6O2 → 6CO2 + 6H2O АДФ + Ф → АТФ Цепные реакции
- 48. Скорость химической реакции ср 2 1 с2 − с1 Δc t − t Δt υ =
- 49. Факторы, влияющие на скорость реакции Природа реагирующих веществ (молекулы, ионы, атомы, радикалы) Н2 + I2 Н+
- 50. υ = k ⋅ с( A)a ⋅ с(B)b Простые реакции 2SO2 + O2 = 2SO3 υ
- 51. Реакции классифицируют: 0 порядка 1 порядка 2 порядка Порядок реакции определяют экспериментально, он не зависит от
- 52. Уравнение Вант-Гоффа 2 1 t t2 −t1 10 Vt = V ⋅ γ γ – температурный
- 53. Эффективные соударения Еа – энергия активации, энергетический барьер
- 54. А – реагенты, В – активированный комплекс (переходное состояние), С – продукты Чем больше энергия активации
- 55. Еа Еа >100 кДж/моль ⇒ υ↓ RT − Ea k = A ⋅ e Уравнение Аррениуса
- 56. КАТАЛИЗ Положительный Отрицательный Основные принципы катализа 1. Каt ускоряет только ТД возможные реакции 2. Снижение Еа
- 57. + + Eакт Е ΔHo Координата реакции Исходные вещества Переходное состояние E’акт Продукты
- 58. Гомогенный Гетерогенный А + В → АВ А + К →АК АК + В → АВК
- 59. Ферментативный катализ 1. Белковая природа 2. Размер 10-5-10-7 Ультрамикрогетерогенный катализ 1. Высокая активность 1 порядка 0
- 60. + + E1акт Е Координата реакции Фермент Энзим (Е) фермент ES-комплекс Субстрат (S)
- 61. aA + bB cC + dD Обратимость – способность реакции протекать в двух направлениях Химическое равновесие
- 62. Условия химического равновесия: G min ΔG = 0 →υ = υ← Химическое равновесие Концентрации веществ в
- 63. Химическое равновесие υ → = υ ← k →[A]a [B]b = k←[С]с [D]d Так как ⇒
- 64. p(С)c p(D)d Kравн. = p( A)a p(B)b [С]c [D]d Kравн. = [ A]a [B]b Способы выражения
- 65. Характеристики константы равновесия Не зависит от концентрации веществ Не зависит от давления Не зависит от катализатора
- 66. Смещение химического равновесия Принцип Ле-Шателье Если на равновесную систему производится внешнее воздействие, то равновесие смещается в
- 67. Принцип адаптивных перестроек Любая живая система при воздействии на нее внешних факторов перестраивается так, чтобы уменьшить
- 68. Растворы. Реакции, протекающие в растворах 1. Кислотно-основные (протолитические) ОВР (редокс-процессы) Гетерогенные Лигандообменные
- 69. Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами
- 70. Растворы Вода орга- низма Истинные растворы – гомогенные системы, в которых структурной единицей растворенного вещества являются
- 71. Основные функции воды в организме процессов всасывания и передвижения питательных Обеспечение механического веществ Поддержание оптимального осмотического
- 72. Коллигативные свойства растворов Это свойства, НЕ зависящие от природы частиц растворенного вещества, а зависящие от концентрации
- 73. Коллигативные (взаимосвязанные) свойства растворов Понижение давления насыщенного пара растворителя над раствором нелетучего вещества - молекулы растворенного
- 74. I Закон Рауля Относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества
- 75. Температура кипения и кристаллизации ПАР Твердое состояние Жидкое состояние Температура кипения жидкости – это температура, при
- 76. Температура кипения и замерзания 2 закон Рауля Температура кристаллизации (замерзания) жидкости – это температура, при которой
- 77. ΔTзам = KкрCm Депрессия температуры замерзания раствора неэлектролита пропорциональна его моляльной концентрации ΔTкип = ЕCm Повышение
- 78. Осмос ППМ Осмос – самопроизвольное проникновение молекул растворителя через ППМ в раствор или из разбавленного раствора
- 81. Расчет осмотического давления Pосм = сRT Условие существования человека и высших животных : ИЗООСМИЯ Росм жидкостей
- 82. Типы растворов, используемых в медицине При контакте с кровью наблюдается плазмолиз – сжатие эритроцитов При контакте
- 83. Значение осмотического давления Слабительное действие глауберовой соли Na2SO4·10H2O и горькой соли MgSO4·7H2O. Плохая всасываемость стенками желудка
- 85. 4. При очистке ран от гноя и носителей инфекции используют гипертонические марлевые повязки, пропитанные 10%-ным раствором
- 86. Осмос и диализ - основа ряда физиологических процессов: усвоение пищи, окислительные процессы, распределение питательных веществ, жидкостной
- 87. 8. Путем осмоса осуществляется транспорт воды через эпителий кишечника, через эпителий почечных канальцев в процессе концентрации
- 88. Растворы электролитов (сильные и слабые) Pосм= iсRT i – изотонический коэффициент α = cдисс ⋅100% c0
- 89. Слабые электролиты СН3СООН СН3СОО– + Н+ Kдис (константа равновесия) зависит от Природы вещества Природы растворителя Температуры
- 90. Слабые электролиты Kдисс= 10-2-10-4 Kдисс= 10-5-10-9 умеренно слабые слабые очень слабые Kдисс= 10-10 и рKa(HA) =
- 91. Kдис С0 α = Закон разведения Оствальда С увеличением концентрации слабого электролита степень его диссоциации уменьшается
- 92. Сильные электролиты Дебай и Хюккель Диссоциация полная Гидратация ионов Межионные взаимодействия Cl– Na+ Cl– Na+ Cl–
- 93. a = C0γ Кэффициент активности γ (f ) − коэффициент активности γ± = γ+ ⋅ γ−
- 94. Ионная сила раствора 2 n i i 1 C ⋅ z ∑ 2 i=1 I =
- 95. Уравнение Дебая-Хюккеля
- 96. Электролиты биосред Клетка концентрированнее плазмы Обязательно присутствие катионов Na, K, Mg, Ca Ca > Mg Mg
- 97. K Ca Na Mg Ca Mg белок HCO3- SO42- HCO3- белок Na Cl 142 103 K
- 98. Теория кислот и оснований Бренстеда-Лоури Основание – молекула или ион, способные присоединить протон : CN– +
- 99. АМФОЛИТЫ Амфолиты – молекулы или ионы, способные как отдавать, так и присоединять протоны: Н2О + HCl
- 100. Устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар: Кислотно-основное (протолитическое) равновесие СН3СООН/СН3СОО¯
- 101. Типы протолитических реакций Реакции ионизации СН3СООН + Н2О СН3СОО– + Н3О+ к-та –1 + осн.-2 осн.-1
- 102. Ионное произведение воды 2 2 −16 = 1.8 ⋅10 [H O] [H+ ][OH− ] K =
- 103. Водородный показатель Сѐрен Сѐренсен (09.01.1868-2.02.1939) Датский биохимик, основатель современной рН-метрии рН = – lg[H+]
- 104. Водородный показатель Данная процедура не несет никакого дополнительного химического смысла. Она лишь упрощает восприятие цифр, характеризующих
- 105. рН можно определить: Колориметрическим методом с помощью индикаторов Потенциометрическим методом рН биологических жидкостей: рН плазмы крови
- 106. Протолитический балланс Буферные системы Белки, жиры, углеводы всасывание, метаболизм переваривание, СО2, Н2О , конечные продукты обмена
- 107. Протолитический балланс рН = const Почки а) Ацидогенез : СО2+Н2О⇔Н2СО3 ⇔Н+ + НСО3– моча плазма б)
- 108. 108 Добавим 1 каплю (0,05 мл) 1М НСl к 1л воды (безбуферный раствор, рН=7) и рассчитаем
- 109. Протолитический балланс Буферные системы Буферная система – протолитическая (кислотно-основная) система, способная поддерживать постоянство рН при разбавлении
- 110. [CH3COOH] Ka = 3 [H + ]⋅[CH COO− ] Буферные системы Основные буферные системы: Слабое основание
- 111. Уравнение буферных систем (Гендерсона-Хассельбаха) + a [H ] = K · [сопряж.кислота] a lg [сопряж.основание] рН
- 112. Буферные системы Механизм действия CH3COOH ⇔ CH3COO– + H+ CH3COONa ⇒CH3COO– + Na+ CH3COOH + ОН–
- 113. Буферная емкость 3 [CH COOH] K a = [H ]⋅[CH3COO ] Буферная е+ мко−сть зависит :
- 114. Буферные системы организма Гидрокарбонатная буферная система СО2+Н2О ⇔ Н2СО3 ⇔ Н+ + НСО3– Открытая система быстрого
- 115. Гидрокарбонатный буфер – главный буфер плазмы крови (55% от буферной емкости крови) Н+ + НСО3– ОН–
- 116. Фосфатный буфер HPO 2- + H+ = H PO – 4 2 4 H2PO4–/НРО42– H2PO4 +
- 117. Белковый буфер Изоэлектрическая точка (pI) – значение рН, при котором суммарный─ заряд макромо- лекулы равен нулю
- 118. Белковый буфер Анионный буфер , рН > pI белка НPt ⇔ H+ + Pt– NH3+ —Pt
- 119. Гемоглобиновый буфер рKа 6,1 6,95 Н2СО3 HHbO2 8,2 HHb Сила кислоты уменьшается НСО3– HbO2– Hb– HHb
- 120. На сродство гемоглобина к кислороду явление носит название При подкислении среды влияет рН. Это эффекта Бора.
- 121. 121 Гемоглобиновая буферная система: ~ 35 % общего буферного действия крови Гемоглобиновая H-Hb K-Hb венозная кровь
- 122. В легочных концентрации капиллярах углекислого за счет относительно газа в альвеолярном низкой воздухе: происходит эффективная диффузия
- 123. 123 pK = 8,2 pK = 6,95 − + HHb ↔ H+ + Hb− HHbO2 ↔
- 124. В тканях диффундирующий в кровь из клеток СО2 большей частью (около 90%) попадает в эритроциты, что
- 125. 125 HbO− ↔ Hb− + O 2 2 СО2 + Н2О → Н2СО3 H − Hb
- 126. СО2→→СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО-3 Гемоглобиновая буферная система эффективно функционирует только в
- 127. КРОВЬ ПОЧКИ Кислые фосфаты - 80% - 15% НСО3– (Hb·СО2)– (СО2·Н2О) - 5% ЛЕГКИЕ СО2 атмосфера
- 128. Кислотно-щелочное равновесие Ацидоз – уменьшение кислотной буферной емкости крови Алкалоз - увеличение кислотной буферной емкости крови
- 129. Кислотно-щелочное равновесие Ацидоз Газовый (гиповентиляция Легких) Негазовый Метаболический (диабет) Экзогенный Выделительный Почечный Потеря кишечного сока (диарея)
- 130. Кислотно-щелочное равновесие АЛКАЛОЗ Газовый (гипервентиляция легких) Негазовый Метаболи- ческий Экзогенный Выделительный Почечный Потеря желудочного сока
- 131. Кислотно-щелочное равновесие рН = 7,35 – 7,45 6,8 - 7,8 рСО2 = 40 5 мм рт
- 132. Гетерогенные процессы и равновесия Насыщенный Раствор Vраст = V крист Вещество + растворитель раствор Ненасыщенный Раствор
- 133. Гетерогенные процессы и равновесия BaSO4 Осадок (тв) раствор (ионы) Kравн·[BaSO4]=Ks(ПР)= [Ba2+]·[SO4 ]= 2- 1,1·10-10 Раствор Ba2+
- 134. Константа расторимости, Ks (ПР) Са3(РО4)2 Кs – произведение равновесных концентраций ионов малорастворимого электролита в его насыщенном
- 135. Кs зависит от: Природы малорастворимого эл-та Природы растворителя Температуры
- 136. Использование произведения растворимости (ПР или Ks) Для сравнения растворимости веществ (s) Чем меньше ПР, тем хуже
- 137. 3. Для установления последовательности выпадения осадка ( чем меньше Ks, тем раньше выпадает осадок!!!) Ks (AgCl)
- 138. Cмещение гетерогенного равновесия Образование осадка Пс > Ks Растворение осадка Пс Последовательность осаждения ионов Ag+(р-р)+ Cl–(р-р)
- 139. При добавлении к насыщенному раствору малорастворимого электролита раствора сильного электролита, не имеющего с ним общих ионов,
- 140. S = √Ks Кs и s Бинарный электролит: AgCl (тв) Ag+(р-р) + Cl–(р-р) Ks = [Ag+]·[Cl–]
- 141. Ks 84375 Ks = 9 + 3РО43–(р-р) + ОН–(р-р) n + m Ks(Ktn Anm ) nn
- 142. n + m Ks(Ktn Anm ) nn ⋅ mm 9 Ks 84375 Ks = Гетерогенные равновесия
- 143. n + m Ks(Ktn Anm ) nn ⋅ mm Ks 84375 Ks = 9 Гетерогенные равновесия
- 144. Ag+ + Cl- (р-р) (р-р) AgCl(тв) Ag+(р-р)+ 2NH3 [Ag(NH3)2]+ Mg(OH)2 (тв) Mg2+ + 2OH- (р-р (р-р)
- 146. Образование костной ткани ПЛАЗМА Н2СО3 НСО3 Н2РО4 НРО4 Са лактаты белки - - 2- 2+ с(Са2+)
- 147. Органическая матрица Коллаген хондроитинсульфаты Образование костной ткани Остеобласты рН = 8,3 Са2+ + НРО42- ⇒ СаНРО4
- 148. Органическая матрица Коллаген хондроитинсульфаты Кристаллизация Са2+ + фосфаты Образование костной ткани 5Са2+ + 3 НРО42- +4ОН–
- 149. Деминерализация костной ткани (эмали зуба) Остеокласты Са5(РО4)3ОН + 2Н+ Са4Н(РО4)3 + Са2+ + Н2О Са5(РО4)3ОН +
- 150. В полости рта в результате жизнедеятельности микробов достаточно сильные кислоты: пировиноградная, образуются молочная, янтарная, которые разрушают
- 151. гидроксид-аниона на фторид-анион значительно Замена повышает твердость и устойчивость зубной эмали к растворению. Ks(Ca PO F)
- 152. Образование защитного эмалевого слоя Лечение кариеса фторидами
- 153. Бериллиевый вытеснение ионов рахит (бериллиоз) - Са2+ Ве2+ ионами из костей и их размягчение вследствие меньшего
- 154. Са3(РО4)2 Ураты-Са СаС2О4 · Н2О NH4MgPO4 СаС2О4 · 2Н2О Ca10(PO4)6CO3·H2O ☝ Моча рН Моча рН >
- 155. Детоксикация при отравлениях: Отравление ионами тяжелых металлов (Pb2+, Hg2+, Cd2+) приводит к блокаде –SH-групп белковых фрагментов.
- 156. BaSO4 (рентгенография) BaCl2 BaCO3 ☝☠ Применение в медицине Количественный анализ (реакции осаждения) Определение хлоридов в моче,
- 157. Редокс-процессы
- 158. РОЛЬ ОВР 1. ОВР лежат в основе метаболизма любых организмов. Аэробный метаболизм: окислитель – О2 (дыхание)
- 159. оксигеназный путь (включение в субстрат одного атома кислорода - монооксигеназный путь, двух атомов кислорода - диоксигеназный
- 160. Тиосульфат натрия Na2S2O3 – универсальный антидот!!! а) При отравлении тяжелыми металлами образуются трудно растворимые и поэтому
- 161. в) При отравлении галогенами и другими сильными окислителями антитоксическое действие Na2S2O3 обусловлено его умеренными восстановительными свойствами:
- 162. 3. Назначение лекарственных препаратов. Прогноз совместимости лекарственных препаратов (иодид калия и нитрит натрия, перманганат калия и
- 163. В неорганической химии ОВР формально рассматриваются как перемещение электронов от атома одного реагента (восстановителя) к атому
- 164. В органической химии окисление рассматривают как процесс, при котором в результате перехода электронов от органического соединения
- 165. Окисление, восстановление Окисление можно определить как: потеря электронов веществом; удаление водорода из какого-либо вещества; присоединение кислорода
- 166. Направление ОВР В основе определения направления самопроизвольного протекания ОВР лежит правило: Самопроизвольно ОВР протекают всегда в
- 167. Редокс-потенциал Окислительно-восстановительный потенциал (ОВП, ϕr) – количественная мера окислительно-восстановительной способности. Величина ϕr зависит от: а) природы
- 168. ОВ (редокс)-электроды ОВ (редокс)-потенциалы Pt | Ох, Red Ох + nē Red υ (ок-я) . +
- 169. 9 16 Возникновение окислительно-восстановительного потенциала. ( зачем нужен платиновый электрод?! ) Поскольку ионы Fe2+ Fe3+ и
- 170. Окислительно-восстановительные электроды Pt ⏐ Fe+3, Fe+2 ϕ0(Fe+3, Fe+2 ) Pt Пример: Fe+3(ox) и Fe+2(red) Fe+3 Fe+2
- 171. Стандартный водородный электрод Н2(газ) 2Н (адсорбированный платиной) 2Н+(р-р) + 2ē ϕо(2Н+/Н2) = 0 р(Н2)= 1 атм
- 172. Схема гальванического элемента, состоящего из водородного электрода и электрода MnO4-/ Mn2+
- 173. ϕ(Ох/Red) = ϕo (Ox/Red) + RT ln а(Ox) zF a(Re d) Уравнение Нернста - Петерса: ОВ
- 174. Направление ОВР Сравнивая потенциалы ОВ пар, участвующих в ОВР, можно заранее определить направление, в котором будет
- 175. Направление ОВР I2 + 2e = 2I– ϕ1 = 0,54 В (первая ОВ пара) окисленная форма
- 176. Задача: Действием какого галогена (Cl2 или I2) можно окислить Fe+2 до Fe+3? Fe+2 + Hal2 ⮀
- 177. Биохимические ОВР 1.Все биохимические ОВР – каталитические Ферменты – оксидоредуктазы. Оксидоредуктазы – сложные белки: Белок +
- 178. рН ↓ → ϕ↑ Биохимические ОВР 3. В биохимии используют нормальный восстановительный потенциал ϕ°′, рН =
- 179. 4. Ступенчатость биохимических ОВР
- 180. Система ϕ’, В НАД+/НАДH 2 Полуреакция НАД+ + H+ + 2e ⮀ НАДH ФАД/ФАДH 2 КoQ/КoQН
- 181. St-H2 НАД НАД(Н)+Н ФАД ФАД-Н2 Убихинон 2Н 2р 2ē О 2 2ē Н2О 2ē 2ē цитохромы
- 182. Биохимические ОВР 5. Экзэргоничность Реакции биологического окисления – источники энергии для различных процессов жизнедеятельности Принцип сопряжения
- 183. Классификация биохимических ОВР Реакции внутримолекулярной окисли- тельно-восстановительной дисмутации за счет атомов углерода, например: −1 −1 окислитель
- 184. Реакции межмолекулярные Реакции дегидрогеназного окисления- восстановления, например: СН3−С = О +Н2О Н СН3 − С −О
- 185. Реакции межмолекулярные Реакции оксигеназного окисления-восстановления: Монооксигеназное и диоксигеназное Оксигеназы (гидроксилазы) катализируют реакции окисления путем включения атома
- 186. Свободнорадикальное окисление-восстановление Главный источник радикалов в организме - молекулярный кислород, а в случае радиационного воздействия –
- 187. О2 Увеличивается способность окислять Скорость свободнорадикального окисления определяется концентрацией радикалов практически не регулируется организмом
- 188. Радиация → радиолиз Н2О (небольшая энергия) → Н∙ + НО∙ ; 2 Н∙+ О → НО∙
- 190. При излишнем накоплении в организме окислителей, например за счет свободнорадикального окисления, их действие, прежде всего, направляется
- 191. В организме свободнорадикальное окисление сдерживается многокомпонентной антиоксидантной буферной системой, которая превращает радикалы в малоактивные соединения. Эти
- 192. Антиоксидантная система Антиоксиданты - соединения, способные уменьшать интенсивность свободнорадикального окисления, нейтрализовать свободные радикалы за счет обмена
- 193. Антиоксидантная система Антиоксидантные ферменты (супероксиддисмутаза (СОД), церулоплазмин, каталаза, глутатион-зависимые ферменты) обеспечивают комплексную антирадикальную защиту биополимеров. Низкомолекулярные
- 194. Антиоксидантная система Первая линия защиты - ферменты антиоксидантной системы, ингибирующие инициацию перекисного окисления липидов и предотвращающие
- 195. Антиоксидантная система
- 196. Комплексные соединения - устойчивые химические соединения сложного состава, в которых имеется хотя бы одна связь, образованная
- 198. Ковалентная связь H. + .H → H:H Обменный механизм + →
- 199. Ион аммония H.. [ H : N.. : H ] + H донор H.. H :
- 200. Теория кислот и оснований Льюиса Кислоты – вещества, имеющие атом со свободной валентной орбиталью. Основания –
- 201. III K3[ Fe (CN)6 ] комплексообразователь лиганд внутренняя сфера число лигандов заряд комплексо- образователя внешняя сфера
- 202. Лиганды – основания по Льюису. 10Al+3 = 1s22s22p63s03p0 Комплексообразование по теории Льюиса Комплексообразователи – кислоты по
- 203. Комплексообразователи - катионы всех s-, d- и f- металлов, иногда - p-элементов (Al3+, Sn2+...) Общее требование
- 204. Лиганды: анионы - F-, Cl-, Br-, I-, CN-, CNS-, NO2-, OH-... нейтральные молекулы – H2O, NH3,
- 205. Лиганды монодентатные: анионы - F-, Cl-, Br-, I-, CN-, CNS-, NO2-, OH- нейтральные молекулы – H2O,
- 206. Би- и Полидентатные – хелаты (от греческого «клешня краба») Анион порфирина- 4-дентатный лиганд Анион ЭДTA -
- 207. H2N.. N..H2 .. NH2 .. H2N Cu++ Cu .. NH2 .. H2N H2N.. N..H2 ++ этилендиами
- 208. Классификация комплексных соединений 1. По заряду внутренней сферы: катионного типа: анионного типа: нейтрального типа: [Ag(NH3)2]Cl, [Cu(NH3)4]SO4
- 209. Классификация комплексных соединений Многоядерные комплексы
- 210. Классификация комплексных соединений Аквакомплексы- лиганд - вода Амминокомплексы – лиганд аммиак Гидроксокомплексы – лиганд –ОН- Ацидокомплексы
- 211. R3 R4 N N N Me N R1 R2 R5 R7 R6 R8 Y Х Макроциклические
- 212. Макроциклические мембраноактивные комплексы Ионофоры – органические полидентатные лиганды, которые обладают избирательной способностью взаимодействовать с теми или
- 213. Краун-эфиры (СН2СН2О)n - избирательно взаимодействуют со щелочными металлами + H O H Li O H H
- 214. Координационного число (к.ч.) - число связей комплексообразователя и лиганда К.ч. = числу лигандов, если лиганд монодентатный,
- 215. Связь координационного числа с зарядом комплексообразователя
- 216. sp-гибридизация y x z s x px y z + 180o Гибридизация
- 217. d 4 5 sp-гибридизация [AgCN2] - Строение комплексного иона Ag0 …4d105s1 Ag+ …4d105s0 - CN Ag
- 218. y x z s x px sp3-гибридизация y z x PY z y p x z
- 219. d Ni2+ = …3d84s0 3 4 sp3-гибридизация [NiCl4]2- парамагнитный тетраэдрический комплекс Строение комплексного иона
- 220. [NiCl4]2-
- 221. + sp2d-гибридизация квадрат NiX4 2-
- 222. Ni2+ = …3d84s0 d 3 4 .. sp2d-гибридизация [Ni(CN)4]2- Диамагнитный квадратный комплекс
- 223. [Ni(CN)4]2-
- 224. Транс-[Pt(NH3)2Cl2] Цис-[Pt(NH3)2Cl2] Цис-изомер дихлордиамминплатины (II) обладает противоопухолевой активностью и применяется в качестве лекарственного средства при онкологических
- 225. + sp3d2-гибридизация Тетрагональная бипирамида
- 226. Fe2+ = …3d64s0 d 3 4 .. .. .. Внешняя sp3d2-гибридизация [Fe(H2O)6]2+ Пара- магнитный октаэдр ..
- 227. [Fe(H2O)6]2+ октаэдр
- 228. Fe2+ = …3d64s0 d 3 4 Внутренняя sp3d2-гибридизация [Fe(CN)6]4- Диамагнитный октаэдр .. ..
- 229. квадрат тетраэдр октаэдр Основные конфигурации комплексов
- 230. Изолированные [Cu(NH3)4]SO4 Равновесия в растворах комплексных соединений [Сu(NH3)4]2+ + SO42- Первичная диссоциация [Сu(NH3)4]2+ Сu2+ + 4NH3
- 231. Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за лиганд [Сu(NH3)4]2+ Kн=1,07•10-12 Лиганд - NH3 Комплексообразователи
- 232. Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за комплексообразователь [Сu(NH3)4]2+ Kн=1,07•10-12 Лиганды - NH3, CN-
- 233. Совмещенные, конкурирующие процессы разных типов AgCl + NH3 [Ag(NH3)2]Cl р-р AgClтв Ag+ + Cl- р-р Гетерогенный
- 234. Биокомплексообразователи Fe(II) в составе миоглобина, гемоглобина, ферментов Fe(III) в составе цитохромов Co(III) в витамине В12 Cu(I),
- 235. Биолиганды Кислород Оксид углерода(II) Азот Аминокислоты Пептиды Нуклеотиды Углеводы Лекарства Метаболиты
- 236. Гемоглобин
- 237. Гемоглобин
- 238. Гемоглобин Fe2+ Гем + О2 = ННBO2 + CО2 = ННBCO2 Белок- Fe2+ Гем С О
- 239. Гемоглобин Fe2+ + окисли тели Метгемоглоб ин Fe3+ = Белок- Гем NO - + 2H+ +
- 241. Цитохромоксидаза Fe3+ + Белок Прекращается клеточное дыхание, кислород не усваивается, артериальная кровь переходит в вены -
- 242. Металлолигандный гомеостаз, его нарушение Металлы –токсиканты R-SH + Hg2+ R-S- Hg2+- S – R + 2H+
- 243. 2 CH COOH NaOOCCH2 CH2COONa HOOCCH 2 N.. CH2CH2N.. + трилон Б Ca++ + 2H+ Динатриевая
- 244. Аминокислоты - комплексоны Хелатный эффект 3 6 [Ni(NH ) ]2+ Кнест. ≈ 10-8 2+ NH2 NH2
- 245. Принципы хелатотерапии Металл- токсикант должен связываться с вводимым препаратом более прочно, чем с биолигандом в организме
- 246. Хелатотерапия препятствует отложению холестерина понижает кровяное давление позволяет избежать ангиопластики удаляет кальций из холестериновых бляшек растворяет
- 247. Поверхностные явления Дисперсные системы Растворы ВМС Модуль «Основы коллодной химии» Коллоидная химия [kolla (греч.) – клей]
- 248. Поверхностная энергия А - молекула в объеме Б - молекула на поверхности Любая поверхность имеет избыточную
- 249. Расчет и определение СПЭ площадь (м2) s → min, σ = const Образование сферических капель Укрупнение
- 250. СПЭ в биологии и медицине Полная альвеолярная поверхность легких при вдохе равна 70—80 м2, что примерно
- 251. К с.р. >> 1 Классификация Сорбент + сорбат Сорбция Адсорбция Абсорбция Неподвижная пов-ть: г/тв, ж/тв Подвижная
- 252. Адсорбция Физическая: межмолекулярные взаимод-я за счет сил Ван-дер-Ваальса; Е 4 - 40 кДж/моль Обратимость, неспецифичность, экзотермичность
- 253. Адсорбция – поглощение газов, паров или жидкостей поверхностным слоем твердого тела.
- 254. ПАВ на границе вода-воздух σ ×103 н/м вода 72,5 масляная кислота 26,5 СH3CH2CH2COOH Гидрофобный хвост Гидрофильная
- 255. Гемосорбция, лимфосорбция, плазмосорбция – удаление ядовитых веществ из кровяного русла
- 256. ХРОМАТОГРАФИЯ Физико-химический метод разделения и анализа смесей газов, паров, жидкостей или растворенных веществ сорбционными методами в
- 257. Дисперсные системы – это такие гетерогенные системы, которые состоят по крайней мере из двух фаз, одна
- 258. Дисперсная фаза (д.ф.) – мелкораздробленные частицы равномерно распределенные в дисперсионной среде Дисперсионная среда (д.ср.) – однородная
- 259. Классификация по агрегатному состоянию
- 260. Примеры дисперсных систем
- 261. По характеру взаимодействия д.ф. и д.ср.
- 262. Золи термодинамически неустойчивы; самопроизвольно не образуются. термодинамически устойчивы; образуются самопроизвольно. Гидрофобные ΔG>0 [ΔS>0, ΔH>0] Гидрофильные ΔG
- 263. По характеру взаимодействия частиц д.ф.
- 264. Лиофобные коллоидные растворы (ЗОЛИ) Условия образования: Малая растворимость д.ф. в д.среде (низкое сродство фазы и среды);
- 265. Методы получения золей 10-9 r > 10-7м r Диспергирование Конденсация Методы диспергирования Механическое дробление (ступка, шаровая
- 266. Методы конденсации Физическая конденсация (замена растворителя; Химическая конденсация – любая реакция, приводящая к образованию осадка. Окислительно-восстановительные
- 267. Методы конденсации AgNO3 + Red → Ag + Ox Золь серебра (и оксида серебра) применяют как
- 268. Диализ
- 269. АИП (Дж. Абель,1913 г. –аппарат для диализа, основа конструкции, В. Колф, 1944 – первая на практике
- 270. Современный АИП
- 271. Строение коллоидной частицы Мицелла – частица дисперсной фазы золя вместе с окружающей ее сольватной оболочкой из
- 272. Строение коллоидной частицы AgNO3 + KI → AgI + KNO3 mAgI I- I- I- I- I-
- 273. Строение коллоидной частицы Межфазный потенциал (ϕмф) – потенциал ДЭС на границе тв/ж (межфазная граница) Значение ϕмф
- 274. Строение коллоидной частицы Формульная запись: [ m AgI n I- (n-x) K+]-x x K+ Na2SiO3 +
- 275. Свойства золей 1. Молекулярно-кинетические а) броуновское движение б) диффузия в) осмос Росм (р-р сахарозы, w =1%)
- 276. Окраска золей (абсорбция света) полихромия Рассеяние света Точечный источник света Эффект Тиндаля Боковое освещение Голубая опалесценция
- 277. 1 – раствор NaCl; 2 – раствор золя; 3 – источник света; 4 – оптическая линза
- 278. Эффект Тиндаля
- 279. Устойчивость дисперсных систем, золей Седиментационная устойчивость – способность частиц д.ф. находиться во взвешенном состоянии и не
- 280. Агрегативная устойчивость Коллоидна я частица Коллоидна я частица 10-9- 10-6м Расклинивающее давление: Электростатическое отталкивание одноименно заряженных
- 281. Агрегация и слипание частиц дисперсной фазы называется коагуляцией. Коагуляция гидрофобных коллоидов ξ-потенциал гранул уменьшается От 70
- 282. Коагуляция Происходит самопроизвольно или под воздействием внешних факторов (изменение температуры, увеличение концентрации, действие ультразвука, электромагнитного поля,
- 283. Минимальное количество электролита (ммоль), вызывающее видимую коагуляцию литра золя, называется порогом коагуляции (Спк, ммоль/л) Электролитная коагуляция
- 284. Коагуляцию вызывает ион, заряд которого противоположен заряду гранулы Чем выше заряд коагулирующего иона, тем меньше его
- 285. Кинетика коагуляции Сэл А В D E F Скрытая Явная медленная Явная быстрая Порог коагуляции (ξ
- 286. Механизм коагуляции I. Нейтрализационная коагуляция mAgI ⋅ nAg+ ⋅ (n-x)NO3 ⋅ xNO3 - x+ - S2-
- 287. Механизм коагуляции 2. Концентрационная коагуляция mAgI ⋅ nAg+ ⋅ (n-x)NO3- x+ ⋅ xNO3 - + (противоионы)
- 288. Коагуляция смесями электролитов Аддитивность – суммирование коагулирующего действия ионов- коагулянтов. Ионы-коагулянты не взаимодействуют между собой. Антагонизм
- 289. Коагуляция смесями электролитов Синергизм – усиление коагулирующего действия одного электролита в присутствии другого. Ионы-коагулянты взаимодействуют между
- 290. Пептизация Пептизация – процесс обратный коагуляции – превращение осадка, образовавшегося при коагуляции, в коллоидный раствор Промывание
- 291. Условия пептизации: 1. Свежеобразованные осадки 2. Небольшое количество электролита- пептизатора 3. Перемешивание, нагревание
- 292. Применение антикоагулянтов в медицине Лечение тромбозов, тромбофлебитов Понижение свертываемости крови во время операции (гепарин, кумарин, цитрат
- 293. Условия: хорошая растворимость ВМС в д.с., адсорбируемость ВМС, достаточная концентрация ВМС Стабилизация золей Коллоидная защита –
- 294. Флокуляция Флокуляция – объединение частиц дисперсной фазы под действием небольших количеств ВМС Полимерные цепи ВМС Флокулы
- 295. σ, н/м lgC, моль/л ККМ (коллоидные ПАВ) Лиофильные коллоиды Критическая концентрация мицеллообразования (ККМ) – концентрация раствора
- 296. ККМ: 10-4 – 10-5 М неионогенные ПАВ 10-2 – 10-3 М ионогенные ПАВ 10 -8 –
- 297. ККМ (323К) : стеарата кальция - 5×10-4 М, эфиров сахарозы - 1×10-5 М
- 298. Формы агрегации лиофильных коллоидов
- 299. Липосомы – искусственные мембраны Липосомы – замкнутые липидные бислойные структуры, имеющие водное содержимое.
- 300. Липосомы – замкнутые пузырьки воды, окруженные двумя или несколькими слоями фосфолипидов Способы включения различных веществ в
- 301. Использование липосом Модельные системы (включение белков и др.). Средства доставки БАС (ДНК, олигонуклеотиды, белки, пептиды, антибиотики,
- 302. Липосомы - средства доставки БАС Липосомы как средства микрокапсулирования БАС должны удовлетворять следующим требованиям: биологическая совместимость
- 303. Липосомы - средства доставки БАС Липосомы как средства микрокапсулирования БАС должны удовлетворять следующим требованиям: способность эффективно
- 304. ИТАК: Липосомы – 1) модели для изучения мембран 2)носители лекарств Сродство к природным мембранам. Не вызывают
- 305. Получение – самопроизвольно при ККМ Лиофильные коллоиды Свойства: Устойчивость, мощная сольватная оболочка, динамичность МКС и оптические
- 306. Потеря устойчивости Высаливание – потеря устойчивости, разрушение лиофильных коллоидных растворов, за счет десольватации. При этом ПАВ
- 307. Солюбилизация – процесс растворения в растворах коллоидных ПАВ тех веществ, которые в данной жидкости практически нерастворимы.
- 308. Электрокинетические явления Прямые Обратные Электроосмос Потенциал седиментации Электрофорез Потенциал течения Причина – ДЭС на границе ф/ср
- 309. Электрофорез – движение частиц дисперсной фазы под действием внешнего электрического поля. Электрокинетические явления Медицинское применение Лекарственный
- 310. Электрофорез белков плазмы
- 311. ЭЛЕКТРОФОРЕЗ
- 312. Электроосмос Электроосмос – направленное движение дисперсионной среды в капиллярной системе под действием электрического тока. Стенки капилляров
- 313. Электроосмос 1 – дисперсная фаза; 2 - перегородка
- 314. Электрокинетические явления - - + Глина Н2О Н2О Ф. Pейсс (1807) [mSiO2nSiO32- 2(n-x)Na+]2x- 2xNa+ гранула линия
- 315. Потенциалы седиментации и течения Потенциал оседания (эффект ДОРНА) - возникновение разности потенциалов при движении частиц в
- 316. Растворы ВМС Имплантанты (для коленных, плечевых, тазобедренных суставов) Природные ВМС – белки, полисахариды, нуклеиновые кислоты, каучук
- 317. Белки Белки выполняют в клетке ряд важнейших функций: 1. Структурная 3. Защитная 5. Сократительная 2. Каталитическая
- 318. В формировании вторичной структуры принимают участие гидрофобные взаимодействия, ионные взаимодействия, водородные связи и ковалентные связи.
- 319. Третичная, четвертичная структура белка
- 320. Структуры белков
- 321. Белки глобулярные, фибриллярные
- 323. Свойства белков Кислотно-основные Окислительно-восстановительные Комплексообразующие Поверхностно-активные Поверхностноактивные: ПАВ, эмульгаторы жиров, стабилизаторы лиофобных систем, образуют мицеллы с
- 324. Комплексообразующие свойства: Белки – активные лиганды, образуют комплексы с биометаллами и металлами-токсикантами ОВ- свойства: Мягкое окисление
- 325. Кислотно-основные свойства 1. КО-свойства зависят от состава белков: R -COOH R - COOH R – СООН
- 326. R-COOH OH- NH 2 0 рН = рI 0 + H2O R-COO- NН3+ 0 +3HN- R-
- 327. 3 + HN-R-COO▬ OH- 3 NH + 0 рН = рI 0 + OH▬ 2HN- R-COO─
- 328. H+ H2O ─ООС-R-COO─ NН3+ OH- ─ООС- R- COO─ NH3+ ─ООС- R- COOН 3 NH + 0
- 329. Изоэлектрические точки различных белков Белок Казеин Желатин Альбумин яйца Гемоглобин Глобулин ИЭТ 4,6 4,7 4,8 6,8
- 330. Набухание и растворение ВМС Вода Вода ВМС ВМС Раствор ВМС Набухание Набухание – самопроизвольный процесс поглощения
- 331. НАБУХАНИЕ ΔG = ΔH ─ TΔS 1. Сольватация полимера ΔН |TΔS| 2. Разрыхление структуры ВМС, V
- 332. Набухание m − m α = 0 m0 α = V − Vo Vo студень Ƭ
- 333. Факторы, влияющие на НАБУХАНИЕ 1. Природа полимера, его лиофильность Природа растворителя «Подобное в подобном» Электролиты SO42─
- 334. Факторы, влияющие на НАБУХАНИЕ 4. рН среды рН pI Набухание Минимально Набухание увеличивается Набухание увеличивается ▬
- 335. Факторы, влияющие на НАБУХАНИЕ 5. Возраст биополимера Способность к набуханию уменьшается 6. Температура t° набухание
- 336. Биологическая роль набухания 1. Пищеварение Сокращение мышц Образование опухоли Давление набухания (непроваренные бобовые) Кулинарная обработка пищи
- 337. Вязкость За счет сил взаимодействия между молекулами реальной жидкости при ее течении возникают силы трения, которые
- 338. Вязкость где S - площадь соприкосновения движущихся слоев жидкости, dv/dx - градиент скорости. Коэффициент η, зависящий
- 339. КРОВЬ – неньютоновская жидкость Вязкость воды при температуре 20°С составляет 1мПа.c, а вязкость крови в норме
- 340. Вязкость Движение крови в организме, в основном, ламинарно. Турбулентности могут возникать в полостях сердца, в крупных
- 341. Вязкость растворов ВМС (аномальная) Вязкость растворов ВМС всегда выше вязкости растворов НМС Цепи макромолекул прошивают слои
- 342. Вязкость На вязкость крови в живом организме влияют: Температура – зависимость сложная Гематокрит - Vэр/Vпл =
- 343. Осмотическое давление ВМС – макромолекулы, гибкие цепи, конформационные изменения Кинетический элемент – сегмент макромолекулы Уравнение Галлера
- 344. Онкотическое давление 2,5 - 4,0 кПа Артериальный конец капилляра Венозный конец капилляра Ргидр= 35 мм.рт.ст >
- 345. Онкотическое давление создается за счет белков плазмы крови 0,5% суммарного осмотического давления (2,5 - 4,0 кПа)
- 346. Мембранное равновесие Доннана Равновесие, устанавливающееся в системе растворов, разделенных полупроницаемой мембраной при условии равенства произведения концентраций
- 347. Мембранное равновесие Доннана Клетка Наружный р-р ─ ─ ─ + + + + + + ─
- 348. Уравнение Доннана c 2 (нар) i i i с (нар) + 2с (внутр) x = i
- 349. Нарушение устойчивости растворов ВМС Высаливание Денатурация Коацервация Денатурация – разрушение природной конформации белков
- 350. Коацервация КОАЦЕРВАЦИЯ (от лат. coacervatio собирание в кучу, накопление), выделение в р-ре капель, обогащенных растворенным веществом.
- 351. Студни, гели – связнодисперсные системы ВМС набухание Студень Студни — это структурированные системы со свойствами эластичных
- 352. Студни, гели – связнодисперсные системы Студень Природа ВМС, его структура, форма макромолекул; Концентрация ВМС; рН среды,
- 353. Свойства студней и гелей
- 354. Свойства студней и гелей Кольца Лизеганга Синерезис Тиксотропия Золь Гель Механическое воздействие
- 355. Биогенные элементы Комплексные соединения
- 356. Бионеорганическая химия – это химия ионов биометаллов и их биокомплексов Макроэлементы (ω > 0,01%): С, H,
- 358. aq aq , , aq , aq , Микроэлементы - организаторы жизни (>10-5%): Fe2+ Zn2+ Co2+
- 359. Биогенные элементы Классификация по функции Органогенные С, H, O, N, S, P Регуляторы Микроэлементы Металлы жизни:
- 360. Токсичные металлы R-SH + Ag+ 2R-SH + Hg2+ 2R-SH + Hg22+ R-SAg + H+ (R-S)2Hg +
- 362. Строение атома
- 363. n = 1 n = 4 n = 3 n = 2 Главное квантовое число (n)
- 364. Орбитальное (побочное) квантовое число (L) характеризует «форму» орбитали – плотность вероятности нахождения электрона у ядра. Орбитальное
- 365. Магнитное квантовое число (ml) определяет ориентацию орбитали в пространстве Численные значения числа ml выражаются следующей зависимостью:
- 366. Спиновое квантовое число (ms или S) Характеризует собственное вращательное движение электрона – «спин» Поскольку возможны только
- 367. КВАНТОВЫЙ «ПАСПОРТ» ЭЛЕКТРОНА n = 3 Значения числа ml 0 -1 0 +1 -2 -1 0
- 368. s-орбиталь l = 0, m = 0
- 369. p-орбитали x px y z x py y z x pz z y l = 1,
- 370. p-орбитали
- 371. d-орбитали l = 2, m = -2,-1,0,+1,+2
- 372. dxy-орбиталь
- 373. Многоэлектронный атом Принцип минимума энергии 1s Фундаментальные закономерности ПРАВИЛА КЛЕЧКОВСКОГО
- 374. Из двух конкурентных орбиталей первой заполняется та, для которой меньше сумма Значений главного и орбитального квантового
- 375. Принцип Паули В атома не может быть двух электронов с одинаковым набором значений всех четырех квантовых
- 376. Правило Гунда В невозбужденных атомах электроны в пределах данного подуровня занимают максимальное число свободных орбиталей, при
- 378. Скачать презентацию





























































![Химическое равновесие υ → = υ ← k →[A]a [B]b =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-62.jpg)
![p(С)c p(D)d Kравн. = p( A)a p(B)b [С]c [D]d Kравн. =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-63.jpg)





































![Ионное произведение воды 2 2 −16 = 1.8 ⋅10 [H O]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-101.jpg)
![Водородный показатель Сѐрен Сѐренсен (09.01.1868-2.02.1939) Датский биохимик, основатель современной рН-метрии рН = – lg[H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-102.jpg)






![[CH3COOH] Ka = 3 [H + ]⋅[CH COO− ] Буферные системы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-109.jpg)
![Уравнение буферных систем (Гендерсона-Хассельбаха) + a [H ] = K ·](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-110.jpg)

![Буферная емкость 3 [CH COOH] K a = [H ]⋅[CH3COO ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-112.jpg)



















![Гетерогенные процессы и равновесия BaSO4 Осадок (тв) раствор (ионы) Kравн·[BaSO4]=Ks(ПР)= [Ba2+]·[SO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-132.jpg)










![Ag+ + Cl- (р-р) (р-р) AgCl(тв) Ag+(р-р)+ 2NH3 [Ag(NH3)2]+ Mg(OH)2 (тв)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-143.jpg)






















































![Ион аммония H.. [ H : N.. : H ] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-198.jpg)

![III K3[ Fe (CN)6 ] комплексообразователь лиганд внутренняя сфера число лигандов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-200.jpg)















![d 4 5 sp-гибридизация [AgCN2] - Строение комплексного иона Ag0 …4d105s1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-216.jpg)

![d Ni2+ = …3d84s0 3 4 sp3-гибридизация [NiCl4]2- парамагнитный тетраэдрический комплекс Строение комплексного иона](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-218.jpg)
![[NiCl4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-219.jpg)

![Ni2+ = …3d84s0 d 3 4 .. sp2d-гибридизация [Ni(CN)4]2- Диамагнитный квадратный комплекс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-221.jpg)
![[Ni(CN)4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-222.jpg)
![Транс-[Pt(NH3)2Cl2] Цис-[Pt(NH3)2Cl2] Цис-изомер дихлордиамминплатины (II) обладает противоопухолевой активностью и применяется в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-223.jpg)


![[Fe(H2O)6]2+ октаэдр](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-226.jpg)
![Fe2+ = …3d64s0 d 3 4 Внутренняя sp3d2-гибридизация [Fe(CN)6]4- Диамагнитный октаэдр .. ..](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-227.jpg)

![Изолированные [Cu(NH3)4]SO4 Равновесия в растворах комплексных соединений [Сu(NH3)4]2+ + SO42- Первичная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-229.jpg)
![Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за лиганд [Сu(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-230.jpg)
![Совмещенные, конкурирующие Равновесия в растворах комплексных соединений Конкуренция за комплексообразователь [Сu(NH3)4]2+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-231.jpg)
![Совмещенные, конкурирующие процессы разных типов AgCl + NH3 [Ag(NH3)2]Cl р-р AgClтв](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-232.jpg)










![Аминокислоты - комплексоны Хелатный эффект 3 6 [Ni(NH ) ]2+ Кнест.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/724374/slide-243.jpg)




































































































































 Положение металлов в ПС, особенности строения их атомов, физические свойства
Положение металлов в ПС, особенности строения их атомов, физические свойства Упражнения по теме скорость химической реакции
Упражнения по теме скорость химической реакции Неорганические вещества. Минеральные соли и кислоты
Неорганические вещества. Минеральные соли и кислоты Атом тұрақтылығының шарттары
Атом тұрақтылығының шарттары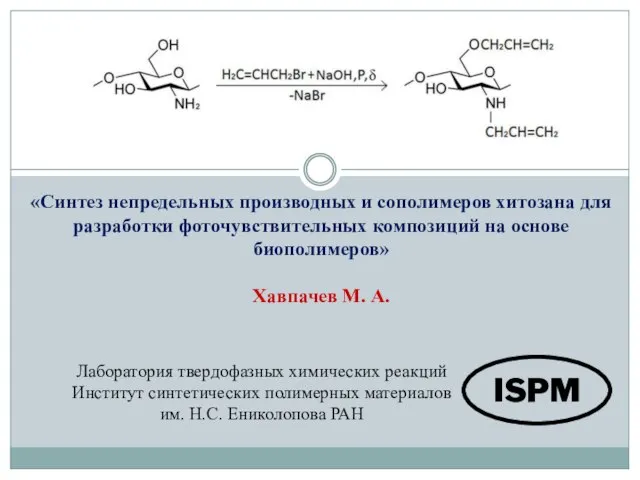 Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Гидроксид магния. Mg(OH)2
Гидроксид магния. Mg(OH)2 Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви
Александр Михайлович БУТЛЕРОВ Презентация учителя химии школы №122 Центрального р-на Санкт-Петербурга Поспеловой Светланы Ви Биохимические аспекты рационального питания
Биохимические аспекты рационального питания Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Именные реакции в органической химии
Именные реакции в органической химии Презентация по Химии "Солі в природі" - скачать смотреть бесплатно
Презентация по Химии "Солі в природі" - скачать смотреть бесплатно Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы
Алкендер – қаныпаған көмірсутектер. Алынуы, химиялық қасиеттері және қолданылуы Органические и неорганические вещества
Органические и неорганические вещества Получение этилена и опыты с ним. (Практическая работа 2)
Получение этилена и опыты с ним. (Практическая работа 2) Алкалоиды
Алкалоиды Сполуки фосфору
Сполуки фосфору Химическая связь
Химическая связь Алюминий - презентация скачать
Алюминий - презентация скачать  Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации
Растворы неэлектролитов. Закон Вант- Гоффа и Рауля. Растворы электролитов. Теория электронной диссоциации Основы электрохимии
Основы электрохимии Семь чудес света и роль металлов в их создании
Семь чудес света и роль металлов в их создании Задачи на смеси (задание № 33)
Задачи на смеси (задание № 33) Презентация по Химии "Углеводы или сахариды" - скачать смотреть
Презентация по Химии "Углеводы или сахариды" - скачать смотреть  Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск 2005
Выполнил ученик 11-б класса МОУ СОШ №41 Гандилян Армен Руководитель: Изместьева Н.Д. Красноярск 2005 Физико-химический метод очистки сточных вод
Физико-химический метод очистки сточных вод Состав раствора количественно характеризуется величинами концентраций
Состав раствора количественно характеризуется величинами концентраций Алюминий и его соединения
Алюминий и его соединения Углеводы. Моносахариды и их производные. (Лекция 5)
Углеводы. Моносахариды и их производные. (Лекция 5)