Содержание
- 2. Бор (хімічний символ — B, лат. Borum) — хімічний елемент з атомним номером 5, який належить
- 3. В природі бор у елементарному вигляді не зустрічається та не відноситься до числа найпоширеніших елементів земної
- 4. Основними мінеральними формами бору є: Борати: бура Na2B4O7·10H2O, керніт Na2B4О7·4Н2О, сасолін В(ОН)3·10H2O, ашарит MgBO2(OH), гідроборацит (Ca,
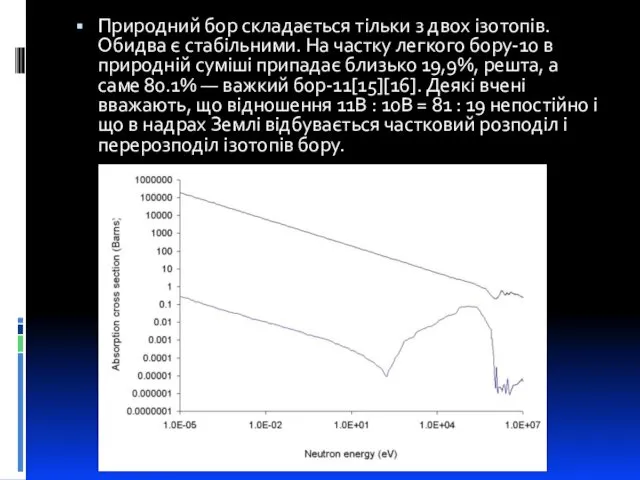
- 5. Природний бор складається тільки з двох ізотопів. Обидва є стабільними. На частку легкого бору-10 в природній
- 6. Проста речовина бор має кілька алотропних модифікацій, він існує в і аморфному, і кристалічному видах. Всі
- 7. α-тригональний-Бор має комірки з дванадцяти атомів бору, структура яких складається з ікосаедрів B12, в котрих кожен
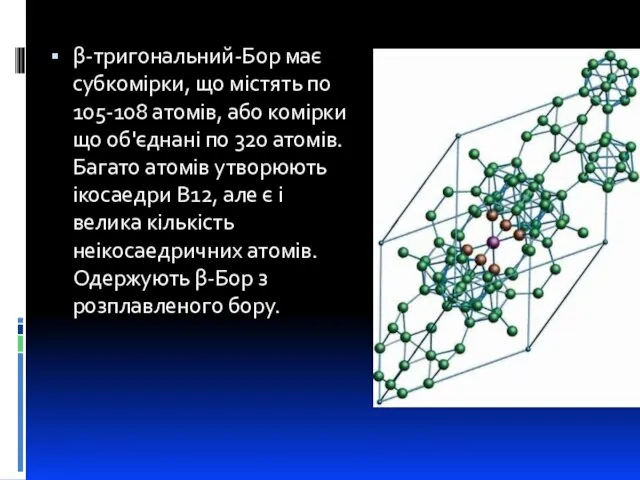
- 8. β-тригональний-Бор має субкомірки, що містять по 105-108 атомів, або комірки що об'єднані по 320 атомів. Багато
- 9. Напівметал бор являється вельми інертною речовиною, нерозчинною у воді, і майже нерозчинною у кислотах (причому кристалічний
- 10. Елементарний бор з природної сировини отримують у кілька стадій. У промисловості спочатку з природних боратів сплавленням
- 11. Бор та його сполуки широко використовуються в промисловості та народному господарстві: Близько 50 % природних і
- 13. Скачать презентацию








 Характеристика и свойства истинных растворов
Характеристика и свойства истинных растворов Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест
Периодическая система и периодический закон химических элементов Д.И. Менделеева. Тест Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті” Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы»
Аттестационная работа. Методическая разработка исследователького урока «Строение вещества. Молекулы и атомы» Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 класса Кирако
Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 класса Кирако Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii
Lektsia_1_Osnovnye_ponyatia_i_zakony_khimii Правила безопасни 7-й класс
Правила безопасни 7-й класс Химическая связь
Химическая связь Д. И. Менделеев Автор: Ким Н. В. учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год.
Д. И. Менделеев Автор: Ким Н. В. учитель химии МОУСОШ №6 г. Нягани ХМАО-Югры 2008 год. Биохимия крови
Биохимия крови Циклоалканы
Циклоалканы Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2)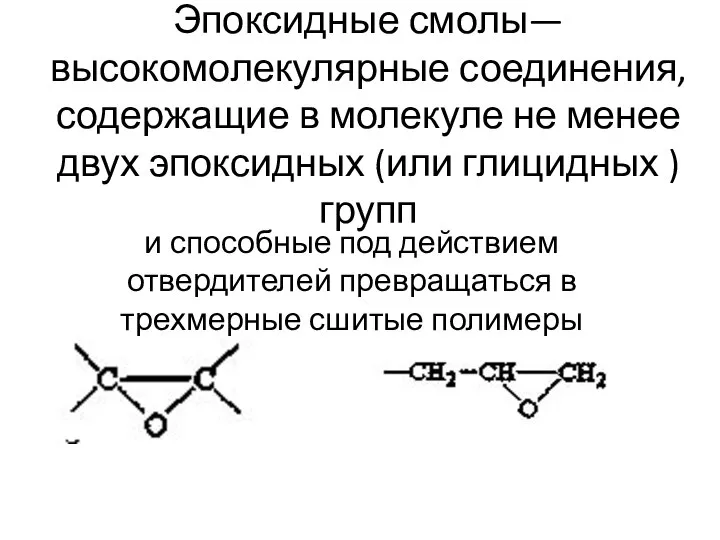 Эпоксидные смолы
Эпоксидные смолы Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Алкадиены: строение,номенклатура,гомологи,изомерия Урок химии в 9 классе Учитель: Дворничена Л.В.
Алкадиены: строение,номенклатура,гомологи,изомерия Урок химии в 9 классе Учитель: Дворничена Л.В.  Алкины - непредельные углеводороды с общей формулой CnH2n+2
Алкины - непредельные углеводороды с общей формулой CnH2n+2 Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия
Мыло ручной работы Подготовила ученицы 11 класса Хахалева Юлия  Роль воды в организме человека
Роль воды в организме человека Вода, которую мы пьем
Вода, которую мы пьем Химия в быту
Химия в быту Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основные типы промышленных масел
Основные типы промышленных масел Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола
Нанокомпозиционный материал на основе фенолоформальдегидной смолы, эпоксидной смолы, полистирола Polymers
Polymers Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Крахмал. Строение вещества
Крахмал. Строение вещества ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
ГИДРОЛИЗ ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ