Содержание
- 2. 1924 год Франция Луи де Бройль (Луи Виктор Пьер Реймон, 7-й герцог Брольи) (1892-1987) Лауреат нобелевской
- 3. 1927 год США Клинтон Дж. Дэвиссон (1881-1958) Лауреат нобелевской премии по физике (1937) Лестер Г. Джермер
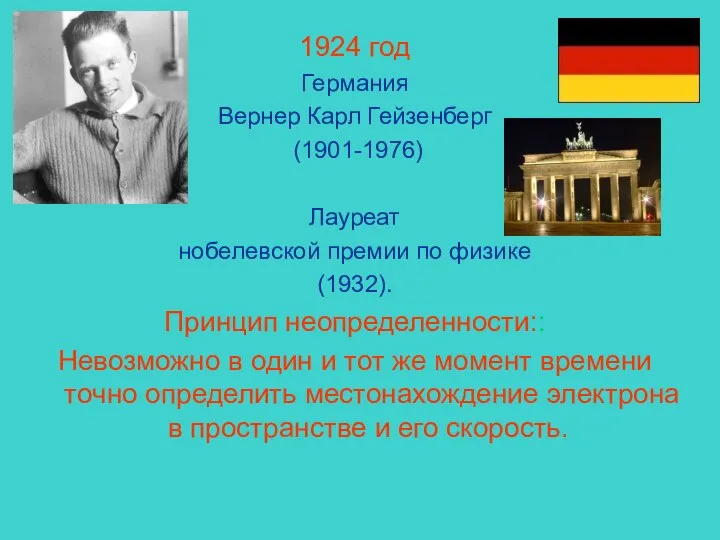
- 4. 1924 год Германия Вернер Карл Гейзенберг (1901-1976) Лауреат нобелевской премии по физике (1932). Принцип неопределенности:: Невозможно
- 5. 1926 год Австрия Эрвин Шредингер (1887-1961) Лауреат нобелевской премии по физике (1933) Уравнение Шредингера
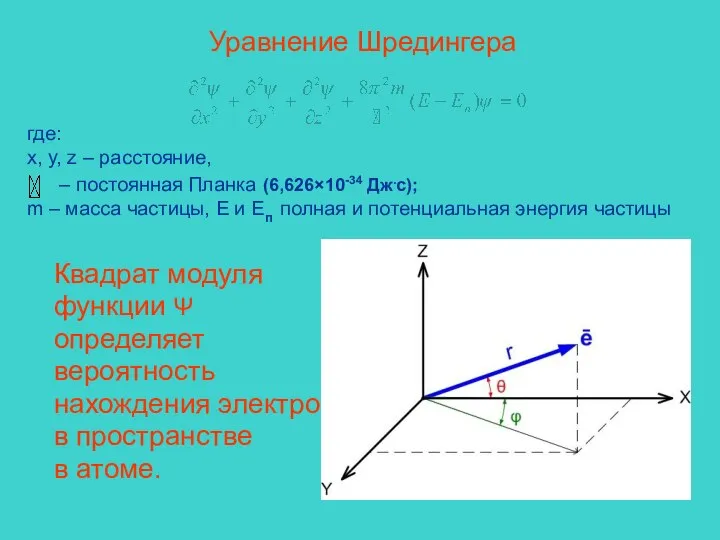
- 6. Уравнение Шредингера где: x, y, z – расстояние, – постоянная Планка (6,626×10-34 Дж.с); m – масса
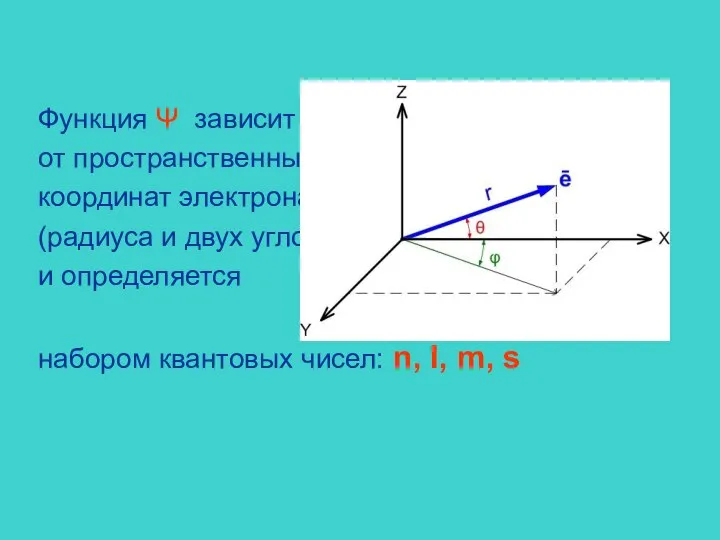
- 7. Функция Ψ зависит от пространственных координат электрона (радиуса и двух углов) и определяется набором квантовых чисел:
- 8. Квантовые числа
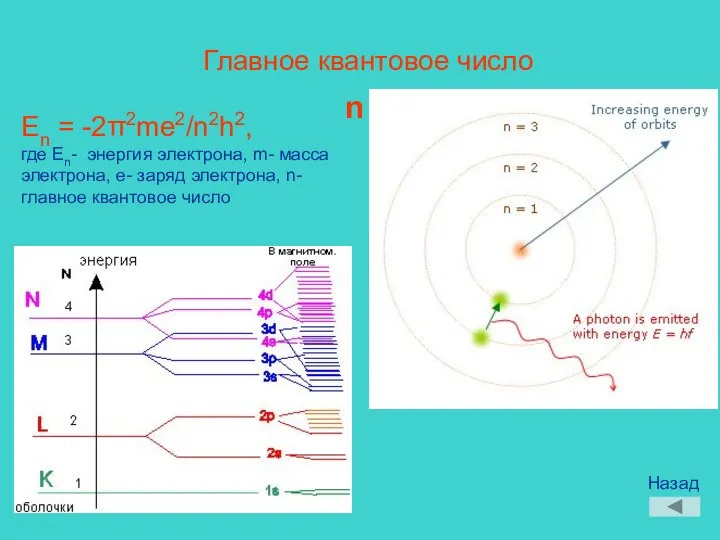
- 9. Главное квантовое число n En = -2π2me2/n2h2, где En- энергия электрона, m- масса электрона, e- заряд
- 10. Орбитальное квантовое число l Назад
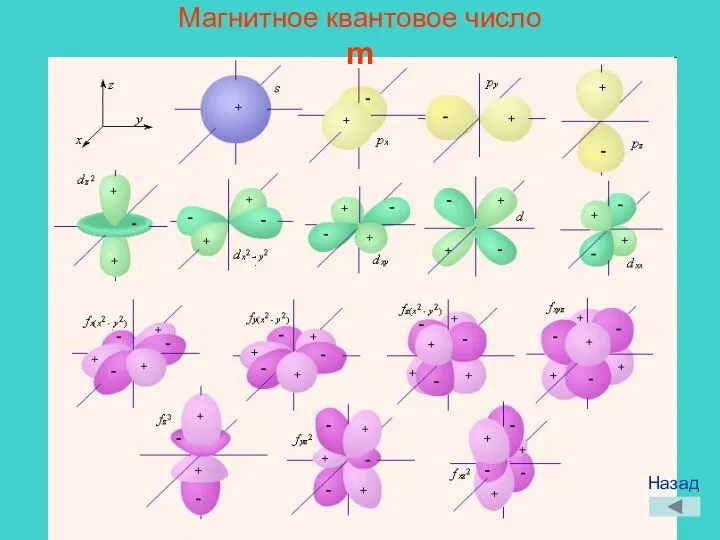
- 11. Магнитное квантовое число m Назад
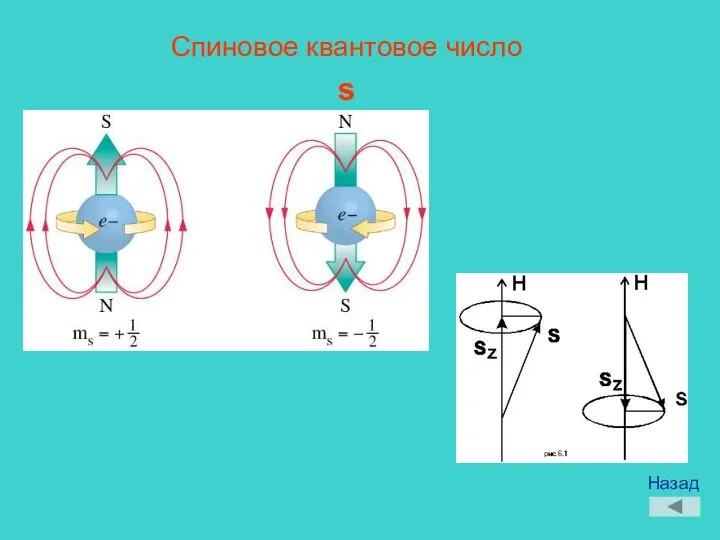
- 12. Спиновое квантовое число s Назад
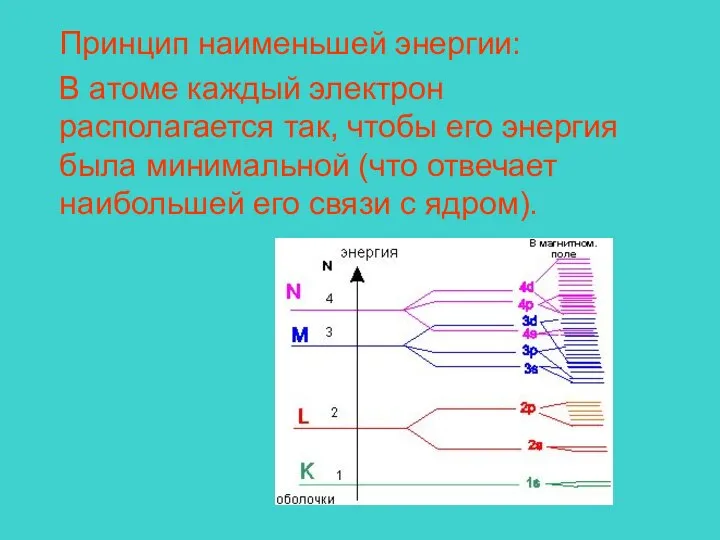
- 13. Принцип наименьшей энергии: В атоме каждый электрон располагается так, чтобы его энергия была минимальной (что отвечает
- 14. 1961 Клечковский Всеволод Маврикиевич (1900 -1972) Россия Правило Клечковского: Электрон занимает в основном состоянии уровень не
- 15. 1940 Вольфганг Эрнст Паули (1900 – 1958) Австрия Лауреат нобелевской премии (1945) Принцип Паули: В атоме
- 16. Фридрих Хунд (1896 – 1997) Германия Правило Хунда: При данном значении l (т. е. в пределах
- 18. Скачать презентацию








 Аттестационная работа. Мыловарение. Создание мыла своими руками
Аттестационная работа. Мыловарение. Создание мыла своими руками Современные области применения изотопной продукции
Современные области применения изотопной продукции Презентация по Химии "Исследование содержания глюкозы в различных соках" - скачать смотреть
Презентация по Химии "Исследование содержания глюкозы в различных соках" - скачать смотреть  Строение атома
Строение атома Аттестационная работа. Методическая разработка по выполнению проекта Краски из природных материалов
Аттестационная работа. Методическая разработка по выполнению проекта Краски из природных материалов Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники
Окисно-відновні реакції, процеси окиснення і відновлення, окисники і відновники Водород- зеленое топливо
Водород- зеленое топливо Основные понятия и законы химии
Основные понятия и законы химии Дисперсные системы. Поверхностная энергия
Дисперсные системы. Поверхностная энергия Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Оксиды. Номенклатура, классификация, свойства
Оксиды. Номенклатура, классификация, свойства Презентация по Химии "Химический КВН" - скачать смотреть
Презентация по Химии "Химический КВН" - скачать смотреть  Промежуточный обмен
Промежуточный обмен Химические уравнения
Химические уравнения 1.При растворении в воде гидроксид-ионы образует вещество, формула которого: 1.При растворении в воде гидроксид-ионы образует ве
1.При растворении в воде гидроксид-ионы образует вещество, формула которого: 1.При растворении в воде гидроксид-ионы образует ве Соединительная ткань. Биохимия межклеточного матрикса. (Тема 8)
Соединительная ткань. Биохимия межклеточного матрикса. (Тема 8) Серная кислота. Физические свойства
Серная кислота. Физические свойства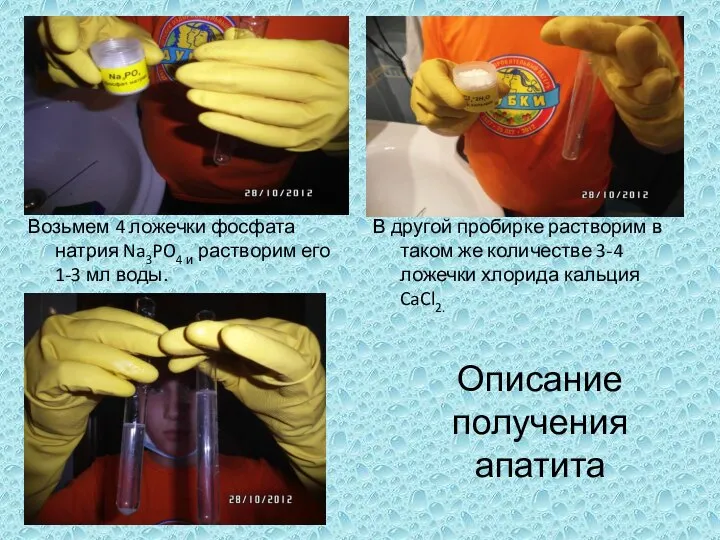 Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды.
Возьмем 4 ложечки фосфата натрия Na3PO4 и растворим его 1-3 мл воды. Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние История одного открытия
История одного открытия  Состав краски
Состав краски Средства борьбы с вредителями растений. Инсектициды и акарициды. (Лекция 6)
Средства борьбы с вредителями растений. Инсектициды и акарициды. (Лекция 6) Валентність
Валентність  Химия и проблемы охраны окружающей среды (11 класс)
Химия и проблемы охраны окружающей среды (11 класс) Дисперсті жүйелердің оптикалық әдістері
Дисперсті жүйелердің оптикалық әдістері Реакции замещения. Электрохимический ряд напряжений.
Реакции замещения. Электрохимический ряд напряжений. Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Алкины 10 класс - Презентация_
Алкины 10 класс - Презентация_