Содержание
- 2. 1. История изучения атома. 2. Открытия, доказавшие сложность строения атома. 3. Модели атома. 4. Состав атома.
- 3. Люди всегда задумывались о строении микромира, но на пороге новой эры так и не пришли к
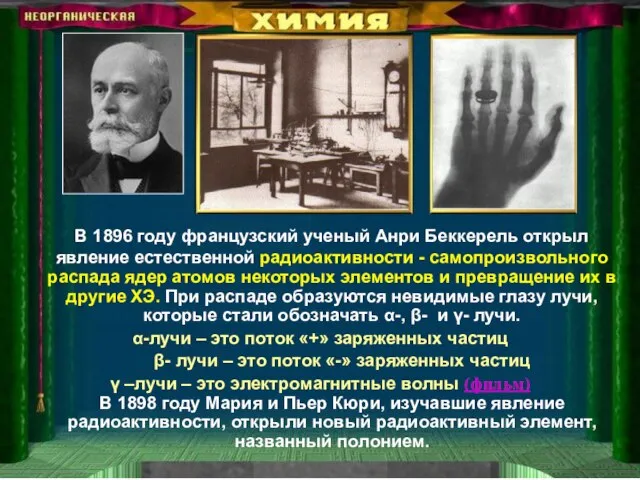
- 4. В 1879 году английский ученый Уильям Крукс открыл катодные лучи - поток быстролетящих отрицательно заряженных частиц,
- 5. В 1895г. немецкий ученый Уильям Конрад Рентген обнаружил новый вид излучения, обладающего большой проникающей способностью, и
- 6. В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности - самопроизвольного распада ядер атомов
- 7. Главным итогом совершенных открытий было, ясное осознание того, что атом не является мельчайшей частицей вещества, он
- 8. Первой экспериментально обоснованной моделью строения атома была планетарная модель Эрнеста Резерфорда, создать которую ему помог специально
- 9. Когда на их пути помещали золотую фольгу, то происходило в основном их слабое рассеивание. Однако, было
- 10. Основываясь на эксперименте. Резерфорд предположил, что в центре атома находится массивное «+» заряженное ядро, вокруг которого
- 11. Современная модель строения атома. Состав ядра Ядро - это центральная часть атома, в котором сосредоточена практически
- 12. Нуклоны имеют следующие характеристики: масса заряд p+ 1 +1 n0 1 0 Mасса атома (массовое число)
- 13. Вокруг ярда движутся электроны (e-), образующие электронную оболочку, размеры которой определяют размеры самого атома. Заряд e-
- 14. Число протонов определяет заряд ядра (Z) Число протонов равно числу электронов: атом – электронейтральная частица Число
- 15. Химический элемент – это определенный вид атомов с одинаковым зарядом ядра
- 17. Скачать презентацию













 Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ
Презентація по хімії на тему:БУДІВЕЛЬНІ МАТЕРІАЛИ  Основные разделы химии
Основные разделы химии Защита металлов от коррозии
Защита металлов от коррозии Рубидий, цезий, франций
Рубидий, цезий, франций Каталитикалық риформинг
Каталитикалық риформинг Скорость химических реакций
Скорость химических реакций Естественная и техногенная радиоактивность ос. Радиохимические методы исследования радионуклидного состава
Естественная и техногенная радиоактивность ос. Радиохимические методы исследования радионуклидного состава Химические и физические явления
Химические и физические явления Неорганическая химия (все для повторения)
Неорганическая химия (все для повторения) Трансформация соединений азота
Трансформация соединений азота Презентация Белки
Презентация Белки Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Нефть как дисперсная система
Нефть как дисперсная система Графит. Химические свойства
Графит. Химические свойства Окислы. Лекция 14
Окислы. Лекция 14 Растворы
Растворы Кислоты, соли
Кислоты, соли Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Клеящие материалы. Классификация и ассортимент клея
Клеящие материалы. Классификация и ассортимент клея Введение. Тренажер
Введение. Тренажер Ароматические углеводороды
Ароматические углеводороды Химическая связь и ее типы
Химическая связь и ее типы Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті
Аминспирттер және олардың биологиялық ролі.Элементорганикалық қосылыстар және олардың қасиеті Каучуки. Гума
Каучуки. Гума Радиоактивный распад. Чернобыль
Радиоактивный распад. Чернобыль Химико – математические проценты
Химико – математические проценты Кислоты. Классификация кислот
Кислоты. Классификация кислот Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов
Термодинамическая теория растворов электролитов. Электропроводность растворов электролитов