Содержание
- 2. Электролиты - вещества, диссоциирующие на ионы при взаимодействии с растворителем и сообщающие раствору способность проводить электрический
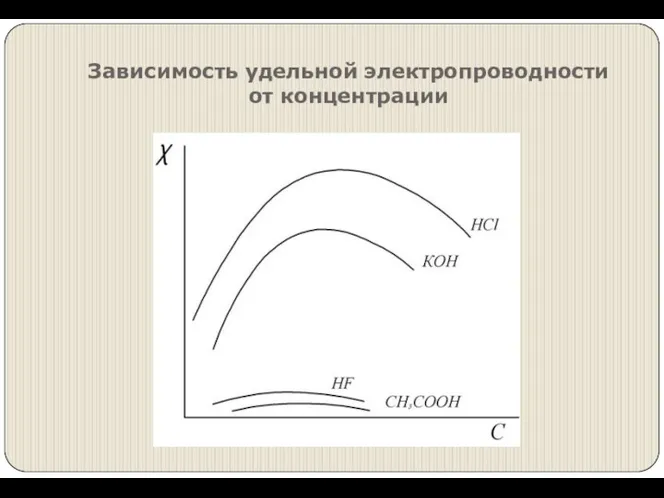
- 4. Зависимость удельной электропроводности от концентрации
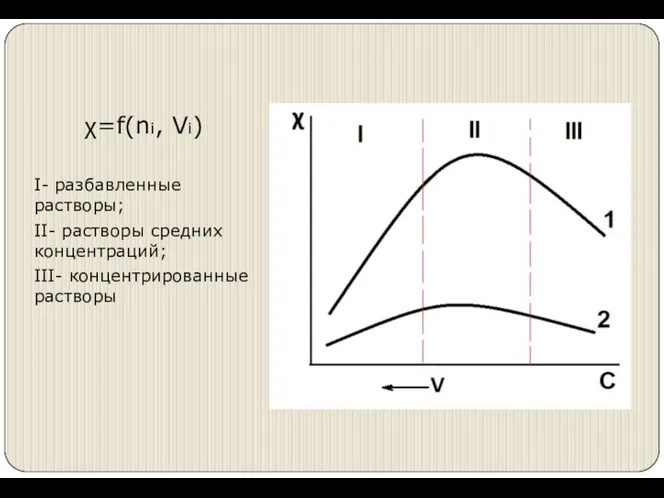
- 5. χ=f(ni, Vi) I- разбавленные растворы; II- растворы средних концентраций; III- концентрированные растворы
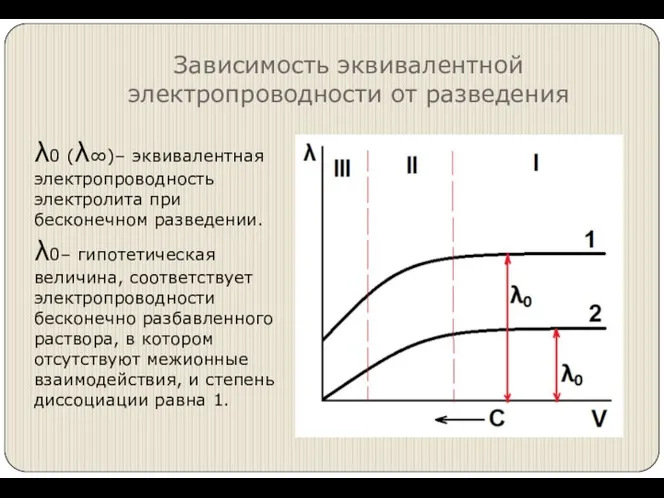
- 8. Зависимость эквивалентной электропроводности от разведения λ0 (λ∞)– эквивалентная электропроводность электролита при бесконечном разведении. λ0– гипотетическая величина,
- 10. При бесконечном разведении растворов кулоновские силы исчезают, величины ионных подвижностей стремятся к предельным значениям.
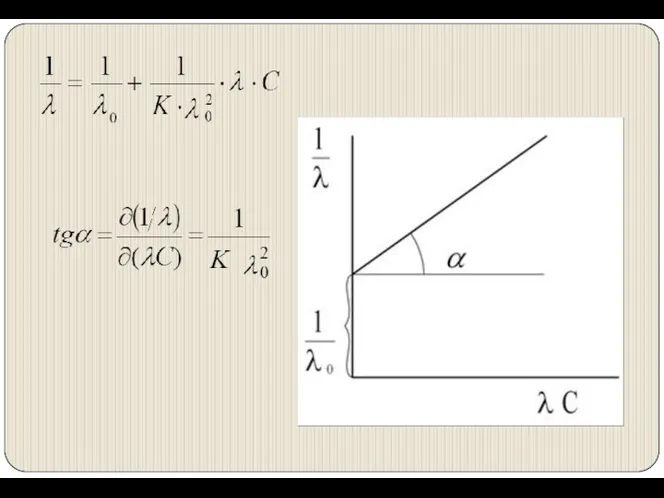
- 11. Зависимость электропроводности электролитов от концентрации при Т=const Разбавленные растворы сильных электролитов подчиняются закону Кольрауша: А –
- 12. Растворы слабых электролитов подчиняются закону разведения Оствальда.
- 15. Движение ионов в электрическом поле. Числа переноса ионов
- 19. Влияние природы электролита (иона и парного иона)
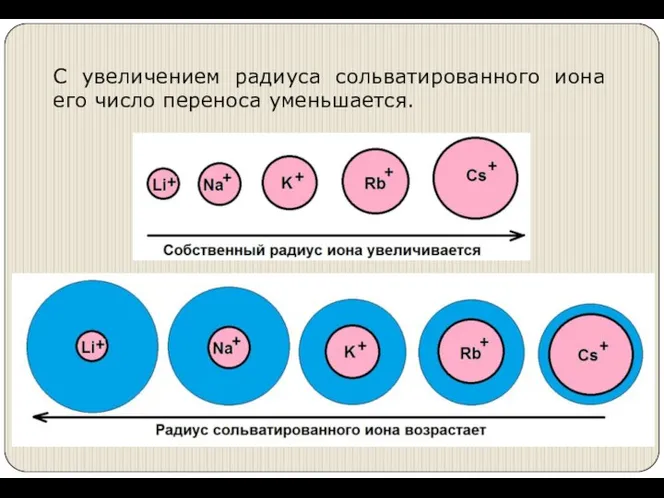
- 20. С увеличением радиуса сольватированного иона его число переноса уменьшается.
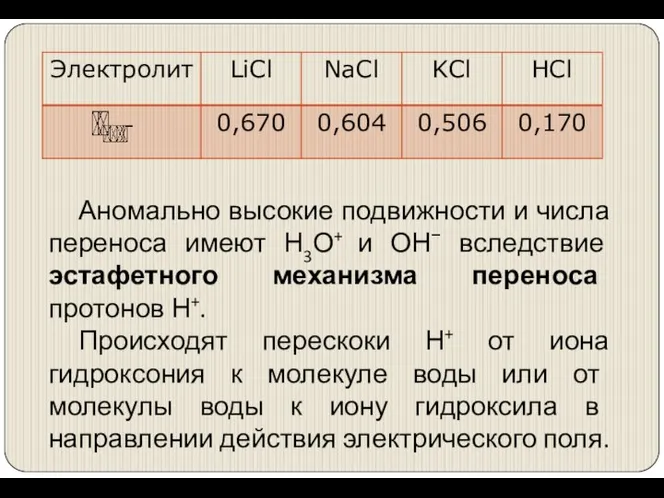
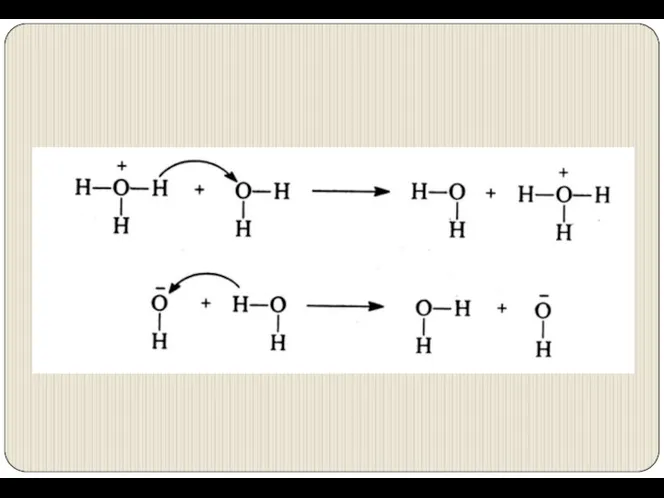
- 21. Аномально высокие подвижности и числа переноса имеют Н3О+ и ОН− вследствие эстафетного механизма переноса протонов Н+.
- 23. Влияние температуры. С ростом температуры снижается вязкость раствора; происходит десольватация ионов; числа переноса катиона и аниона
- 25. Скачать презентацию















 Поліетелен Застосування поліетилену Автор Фурка Т.А.
Поліетелен Застосування поліетилену Автор Фурка Т.А.  Волшебные свойства воды
Волшебные свойства воды Своя игра «Знаешь ли ты химические элементы?»
Своя игра «Знаешь ли ты химические элементы?» Химическая связь
Химическая связь Структура белков, уровни структурной организации белковых молекул
Структура белков, уровни структурной организации белковых молекул Химия в строительстве
Химия в строительстве Биохимия печени
Биохимия печени Средства для борьбы с бытовыми насекомыми
Средства для борьбы с бытовыми насекомыми Презентация по Химии "Физические и химические свойства кислот. 8-й класс" - скачать смотреть
Презентация по Химии "Физические и химические свойства кислот. 8-й класс" - скачать смотреть  Оксиды и кислородсодержащие кислоты неметаллов
Оксиды и кислородсодержащие кислоты неметаллов Эндогенная серия. Вулканогенно-осадочная группа
Эндогенная серия. Вулканогенно-осадочная группа Полимеры
Полимеры Периодический закон и периодическая система Д. И. Менделеева
Периодический закон и периодическая система Д. И. Менделеева Дополнительные конструктивные элементы реакторов
Дополнительные конструктивные элементы реакторов Этил спиртін өндірісте алу
Этил спиртін өндірісте алу Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой
Воздух. Кислород. Горение. Работа выполнена: Учителем химии ГБОУ СОШ № 118 Выборгского района Санкт - Петербурга Тихомировой Презентация по Химии "Электролиты и неэлектролиты. Катионы и анионы" - скачать смотреть
Презентация по Химии "Электролиты и неэлектролиты. Катионы и анионы" - скачать смотреть  Силикаты. Классификация силикатов
Силикаты. Классификация силикатов Техника безопасности для учащихся в кабинете химии.
Техника безопасности для учащихся в кабинете химии.  Пищевая биотехнология
Пищевая биотехнология Пиролиз
Пиролиз Галогены
Галогены Основные понятия и законы химии
Основные понятия и законы химии Э.М. Спиридонов. Эволюция минералов вольфрама в зоне гипергенеза
Э.М. Спиридонов. Эволюция минералов вольфрама в зоне гипергенеза Дикарбоновые кислоты
Дикарбоновые кислоты Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители
Технологические методы производства деталей машин из ПКМ, содержащих дисперсные наполнители Origin of petroleum dilemma
Origin of petroleum dilemma Химическая термодинамика. Лекция 2
Химическая термодинамика. Лекция 2