Содержание
- 2. Лекция №2 Строение органических молекул 1. Введение 2. Строение атома 3. Проблема химической связи Электроотрицательность; Ковалентная
- 3. Фридрих Август Кекуле Алексадр Михайлович Бутлеров Арчибальд Скотт Купер Теория валентности; четырех- валентность атома углерода 1857г.
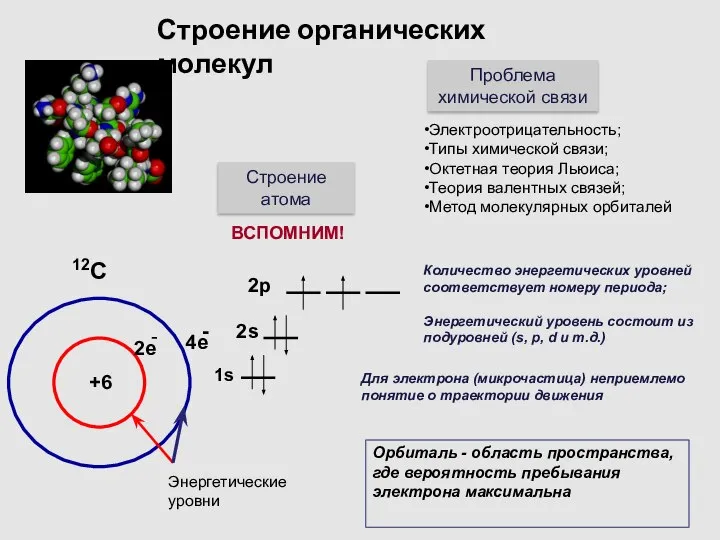
- 4. Строение органических молекул Строение атома Проблема химической связи Электроотрицательность; Типы химической связи; Октетная теория Льюиса; Теория
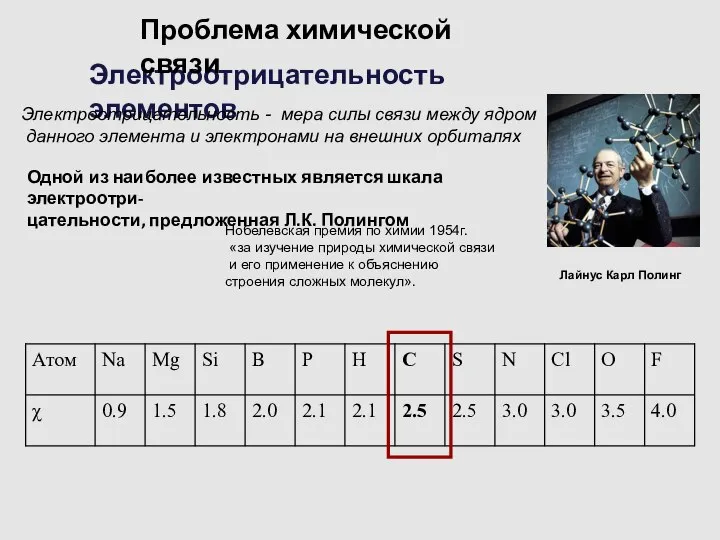
- 5. Электроотрицательность элементов Электроотрицательность - мера силы связи между ядром данного элемента и электронами на внешних орбиталях
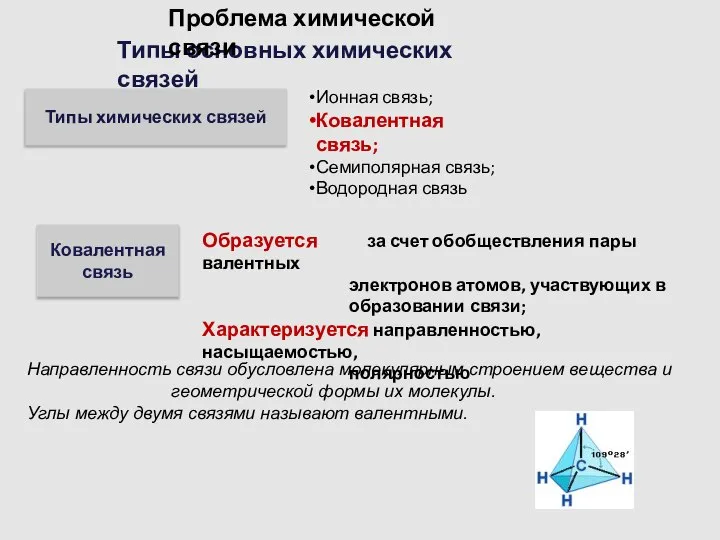
- 6. Типы основных химических связей Проблема химической связи Типы химических связей Ионная связь; Ковалентная связь; Семиполярная связь;
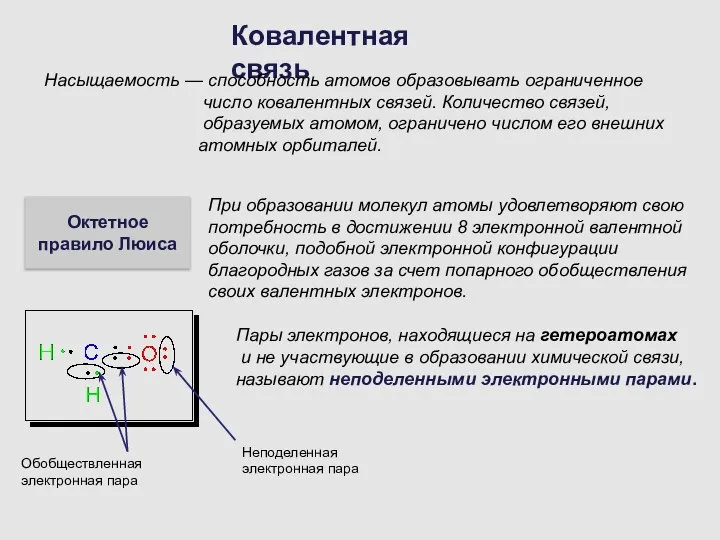
- 7. Ковалентная связь Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено
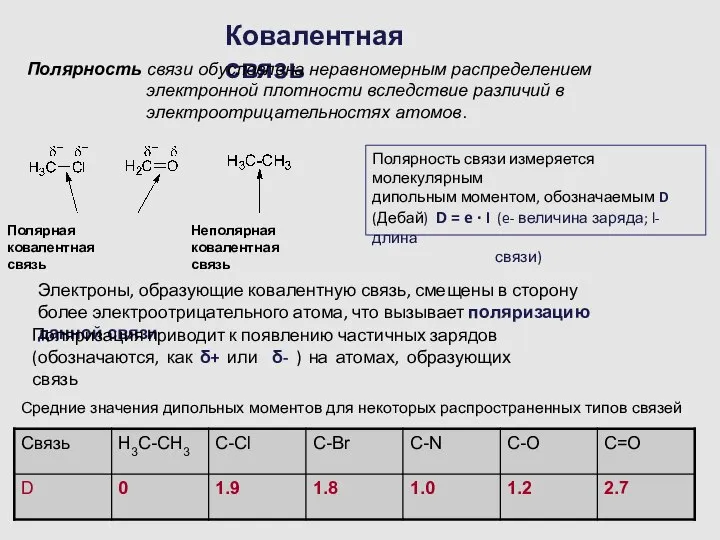
- 8. Ковалентная связь Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. Полярная ковалентная
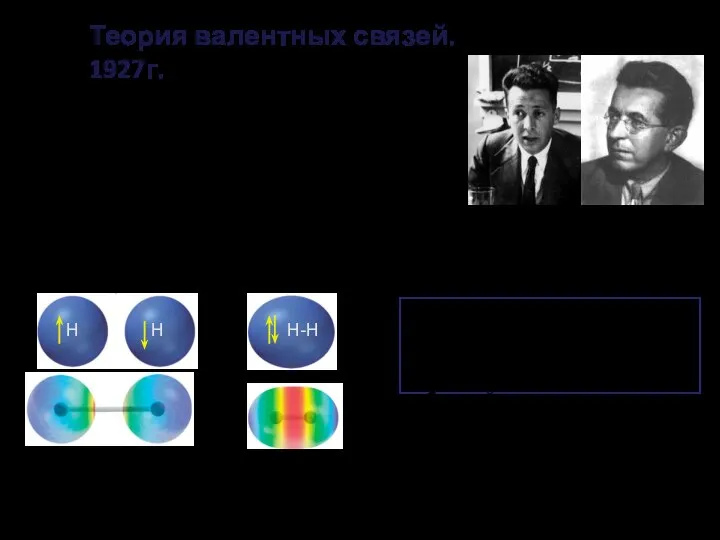
- 9. Вальтер Генрих Гейтлер Фриц Лондон Теория валентных связей. 1927г. Каждая пара атомов в молекуле удерживается вместе
- 10. Концепция гибридизации атомных орбиталей, 1931г. Л. Полинг Виды гибридизации sp3 — гибридизация (алканы); sp2 — гибридизация
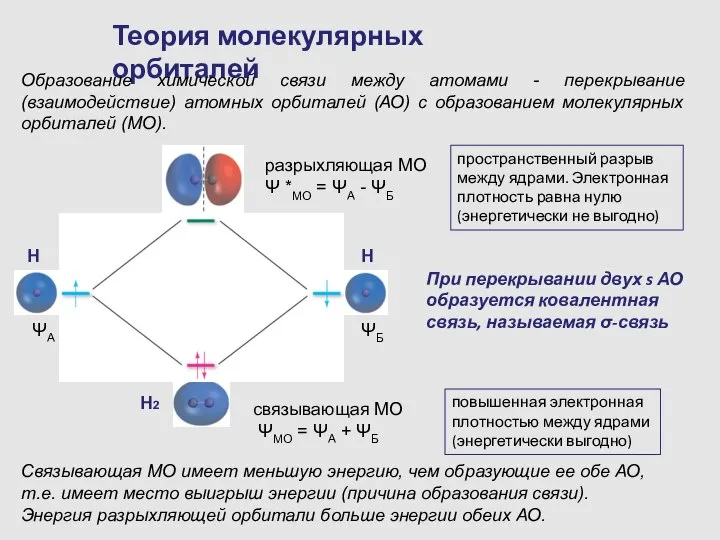
- 11. Теория молекулярных орбиталей Образование химической связи между атомами - перекрывание (взаимодействие) атомных орбиталей (АО) с образованием
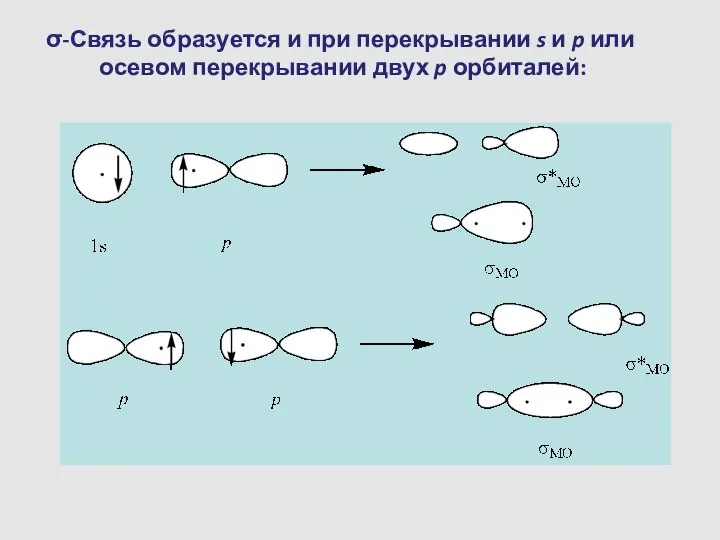
- 12. σ-Связь образуется и при перекрывании s и p или осевом перекрывании двух p орбиталей:
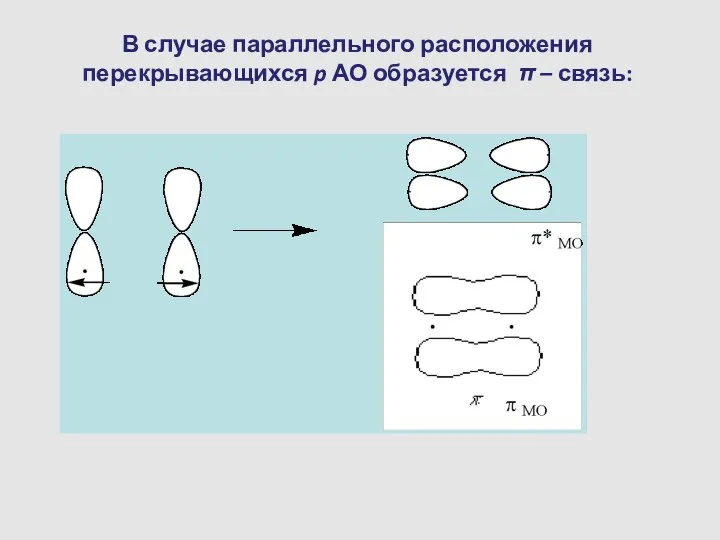
- 13. В случае параллельного расположения перекрывающихся p АО образуется π – связь:
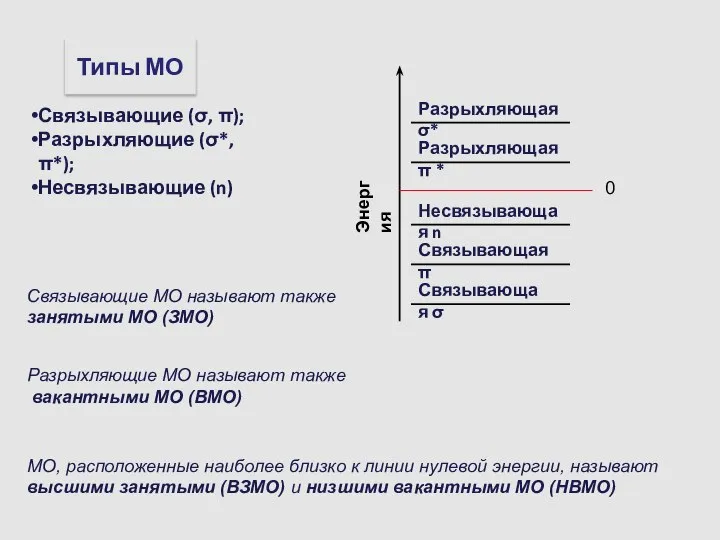
- 14. Связывающие МО называют также занятыми МО (ЗМО) Разрыхляющие МО называют также вакантными МО (ВМО) МО, расположенные
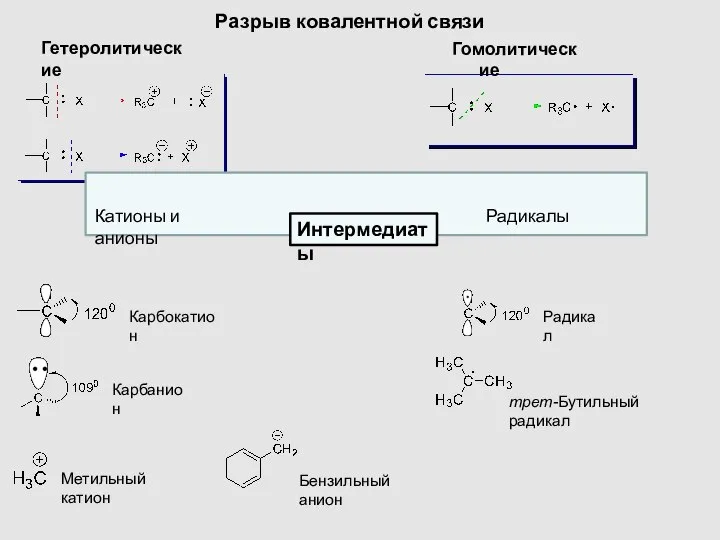
- 15. Разрыв ковалентной связи Гомолитические Гетеролитические Карбокатион Карбанион Метильный катион Радикал Бензильный анион трет-Бутильный радикал Катионы и
- 17. Скачать презентацию



 Биопластики: область применения
Биопластики: область применения Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Кристаллография. История развития
Кристаллография. История развития Производство фенолформальдегидной смолы
Производство фенолформальдегидной смолы Обмен липидов. Классификация липидов
Обмен липидов. Классификация липидов Хімічний склад синтетичних миючих засобів та їх основні нормативно-технічні показники
Хімічний склад синтетичних миючих засобів та їх основні нормативно-технічні показники Химия элементов VA группы
Химия элементов VA группы Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе
Органические производные титана со связями Ti-O-C. Получение и свойства. Полимеры на их основе Алкины. Ацетилен – представитель алкинов.
Алкины. Ацетилен – представитель алкинов. Презентация по Химии "Основные сведения о строении атома" - скачать смотреть
Презентация по Химии "Основные сведения о строении атома" - скачать смотреть  Кислотность органических соединений. Типы химических реакций
Кислотность органических соединений. Типы химических реакций Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин)
Альдегиды. Раствор формальдегида. Гексаметилентетрамин (метенамин) Нефть. Состав и свойства
Нефть. Состав и свойства «Знаки химических элементов. Относительная атомная масса химических элементов»
«Знаки химических элементов. Относительная атомная масса химических элементов» 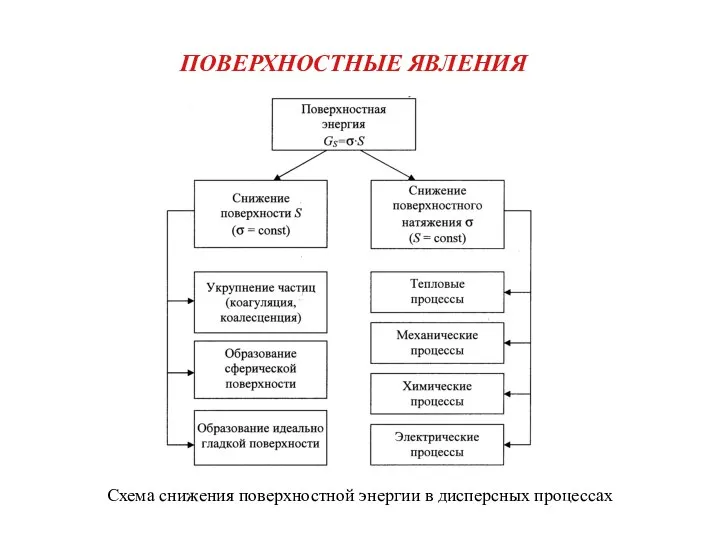 Поверхностные явления
Поверхностные явления Фазовые равновесия в системе ограниченно смешивающихся жидкостей
Фазовые равновесия в системе ограниченно смешивающихся жидкостей Способы разделения смесей
Способы разделения смесей Химические предприятия Саратовской области
Химические предприятия Саратовской области 1oe_zanyatie (1)
1oe_zanyatie (1) Напій кока-кола. Активні інгредієнти кока-коли
Напій кока-кола. Активні інгредієнти кока-коли Адсорбция. Адсорбциондық тепе-теңдік
Адсорбция. Адсорбциондық тепе-теңдік Аминокислоты
Аминокислоты Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро
Роль нафти у сучасному світі Підготував учень 11 класу Войтюк Дмитро  Новітні досягнення в хімії (9 клас)
Новітні досягнення в хімії (9 клас) Рідкі кристали Використання
Рідкі кристали Використання  Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Алканы. Гомологический ряд предельных углеводородов
Алканы. Гомологический ряд предельных углеводородов