Содержание
- 2. АТОМ – сложная частица, состоящая из положительно заряженного ядра и электронных оболочек, на которых помещаются отрицательно
- 3. Символы химических элементов представляются обычно в виде: где X – символ элемента; a – массовое число
- 4. Протоны и нейтроны объединяются в компактное ядро за счет ядерных сил, возникновение которых приводит к дефекту
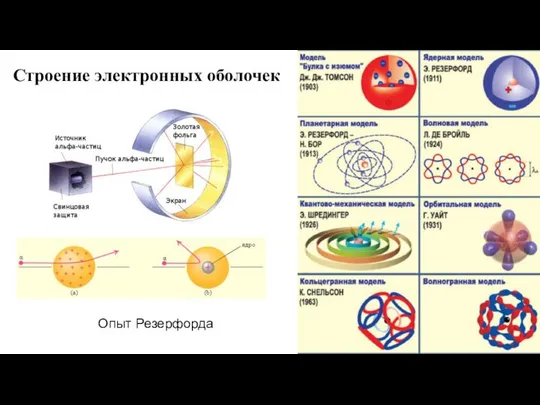
- 5. Строение электронных оболочек Опыт Резерфорда
- 6. Корпускулярно-волновой дуализм электрона (электрон обладает одновременно свойствами частицы и волны). λ – длина волны частицы; m
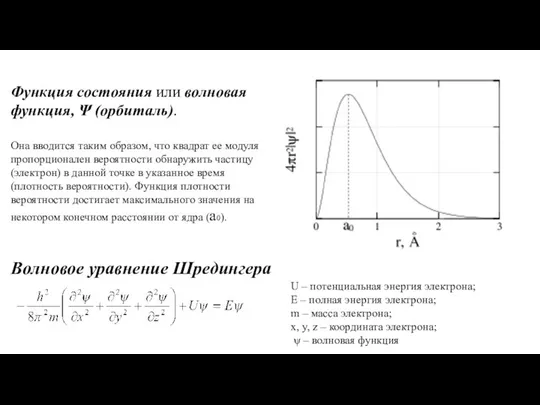
- 7. Функция состояния или волновая функция, Ψ (орбиталь). Она вводится таким образом, что квадрат ее модуля пропорционален
- 8. Решение уравнения Шредингера содержит набор квантовых чисел, характеризующих поведение электрона в атоме. n – главное квантовое
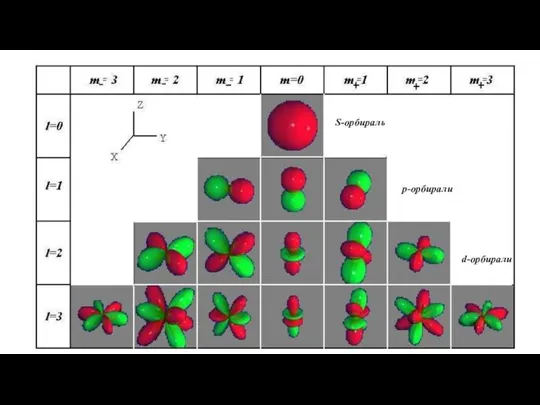
- 9. S-орбираль р-орбирали d-орбирали
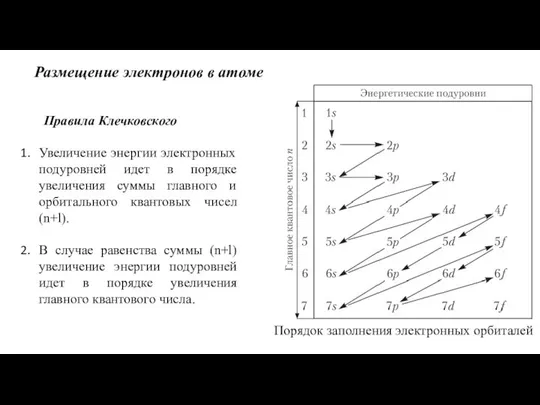
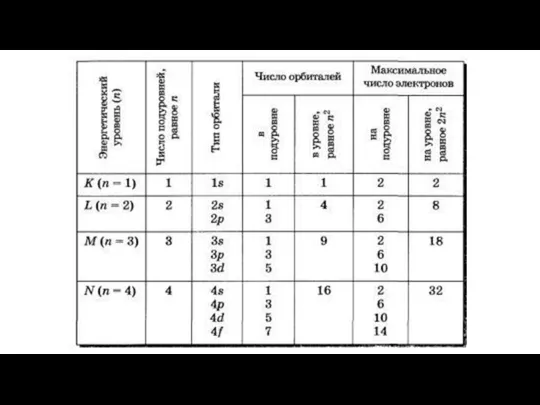
- 10. Размещение электронов в атоме Правила Клечковского Увеличение энергии электронных подуровней идет в порядке увеличения суммы главного
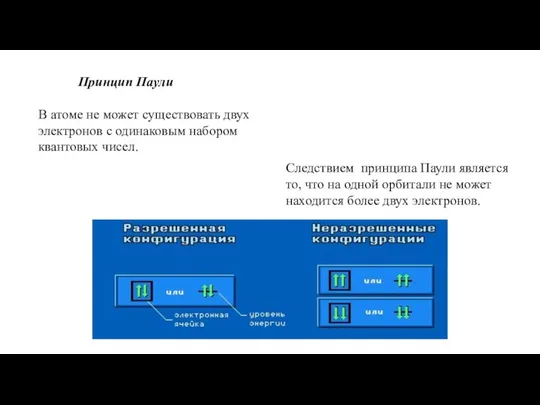
- 11. Принцип Паули В атоме не может существовать двух электронов с одинаковым набором квантовых чисел. Следствием принципа
- 12. Правило Хунда Внутри подуровня электроны заполняют орбитали таким образом, чтобы суммарное спиновое квантовое число было максимальным
- 14. Электронные формулы атомов и ионов: Число электронов в нейтральном атоме равно порядковому номеру элемента в Периодической
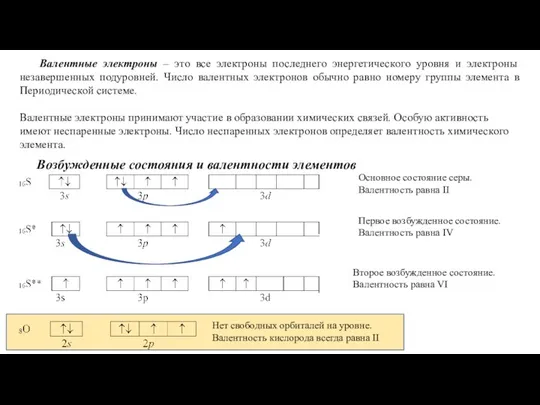
- 15. Валентные электроны – это все электроны последнего энергетического уровня и электроны незавершенных подуровней. Число валентных электронов
- 16. Часть 2. СТРОЕНИЕ МОЛЕКУЛ (ХИМИЧЕСКАЯ СВЯЗЬ) Строение вещества
- 17. Химическая связь возникает при взаимодействии атомов, обусловливающем образование химически устойчивой двух- или многоатомной системы (молекулы, кристалла
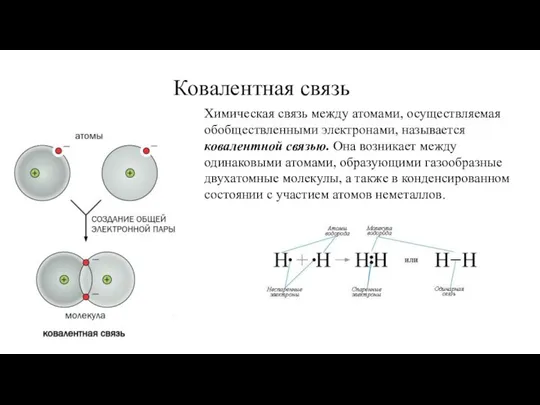
- 18. Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Она возникает между одинаковыми атомами, образующими
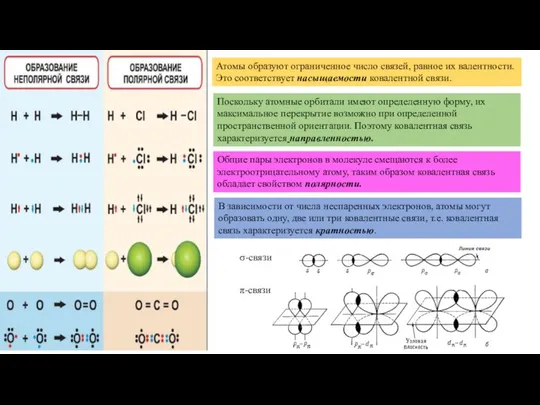
- 19. Атомы образуют ограниченное число связей, равное их валентности. Это соответствует насыщаемости ковалентной связи. В зависимости от
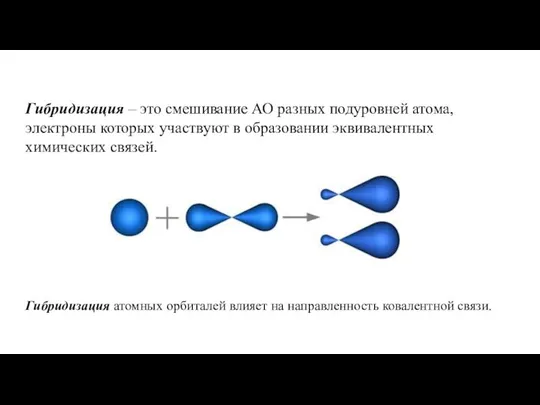
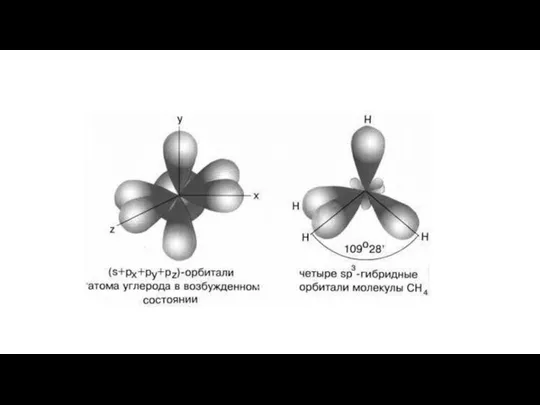
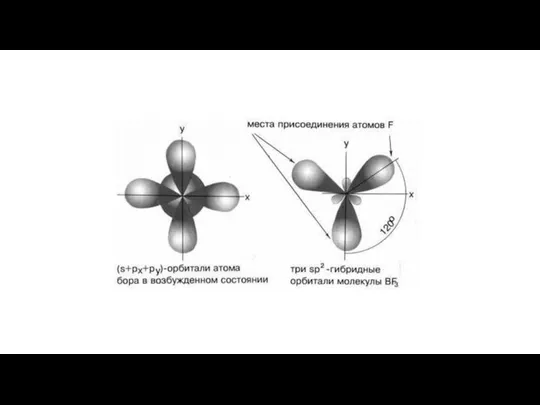
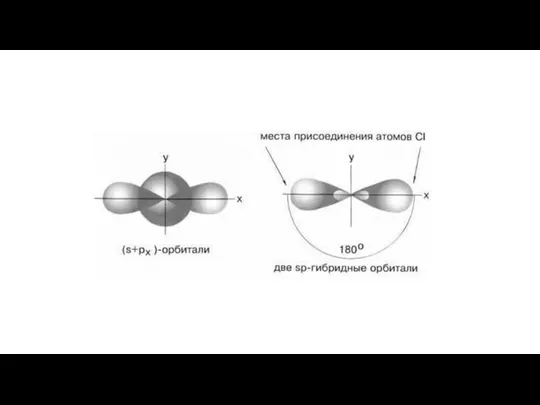
- 20. Гибридизация – это смешивание АО разных подуровней атома, электроны которых участвуют в образовании эквивалентных химических связей.
- 24. Донорно-акцепторный механизм образования ковалентной связи
- 25. Ионная связь Ионная связь – это электростатическая связь между ионами противоположных зарядов. Ионная связь может рассматриваться
- 29. Часть 3. Конденсированное состояние (взаимодействие молекул) Строение вещества
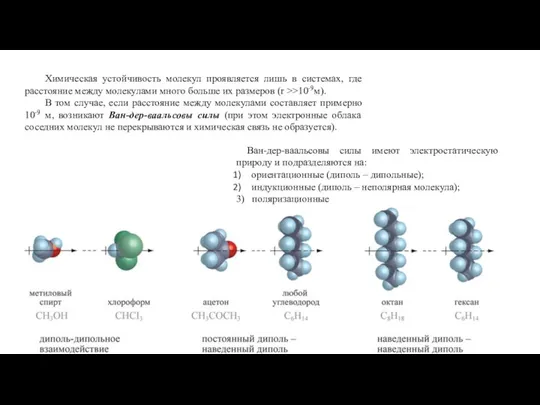
- 30. Химическая устойчивость молекул проявляется лишь в системах, где расстояние между молекулами много больше их размеров (r
- 33. Скачать презентацию
















 Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Строение атома
Строение атома Срез знаний по химии
Срез знаний по химии Алкины
Алкины Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Использование технологии критического мышления на уроках химии
Использование технологии критического мышления на уроках химии Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар
Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Введение в биохимию. Значение биохимии для врача. Химия белка
Введение в биохимию. Значение биохимии для врача. Химия белка Важнейшие минералы
Важнейшие минералы Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Получение фосфорной кислоты
Получение фосфорной кислоты Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть
Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть  Азотные удобрения
Азотные удобрения Атом. Будова атома
Атом. Будова атома Химическая кинетика и катализ
Химическая кинетика и катализ Альдегиды
Альдегиды зубные пасты сравнительная характеристика
зубные пасты сравнительная характеристика Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В.
Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В. Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Radiation dosimetry
Radiation dosimetry VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии
VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Ионы. Проверочная работа
Ионы. Проверочная работа