Содержание
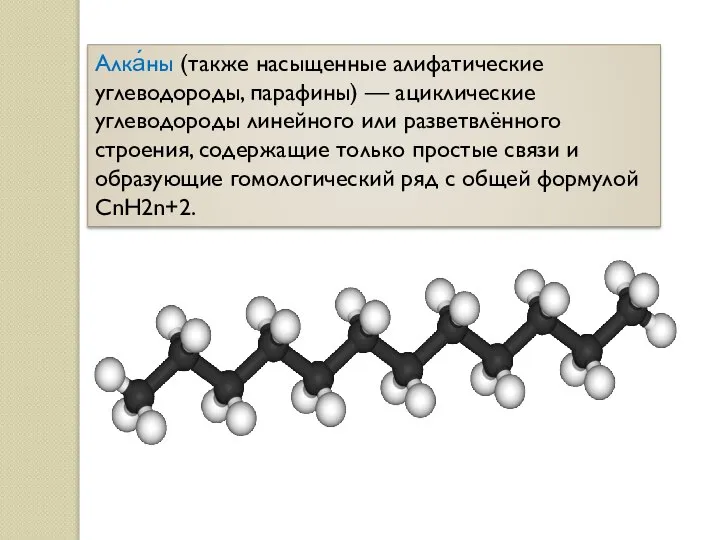
- 2. Алка́ны (также насыщенные алифатические углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые
- 3. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Простейшим представителем класса является метан
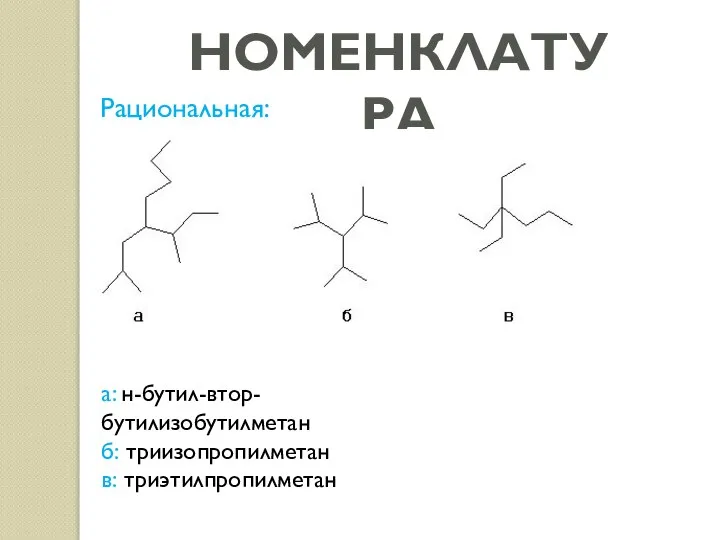
- 4. НОМЕНКЛАТУРА Рациональная: а: н-бутил-втор-бутилизобутилметан б: триизопропилметан в: триэтилпропилметан
- 5. Систематическая ИЮПАК: По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему
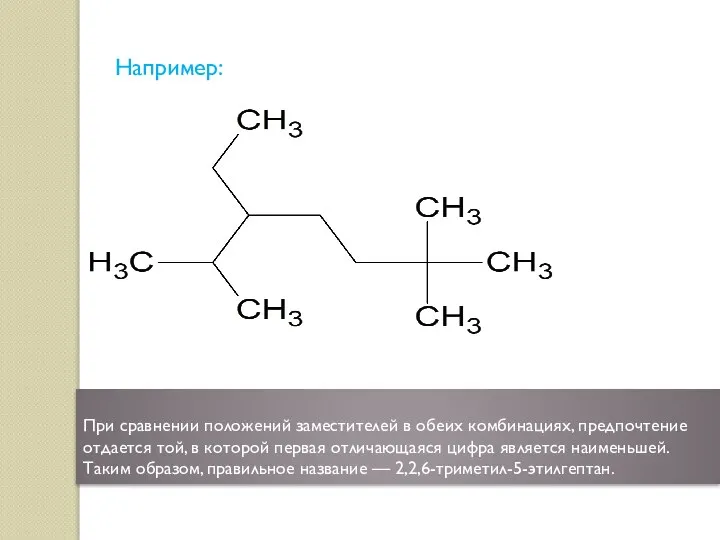
- 6. Например: При сравнении положений заместителей в обеих комбинациях, предпочтение отдается той, в которой первая отличающаяся цифра
- 7. Химические свойства алканов Горение При поджигании на воздухе алканы горят, превращаясь в двуокись углерода и воду
- 8. Химические свойства алканов Реакции замещения - это реакции алканов, идущих с разрывом С_Н связей.
- 9. Галогенирование алканов СН4 + Cl2 hv CH3Cl + HCl Хлорметан, или Хлористый метил СН3 Cl –
- 10. Галогенирование алканов СН3Cl + Cl2 hv CH2Cl2 + HCl Дихлорметан, или хлористый метилен СН2 Cl2 –
- 11. Галогенирование алканов СН2Cl2 + Cl2 hv CHCl3 + HCl Трихлорметан или хлороформ СН Cl3 – хлороформ,
- 12. Галогенирование алканов СНCl3 + Cl2 hv CCl4 + HCl Тетрахлорметан, (четыреххлористый углерод) С Cl4 - применяется
- 13. Нитрование. При нагревании алканов до 140°С с разбавленной (10%-ной) азотной кислотой под давлением осуществляется реакция нитрования
- 14. Изомеризация Под влиянием катализаторов при нагревании углеводороды нормального строения подвергаются изомеризации - перестройке углеродного скелета с
- 15. Реакции разложения При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами
- 16. Крекинг- заводы
- 17. Пиролиз При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды
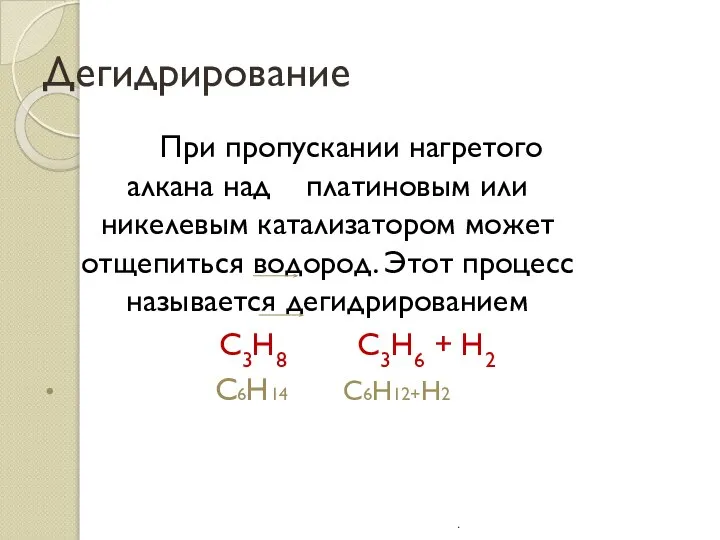
- 18. Дегидрирование При пропускании нагретого алкана над платиновым или никелевым катализатором может отщепиться водород. Этот процесс называется
- 19. Конверсия. СН4+Н2O CO+3H2 Так называют взаимодействия алканов, из которых чаще всего используют природный газ с парами
- 20. Циклоалканы, также полиметиленовые углеводороды[1], нафтены, цикланы, или циклопарафины — циклические насыщенные углеводороды, по химическим свойствам близки
- 21. Виды изомерии: 1)Изомерия углеродного скелета 2)Пространственная 3)Меж классовая изомерия с алкенами
- 22. ФИЗИЧЕСКИЕ СВОЙСТВА При обычных условиях первые два члена ряда (С3 — С4) — газы, (С5 —
- 23. Получение циклоалканов 1. Дегалогенирование дигалогенпроизводных: Br-СН2-СН2-СН2-Br + Mg = циклопропан + MgBr2 2. Гидрирование бензола и
- 24. Химические свойства По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и Циклобутан
- 26. Скачать презентацию














![Циклоалканы, также полиметиленовые углеводороды[1], нафтены, цикланы, или циклопарафины — циклические насыщенные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1382849/slide-19.jpg)




 Химия актиноидов
Химия актиноидов Неоадъювантное лечение II-III стадии HER2-положительного рака молочной железы
Неоадъювантное лечение II-III стадии HER2-положительного рака молочной железы Биохимическая трансформация веществ (3)
Биохимическая трансформация веществ (3) Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева
Значение Периодического закона Д.И. Менделеева. Жизнь Д.И. Менделеева Презентация по Химии "Алотропія карбону" - скачать смотреть
Презентация по Химии "Алотропія карбону" - скачать смотреть  PSKhE
PSKhE Неорганические вещества клетки
Неорганические вещества клетки Кальций хлорид
Кальций хлорид  Явление изоморфизма в геохимии
Явление изоморфизма в геохимии Уравнение состояния идеального газа. Решение задач
Уравнение состояния идеального газа. Решение задач Установка кристаллов
Установка кристаллов Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Фосфор красный, белый и черный
Фосфор красный, белый и черный Органика в ЕГЭ (В,С)
Органика в ЕГЭ (В,С) Презентация Оксиды углерода
Презентация Оксиды углерода Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Презентация по Химии "Малахіт" - скачать смотреть
Презентация по Химии "Малахіт" - скачать смотреть  Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Комплексные соединения
Комплексные соединения Виды парфюмерно-косметической косметики
Виды парфюмерно-косметической косметики Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Образовательная программа дополнительного образования Химия в центре наук
Образовательная программа дополнительного образования Химия в центре наук Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв
Вода Основні забруднювачі: нафтопродукти; пестициди, синтетичні миючі засоби; кислоти, луги, мінеральні солі; відходи тв Вплив хімічних сполук на довкілля і здоров'я людини
Вплив хімічних сполук на довкілля і здоров'я людини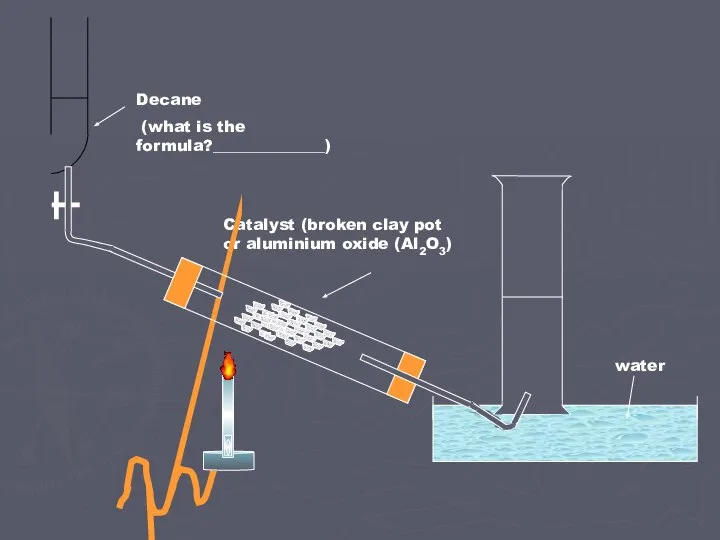 Addition reactions
Addition reactions Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Бензол: строение и свойства
Бензол: строение и свойства Золото ЗОЛОТО Au (читается «аурум»), химический элемент с атомным номером 79, атомная масса 196,9665. Известно с глубокой древности. В при
Золото ЗОЛОТО Au (читается «аурум»), химический элемент с атомным номером 79, атомная масса 196,9665. Известно с глубокой древности. В при