Содержание
- 2. Физические свойства Серная кислота (H2 SO4) самая дешевая из кислот, она не дымит, не имеет запаха.
- 3. В технике под серной кислотой подразумеваются любые смеси триоксида серы с водой: mSO3 + nH2O =
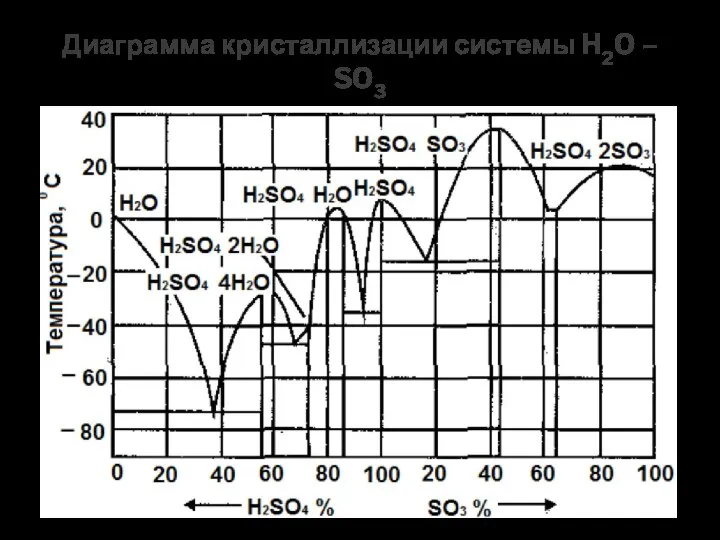
- 4. Диаграмма кристаллизации системы H2O – SO3
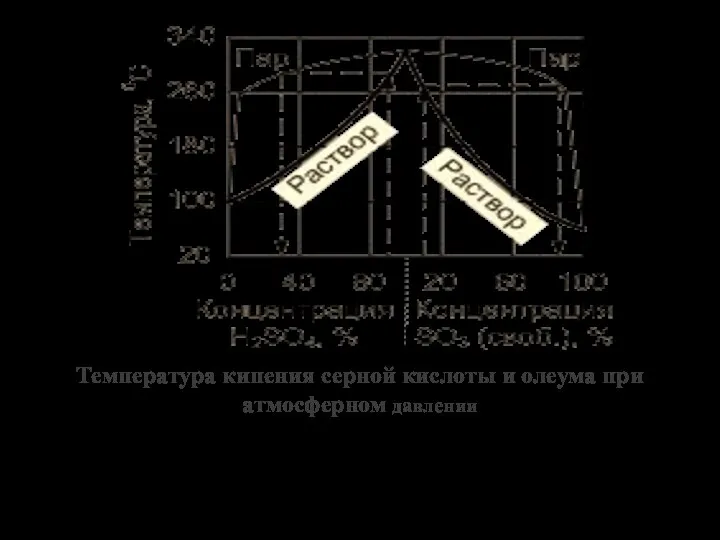
- 5. Температура кипения серной кислоты и олеума при атмосферном давлении
- 6. Химические свойства 1. В водном растворе серная кислота диссоциирует H2SO4 = 2H+ + SO4−2. 2. Взаимодействие
- 7. Концентрированная серная кислота является сильным окислителем: при взаимодействии с металлами (кроме Au, Pt) она восстанавливается до
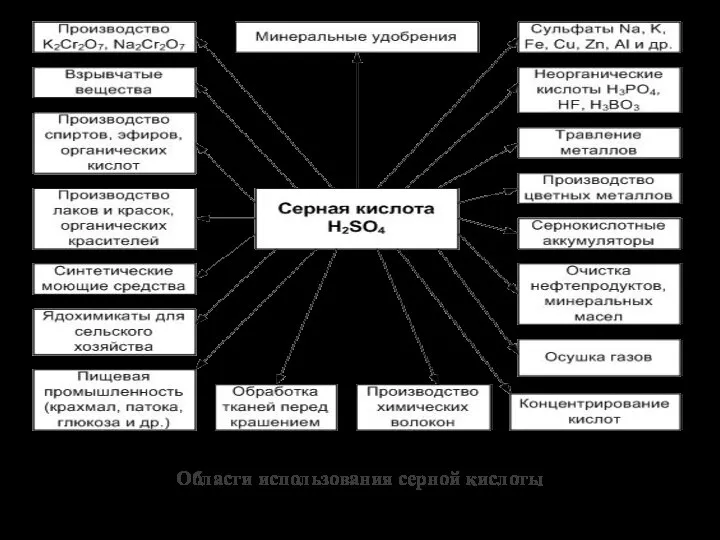
- 8. Области использования серной кислоты
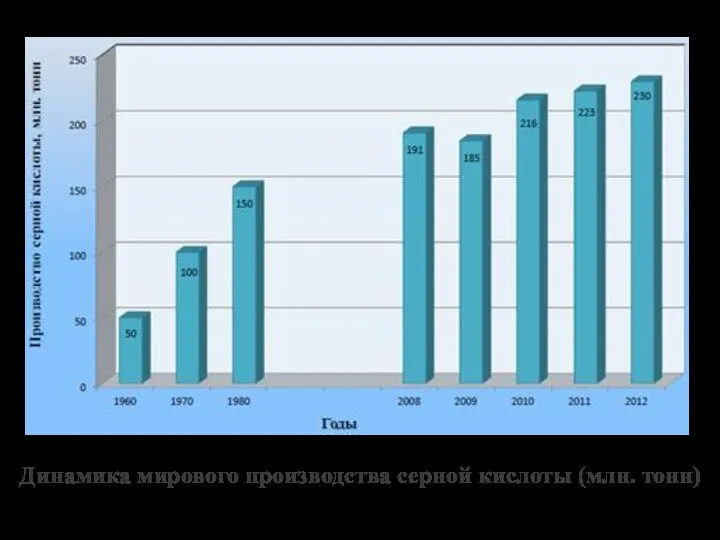
- 9. Динамика мирового производства серной кислоты (млн. тонн)
- 10. 3 основных стадии производства серной кислоты: получение диоксида серы SO2; окисление SO2 кислородом в триоксид SO3:
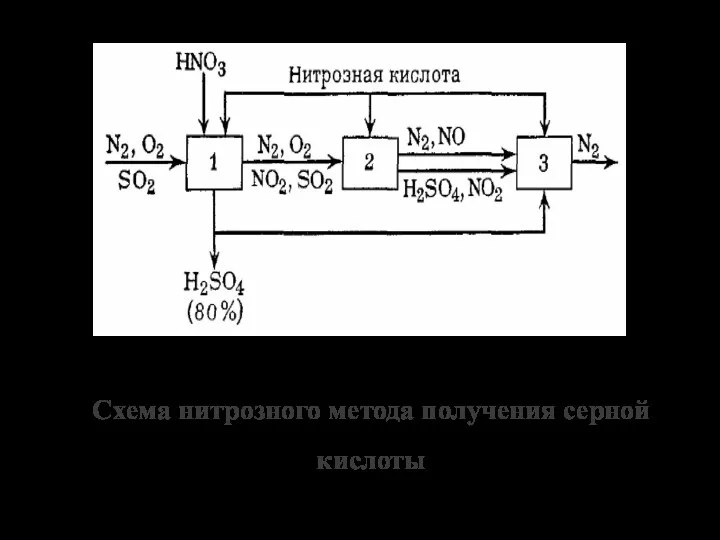
- 11. Схема нитрозного метода получения серной кислоты
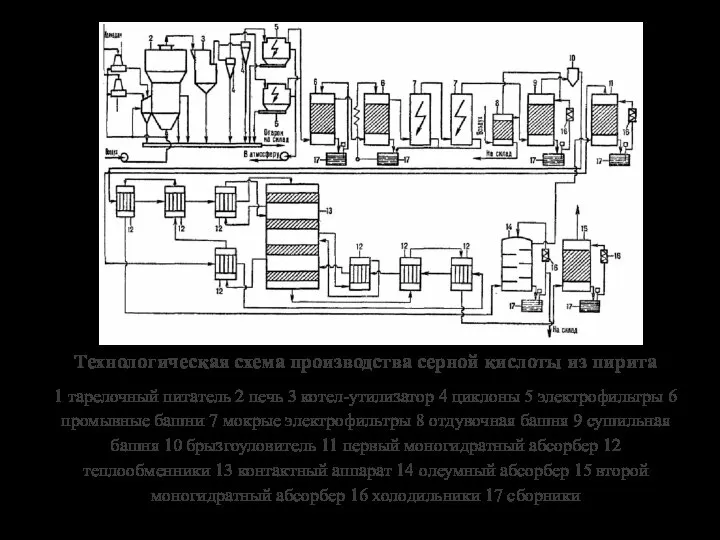
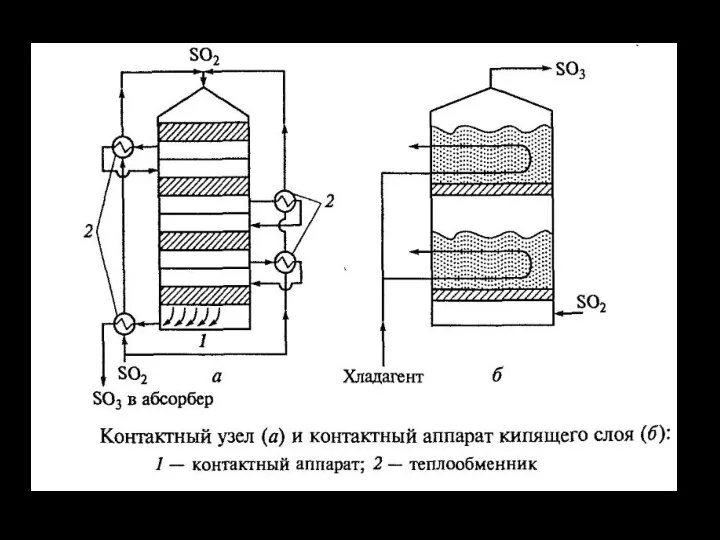
- 12. Технологическая схема производства серной кислоты из пирита 1 тарелочный питатель 2 печь 3 котел-утилизатор 4 циклоны
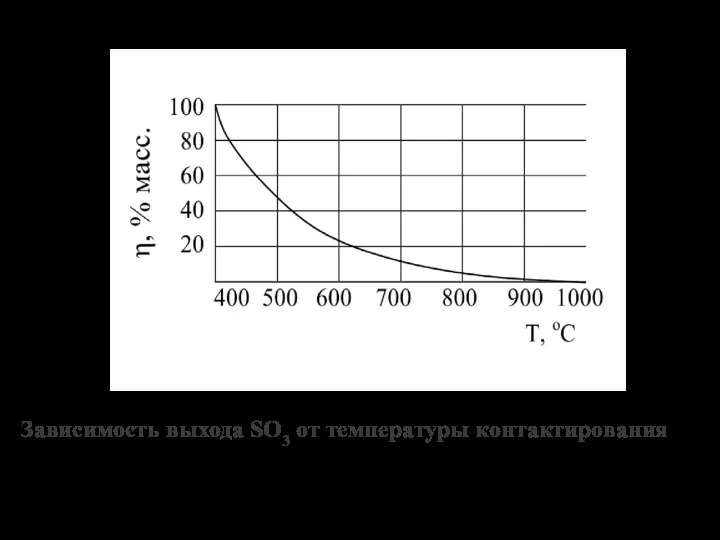
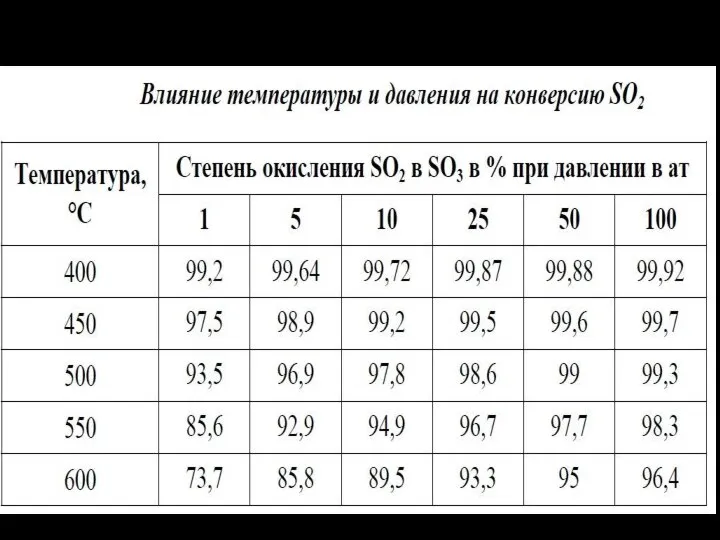
- 13. Зависимость выхода SO3 от температуры контактирования
- 15. Процесс катализа состоит из нескольких последовательно стадий: перенос молекул кислорода и диоксида серы к катализатору диффузия
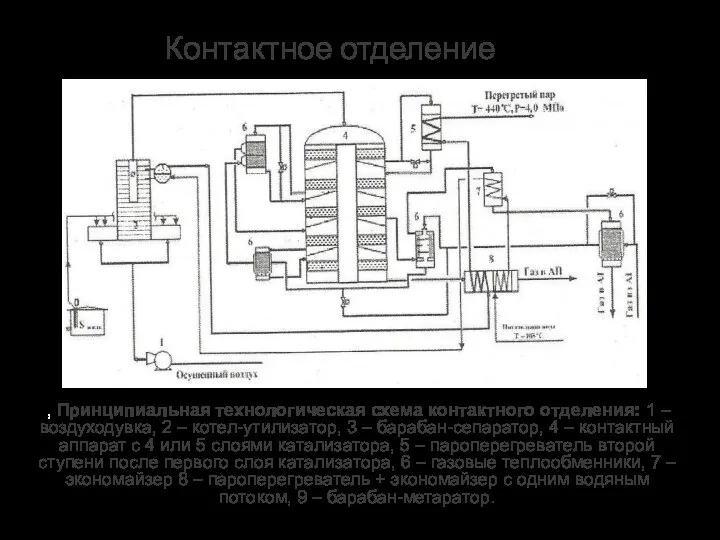
- 17. Контактное отделение , Принципиальная технологическая схема контактного отделения: 1 – воздуходувка, 2 – котел-утилизатор, 3 –
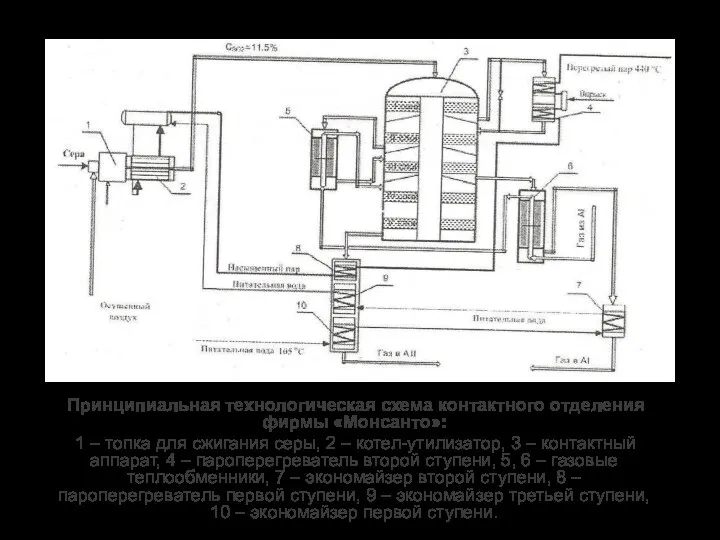
- 18. Принципиальная технологическая схема контактного отделения фирмы «Монсанто»: 1 – топка для сжигания серы, 2 – котел-утилизатор,
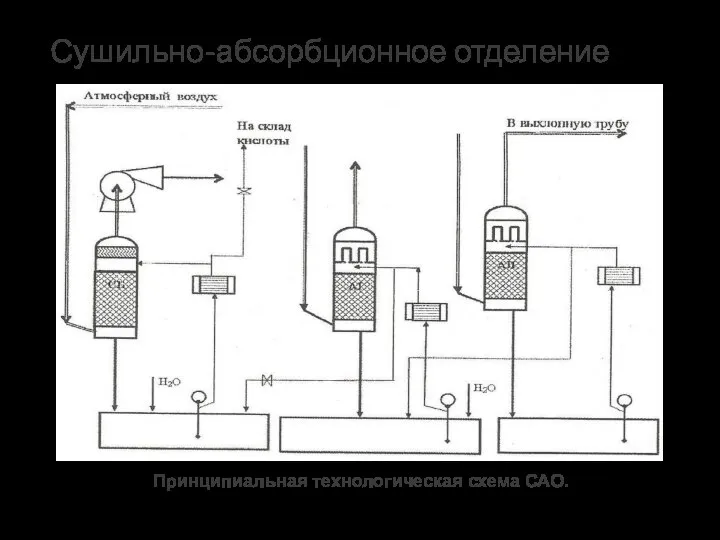
- 19. Сушильно-абсорбционное отделение Принципиальная технологическая схема САО.
- 20. Использование тепла абсорбции. Использование тепла абсорбции позволило бы: снизить расход электроэнергии за счет снижения расхода оборотной
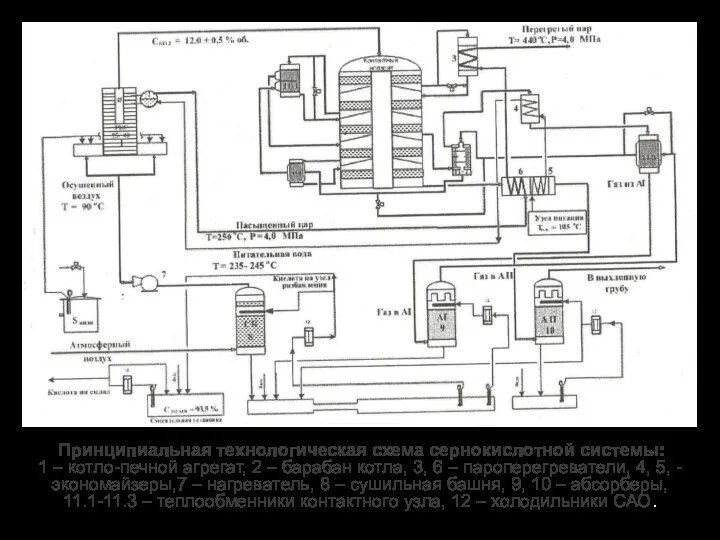
- 21. Принципиальная технологическая схема сернокислотной системы: 1 – котло-печной агрегат, 2 – барабан котла, 3, 6 –
- 23. Скачать презентацию







 Химические реакции
Химические реакции Химические аспекты выбора полимеров-предшественников для получения углеродных волокон
Химические аспекты выбора полимеров-предшественников для получения углеродных волокон Физико-химические основы разделения горючих ископаемых и продуктов их переработки. Хроматография
Физико-химические основы разделения горючих ископаемых и продуктов их переработки. Хроматография Презентация по химии Типы химической связи
Презентация по химии Типы химической связи  Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока
Вторичное квантование. Применение оболочечной модели. Метод Хартри - Фока Поверхностные явления и дисперсные системы (коллоидная химия)
Поверхностные явления и дисперсные системы (коллоидная химия) Презентация по Химии "Презентация Медь" - скачать смотреть
Презентация по Химии "Презентация Медь" - скачать смотреть  Жидкостная хроматография
Жидкостная хроматография Жидкостная хроматография
Жидкостная хроматография Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Стеклообразное состояние полимеров. (Лекция 5)
Стеклообразное состояние полимеров. (Лекция 5) Закономерности управления каталитическими процессами. Упрощенный вариант
Закономерности управления каталитическими процессами. Упрощенный вариант Пищевые кислоты
Пищевые кислоты Хлороформ. Методы его изолирования и обнаружения
Хлороформ. Методы его изолирования и обнаружения Всасывание продуктов гидролиза липидов в тонком кишечнике. Ресинтез жиров. Образование смешанных мицелл
Всасывание продуктов гидролиза липидов в тонком кишечнике. Ресинтез жиров. Образование смешанных мицелл Презентация по Химии "Менделеев" - скачать смотреть бесплатно
Презентация по Химии "Менделеев" - скачать смотреть бесплатно Соединения химических элементов
Соединения химических элементов Органічна хімія
Органічна хімія Почему протекают химические реакции
Почему протекают химические реакции Składniki odżywcze
Składniki odżywcze Химические волокна
Химические волокна Нейрофизиология. Мембранный потенциал покоя и потенциал действия
Нейрофизиология. Мембранный потенциал покоя и потенциал действия Закономерности в таблице Д. И. Менделеева
Закономерности в таблице Д. И. Менделеева Производные индола
Производные индола Ковалентная химическая связь
Ковалентная химическая связь Застосування неметалів
Застосування неметалів Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф
Поняття про лікарські препарати Підготували Стебко Марія, Бондар Аліна 11-Ф  Презентация по Химии "Кислотные дожди" - скачать смотреть
Презентация по Химии "Кислотные дожди" - скачать смотреть