Содержание
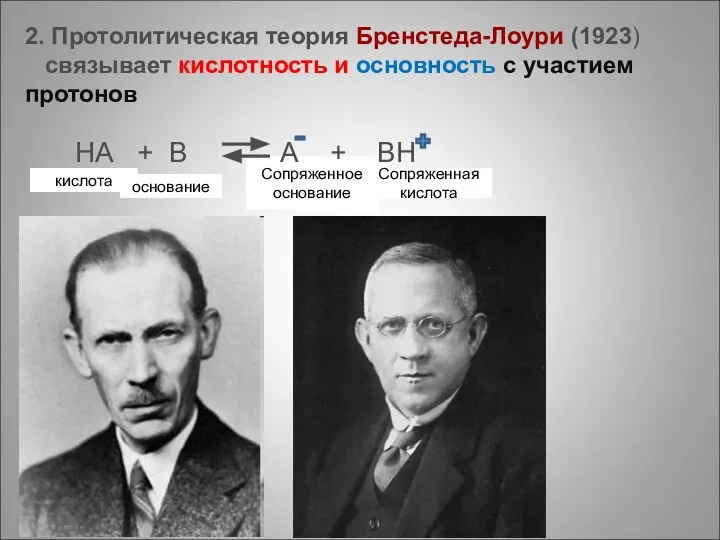
- 3. кислота основание Сопряженное основание Сопряженная кислота 2. Протолитическая теория Бренстеда-Лоури (1923) связывает кислотность и основность с
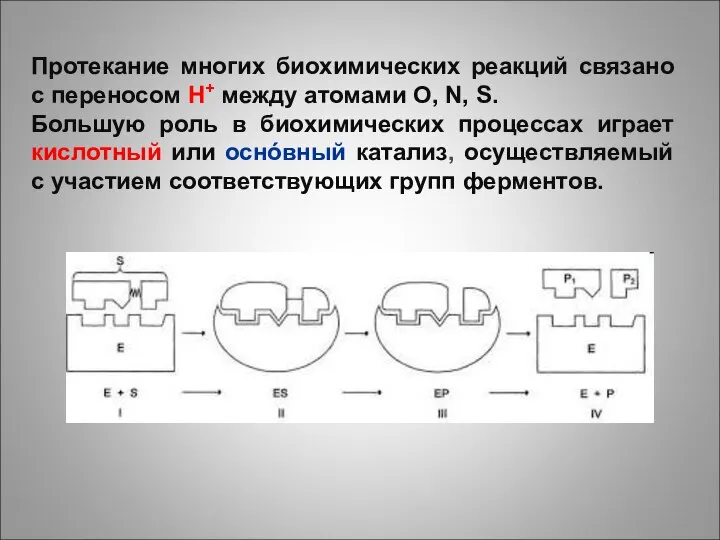
- 4. Протекание многих биохимических реакций связано с переносом H+ между атомами O, N, S. Большую роль в
- 5. Кислоты Бренстеда Кислота Бренстеда – вещество, способное отдавать протоны, т.е. донор H+. В зависимости от природы
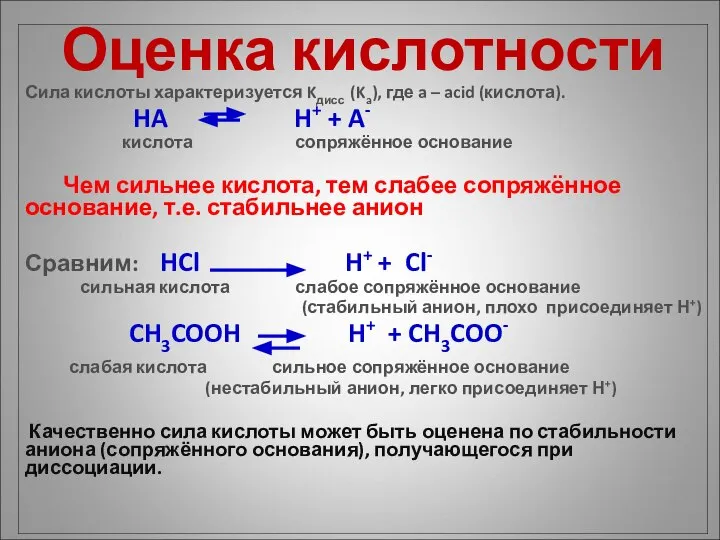
- 6. Оценка кислотности Сила кислоты характеризуется Kдисс (Ka), где a – acid (кислота). HA H+ + A-
- 7. Факторы, определяющие кислотность (стабильность аниона) 1. Влияние электроотрицательности (ЭО) атома в кислотном центре Чем больше ЭО,
- 8. Влияние ЭО СН3–СН3 НСΞСН pKа=50-60 pKa=22 ЭО С(sp) > ЭО С(sp3), поэтому С2Н2 проявляет кислотные свойства,
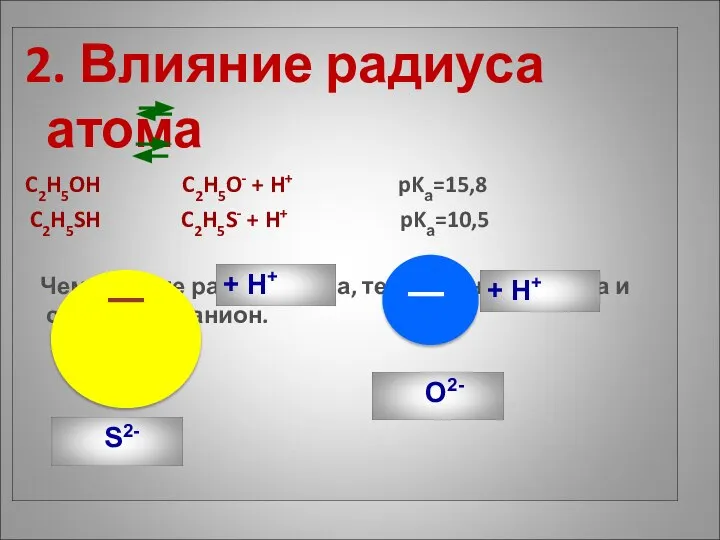
- 9. 2. Влияние радиуса атома C2H5OH C2H5O- + H+ pKа=15,8 C2H5SH C2H5S- + H+ pKа=10,5 Чем больше
- 10. 3. Влияние заместителей C2H5OH C2H5O- + H+ pKа=15,8 CBr3CH2OH CBr3CH2O- + H+ pKа=12,4 нарколан CF3 -
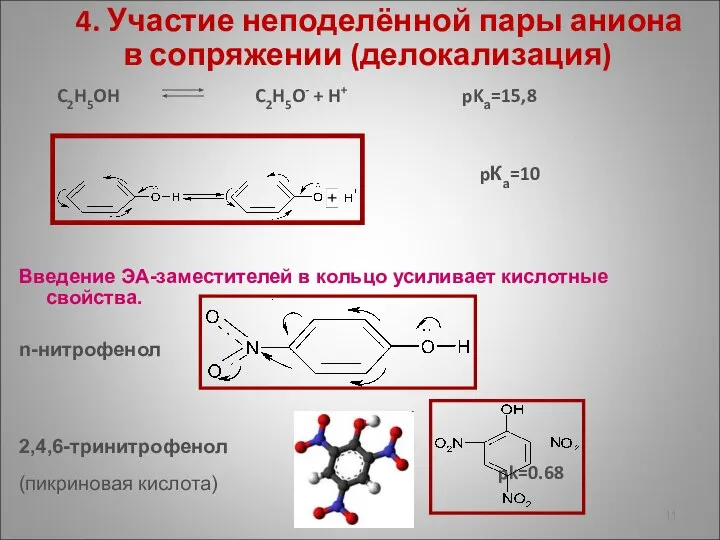
- 11. 4. Участие неподелённой пары аниона в сопряжении (делокализация) C2H5OH C2H5O- + H+ pKа=15,8 pКа=10 Введение ЭА-заместителей
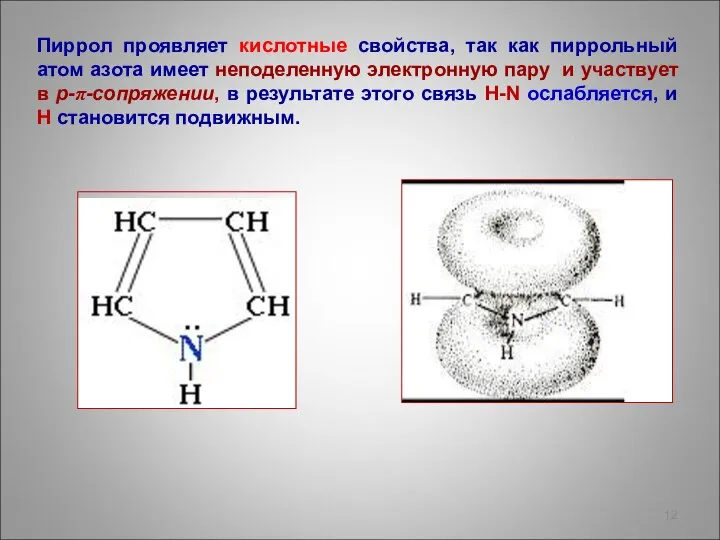
- 12. Пиррол проявляет кислотные свойства, так как пиррольный атом азота имеет неподеленную электронную пару и участвует в
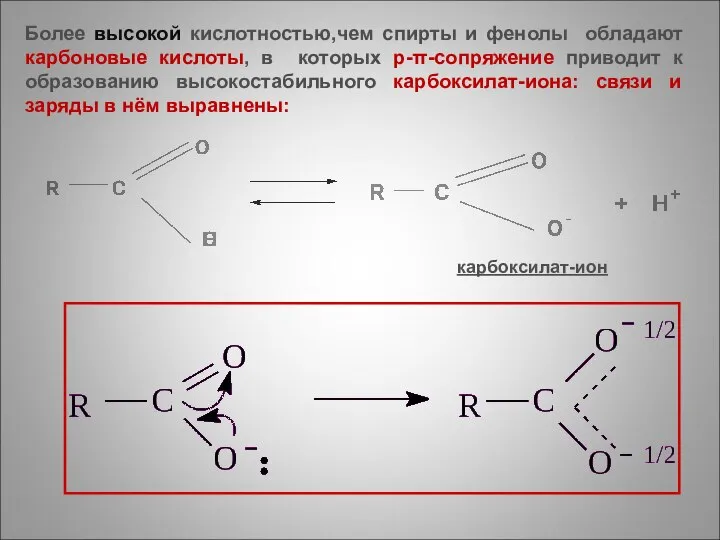
- 13. карбоксилат-ион Более высокой кислотностью,чем спирты и фенолы обладают карбоновые кислоты, в которых р-π-сопряжение приводит к образованию
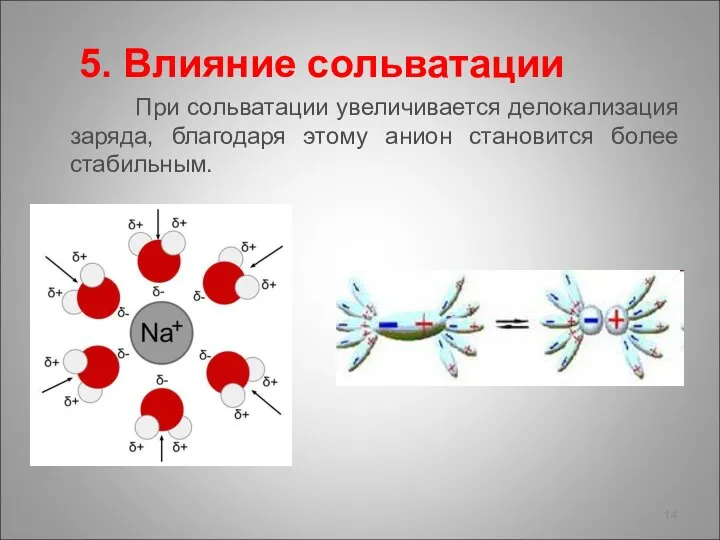
- 14. 5. Влияние сольватации При сольватации увеличивается делокализация заряда, благодаря этому анион становится более стабильным.
- 15. Кислотные свойства спиртов, фенолов, тиолов Спирт можно рассматривать как углеводород, в котором один или более атомов
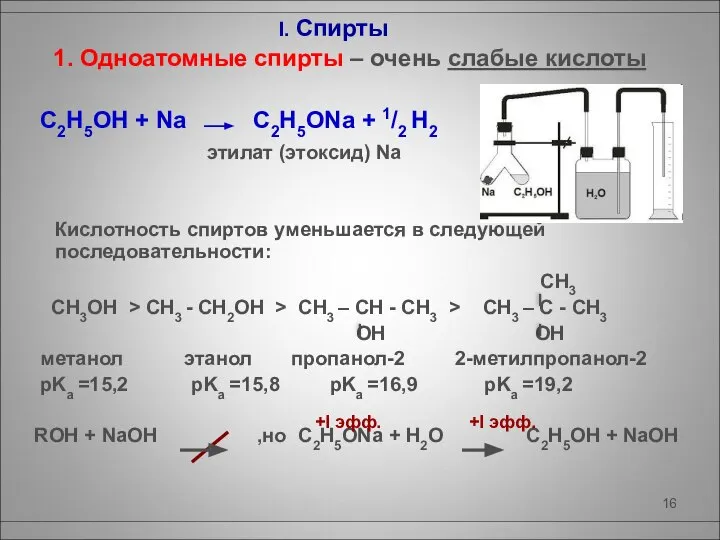
- 16. I. Спирты 1. Одноатомные спирты – очень слабые кислоты C2H5OH + Na C2H5ONa + 1/2 H2
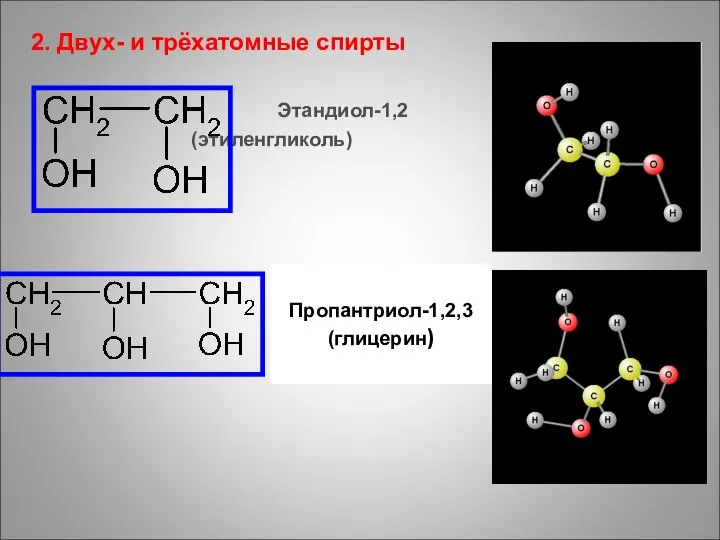
- 17. 2. Двух- и трёхатомные спирты Этандиол-1,2 (этиленгликоль) Пропантриол-1,2,3 (глицерин)
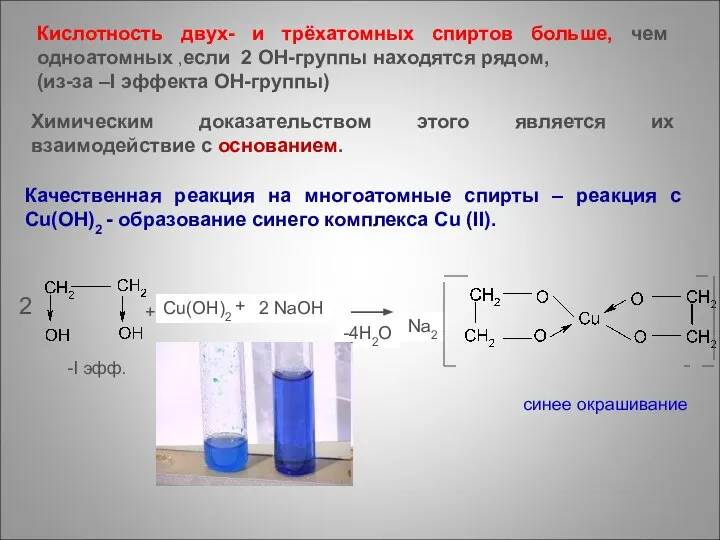
- 18. + Cu(OH)2 + 2 NaOH 2 -I эфф. -4H2O Na2 синее окрашивание Кислотность двух- и трёхатомных
- 19. Многоатомные спирты Накопление ОН-групп ведет к появлению сладкого вкуса: гексангексаол-1,2,3,4,5,6 (сорбит) пентанпентаол-1,2,3,4,5 (ксилит) Ксилит и сорбит
- 20. Многоатомный циклический спирт-Инозит циклогексангексаол - шестиатомный спирт. Из 9-и возможных стереоизомеров инозита свойствами витамина обладает только
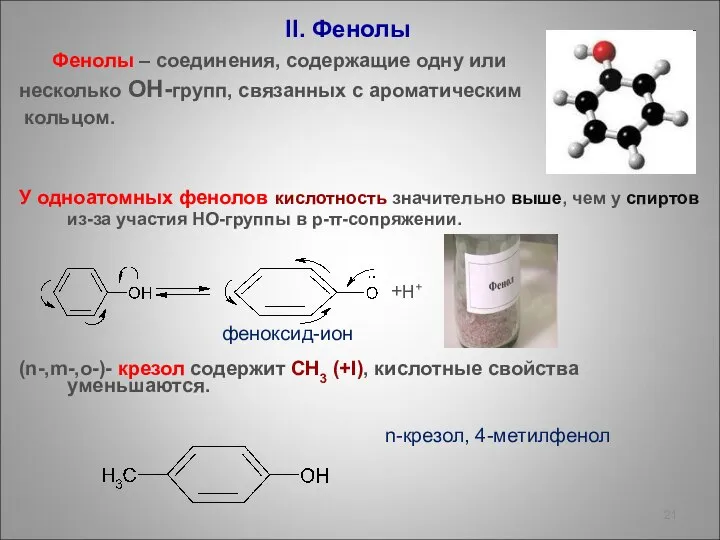
- 21. II. Фенолы Фенолы – соединения, содержащие одну или несколько ОН-групп, связанных с ароматическим кольцом. У одноатомных
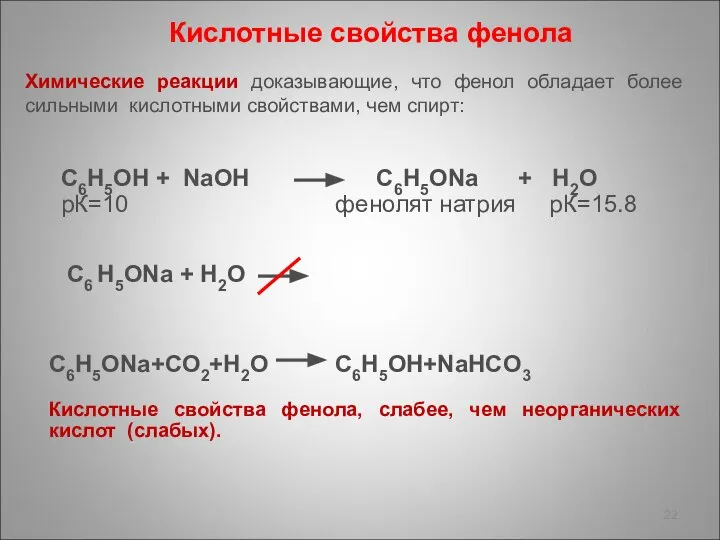
- 22. Химические реакции доказывающие, что фенол обладает более сильными кислотными свойствами, чем спирт: Кислотные свойства фенола C6H5ONa+CO2+H2O
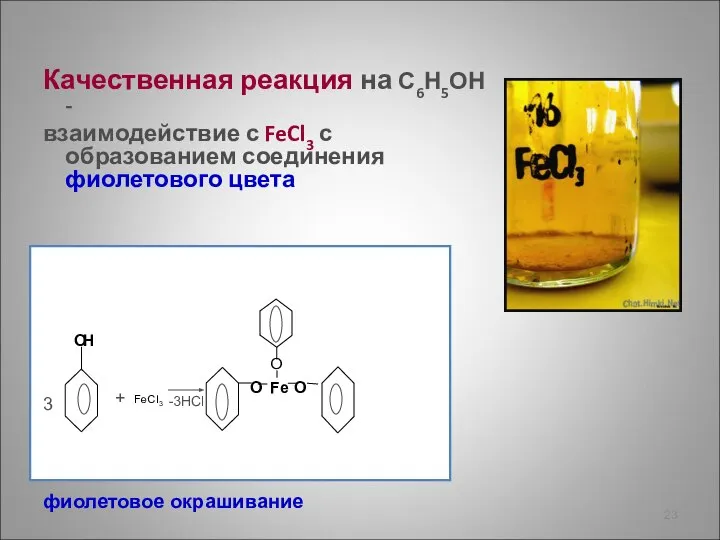
- 23. Качественная реакция на С6Н5ОН - взаимодействие с FeCl3 с образованием соединения фиолетового цвета + -3HCl 3
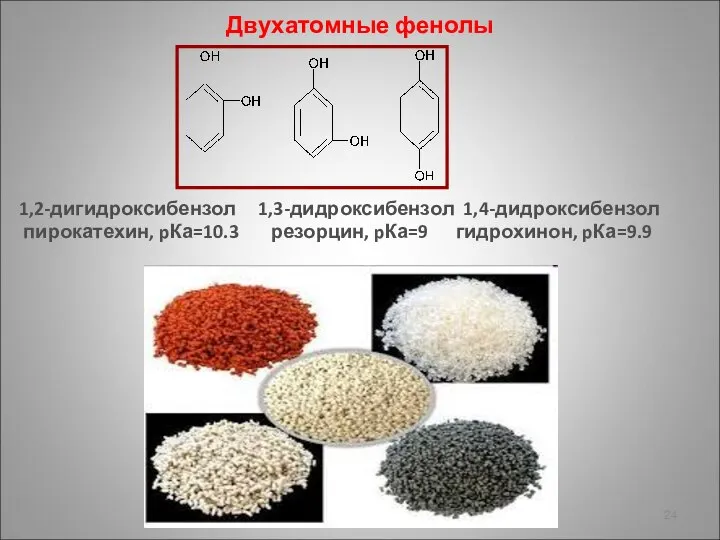
- 24. Двухатомные фенолы 1,2-дигидроксибензол 1,3-дидроксибензол 1,4-дидроксибензол пирокатехин, pКа=10.3 резорцин, pКа=9 гидрохинон, pКа=9.9
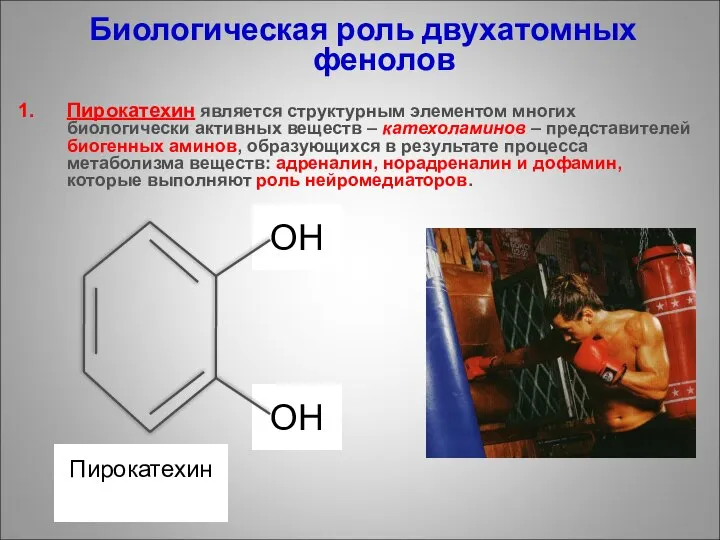
- 25. ОН ОН Биологическая роль двухатомных фенолов Пирокатехин является структурным элементом многих биологически активных веществ – катехоламинов
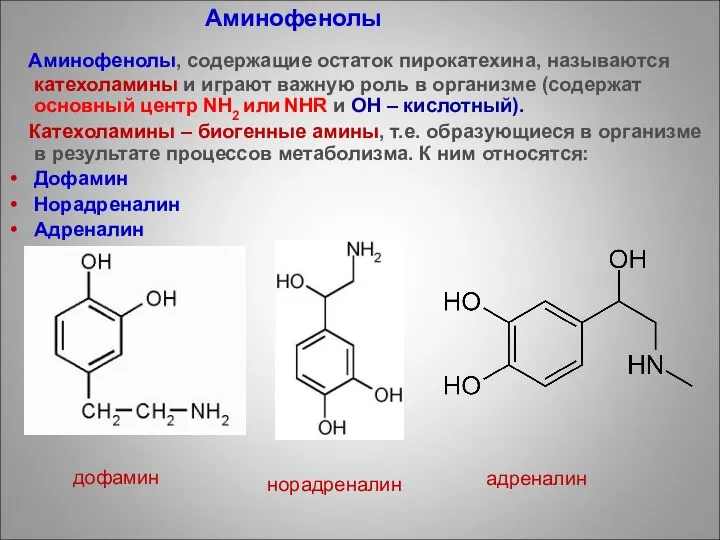
- 26. Адреналин – гормон мозгового вещества надпочечников, гормон страха. С Биологической активностью обладает лишь L-изомер, тогда как
- 27. Резорцин используется в составе мазей или примочек при кожных заболеваниях.
- 28. Норадреналин – предшественники адреналина Дофамин - гормон целеустремленности и концентрации
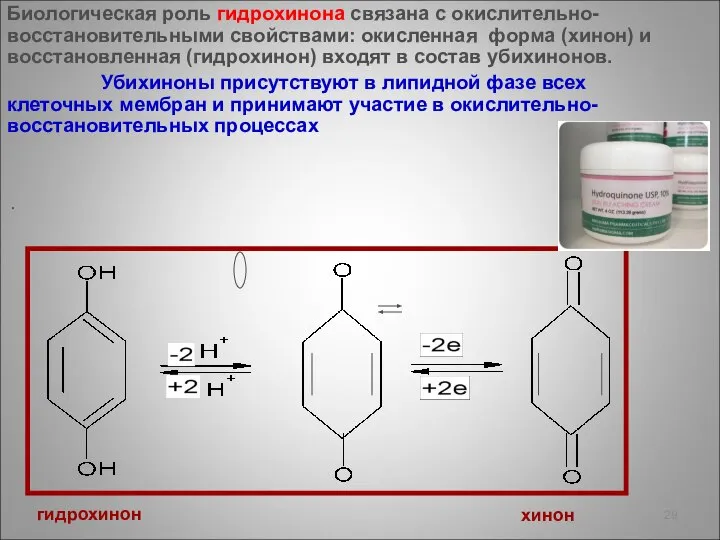
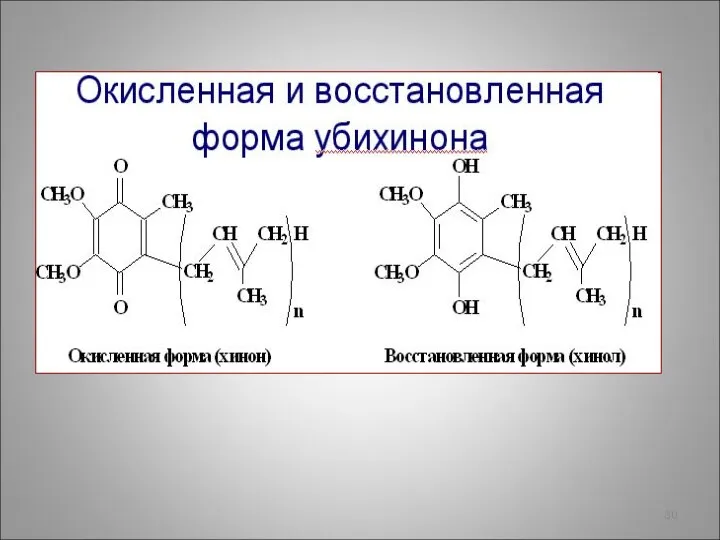
- 29. Биологическая роль гидрохинона связана с окислительно-восстановительными свойствами: окисленная форма (хинон) и восстановленная (гидрохинон) входят в состав
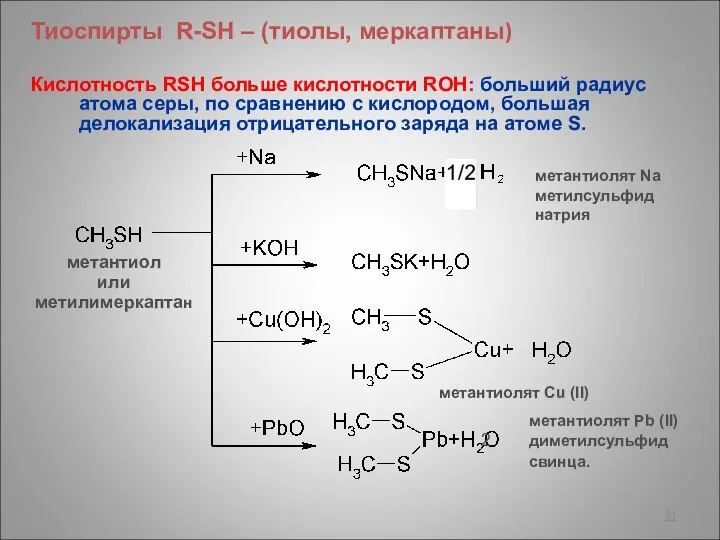
- 31. Тиоспирты R-SH – (тиолы, меркаптаны) Кислотность RSH больше кислотности ROH: больший радиус атома серы, по сравнению
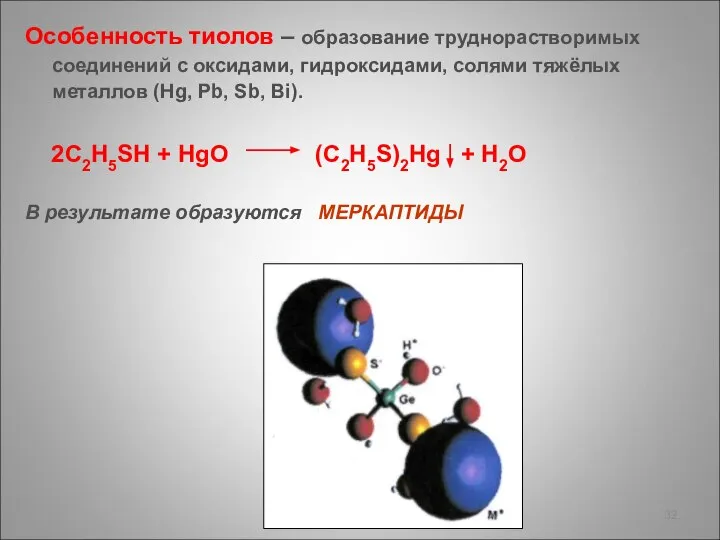
- 32. Особенность тиолов – образование труднорастворимых соединений с оксидами, гидроксидами, солями тяжёлых металлов (Hg, Pb, Sb, Bi).
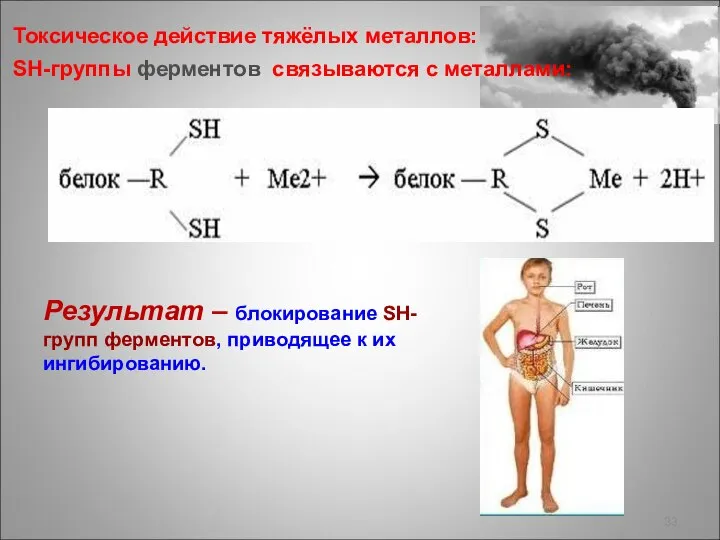
- 33. Токсическое действие тяжёлых металлов: SH-группы ферментов cвязываются с металлами: Результат – блокирование SH-групп ферментов, приводящее к
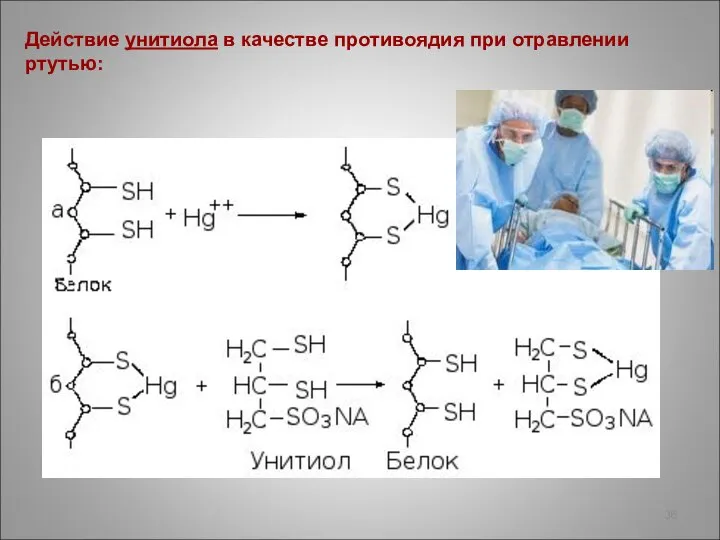
- 34. Антидоты – противоядия – содержат несколько HS-групп, образующих более прочные растворимые комплексы с тяжёлыми металлами, связывают
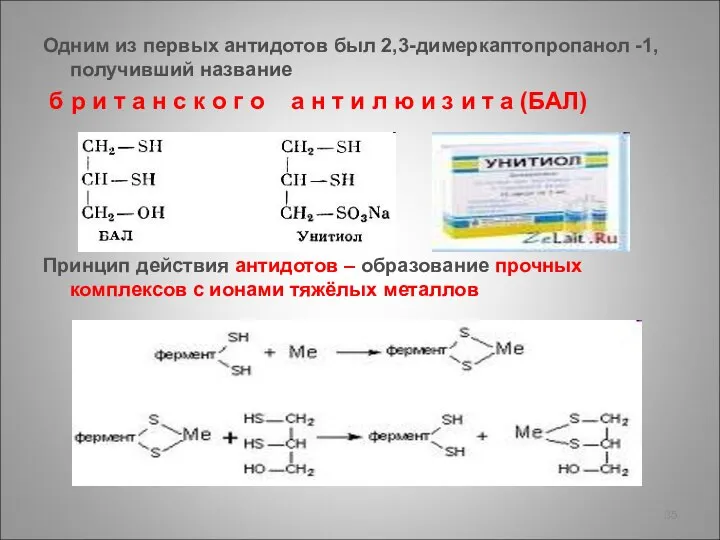
- 35. Одним из первых антидотов был 2,3-димеркаптопропанол -1, получивший название б р и т а н с
- 36. Действие унитиола в качестве противоядия при отравлении ртутью:
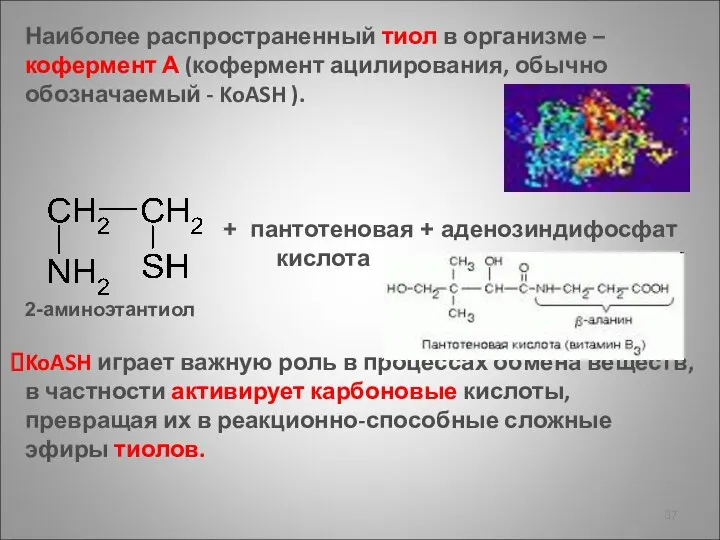
- 37. Наиболее распространенный тиол в организме – кофермент А (кофермент ацилирования, обычно обозначаемый - KoASH ). KoASH
- 38. РЕАКЦИИ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ SN И ЭЛИМИНИРОВАНИЯ E
- 39. Для спиртов характерны: 1) кислотные свойства; R – O – H 2) реакции нуклеофильного замещения SN;
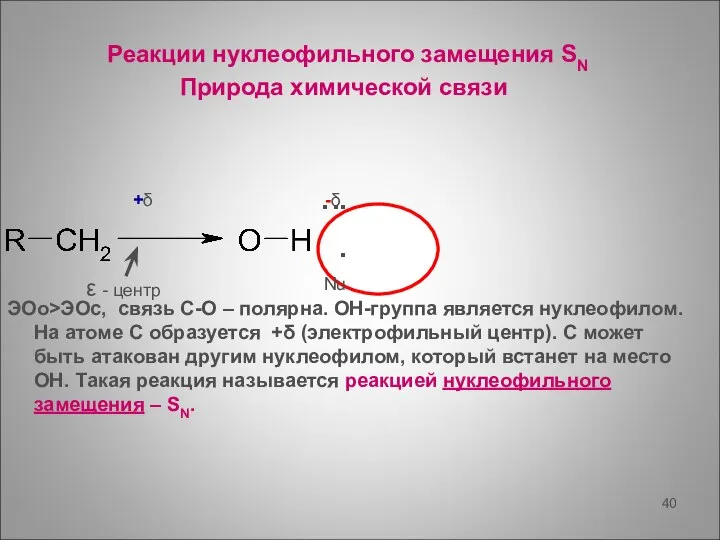
- 40. Реакции нуклеофильного замещения SN Природа химической связи ЭОо>ЭОс, связь С-О – полярна. ОН-группа является нуклеофилом. На
- 41. Реакции SN Реакции нуклеофильного замещения SN характерны для соединений, содержащих нуклеофил, связанный с sp3-гибридным атомом С.
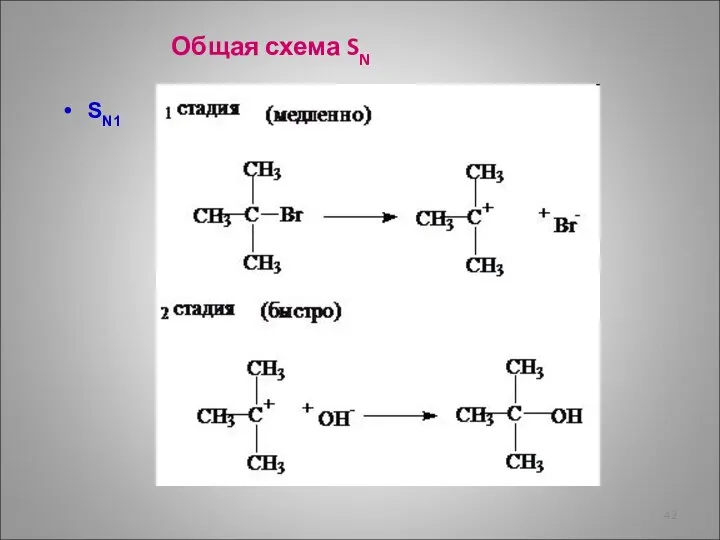
- 42. SN1 Общая схема SN
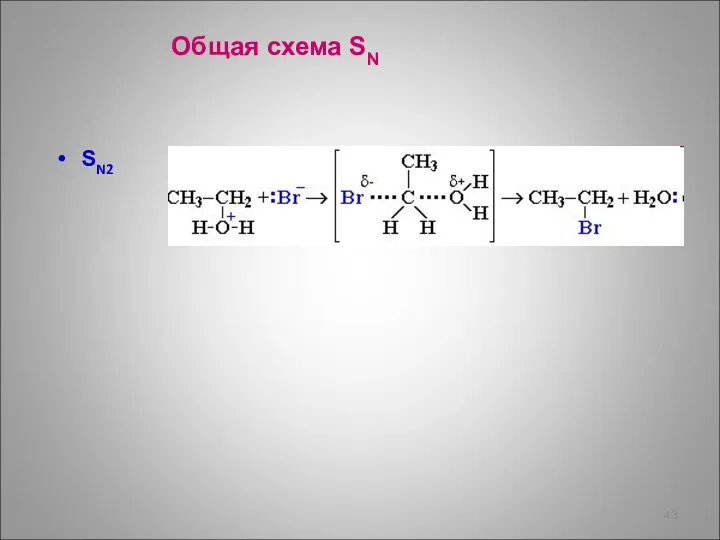
- 43. SN2 Общая схема SN
- 44. Уходящий анион должен быть более устойчивым, чем атакующий. Самые стабильные анионы – галогениды (Hal-): Cl-, Br-,
- 45. Для протекания реакции SN необходимо из плохо уходящей группы создать хорошо уходящую. Это делается с помощью
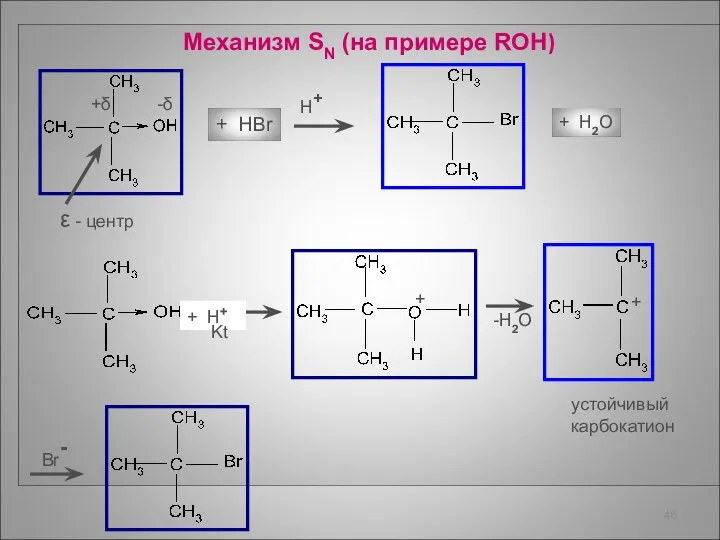
- 46. Механизм SN (на примере ROH) +δ -δ ε - центр + HBr H+ + H2O +
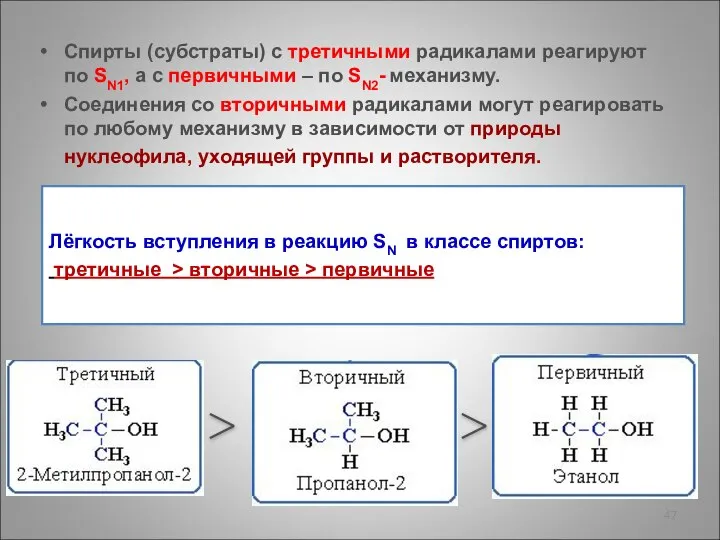
- 47. Спирты (субстраты) с третичными радикалами реагируют по SN1, а с первичными – по SN2- механизму. Соединения
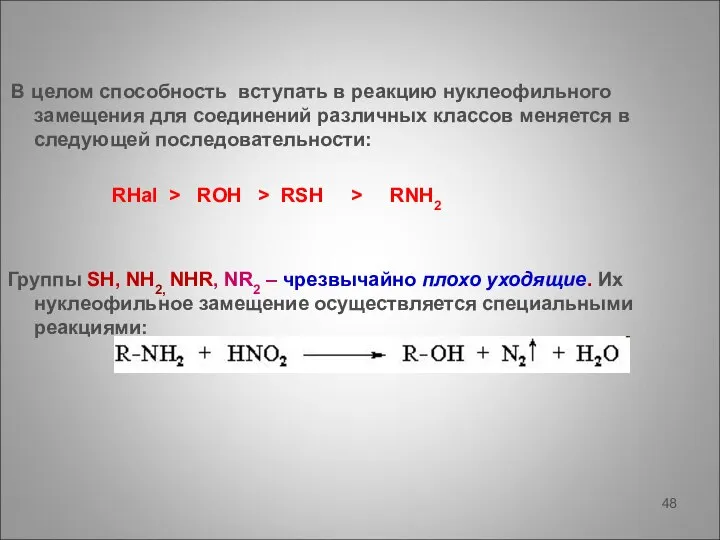
- 48. В целом способность вступать в реакцию нуклеофильного замещения для соединений различных классов меняется в следующей последовательности:
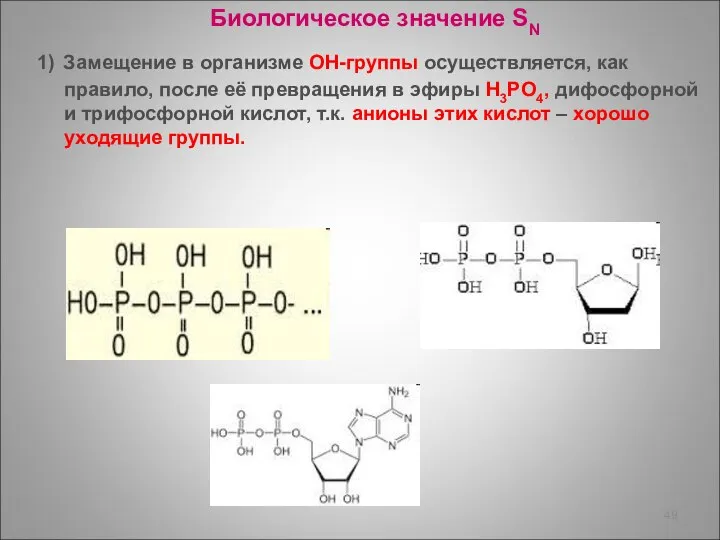
- 49. Биологическое значение SN 1) Замещение в организме ОН-группы осуществляется, как правило, после её превращения в эфиры
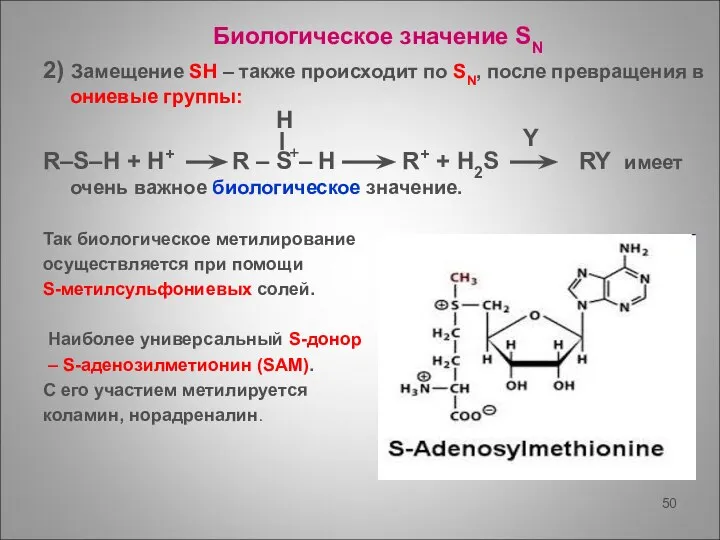
- 50. Биологическое значение SN 2) Замещение SH – также происходит по SN, после превращения в ониевые группы:
- 51. Реакции Е (элиминирования) Реакции нуклеофильного замещения SN и элиминирования Е – конкурентные реакции. В зависимости от
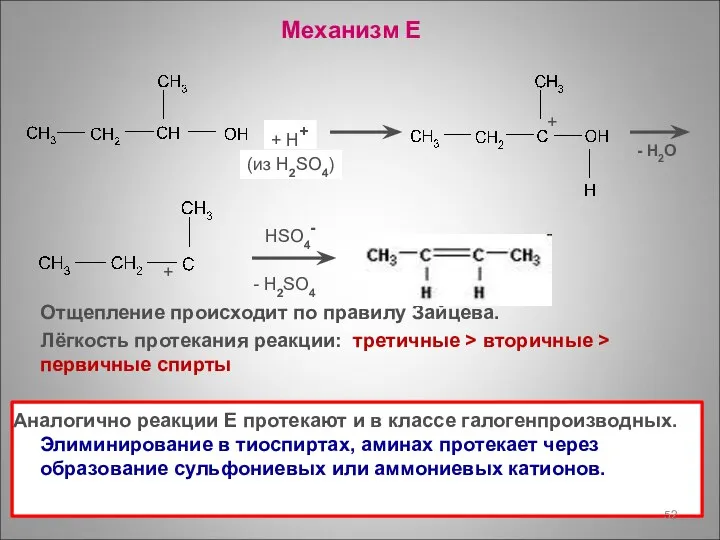
- 52. Механизм Е Отщепление происходит по правилу Зайцева. Лёгкость протекания реакции: третичные > вторичные > первичные спирты
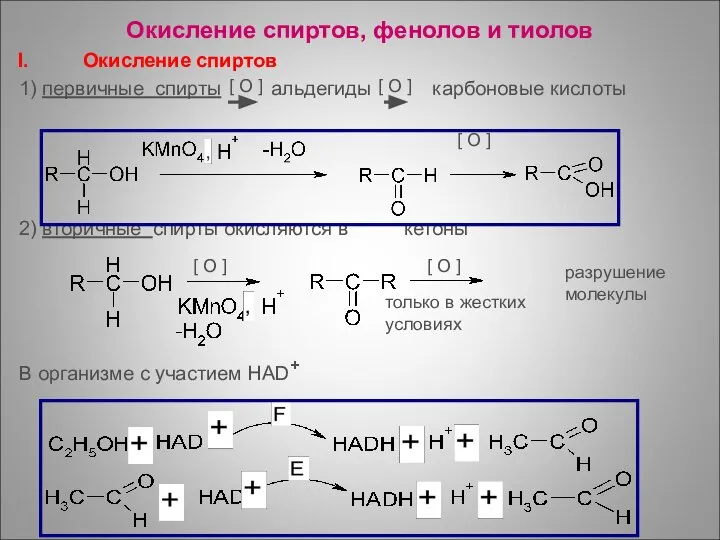
- 53. Окисление спиртов, фенолов и тиолов Окисление спиртов 1) первичные спирты альдегиды карбоновые кислоты 2) вторичные спирты
- 54. Многоатомные спирты карбоновые кислоты или оксокислоты. Окисление фенолов [ O ] О О О О -2e
- 55. IV. Окисление S-H. В организме под влиянием ферментов: S–H - S – S – Eсв S-H
- 56. Основность органических соединений. Биологически важные реакции аминов.
- 57. Основания Бренстеда Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протоны (акцепторы Н+). а) π-основания:
- 58. Факторы, влияющие на основность а) ЭO атома в основном центре Чем меньше ЭО, тем сильнее основность
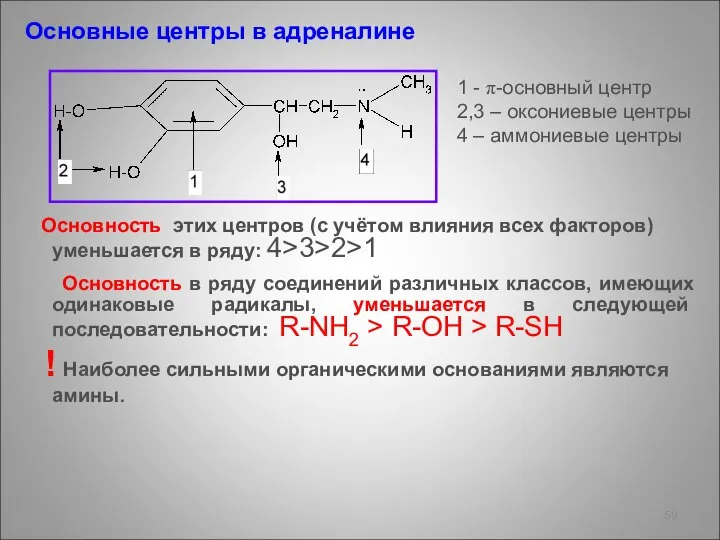
- 59. Основные центры в адреналине Основность этих центров (с учётом влияния всех факторов) уменьшается в ряду: 4>3>2>1
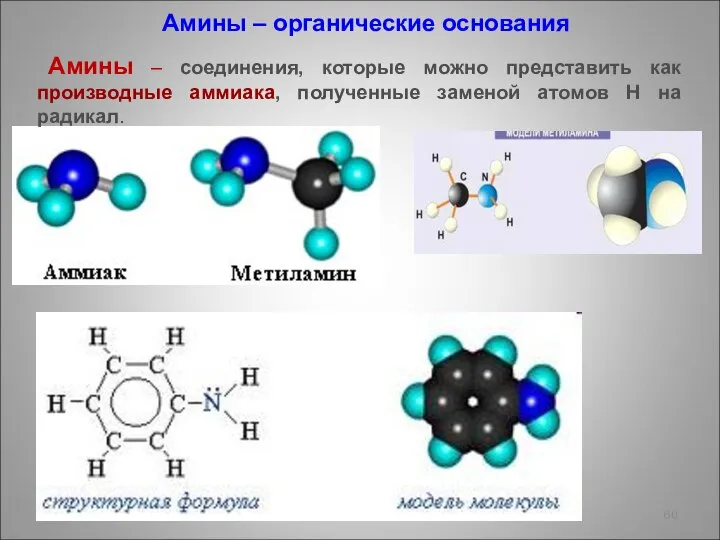
- 60. Амины – органические основания Амины – соединения, которые можно представить как производные аммиака, полученные заменой атомов
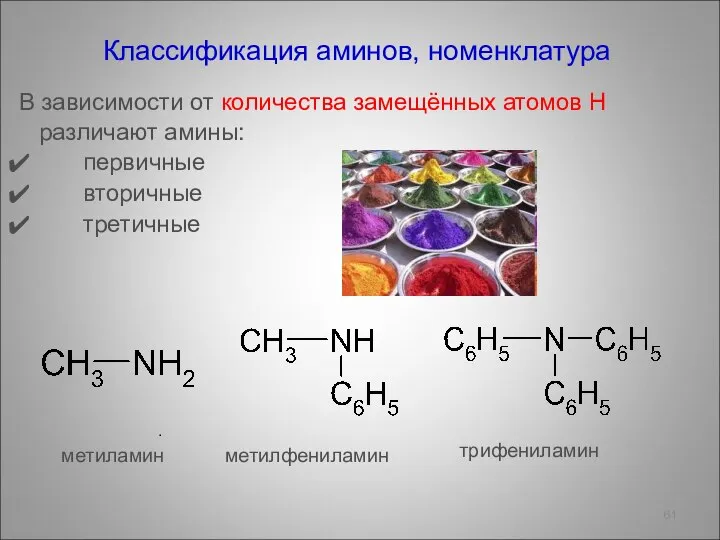
- 61. Классификация аминов, номенклатура В зависимости от количества замещённых атомов Н различают амины: первичные вторичные третичные .
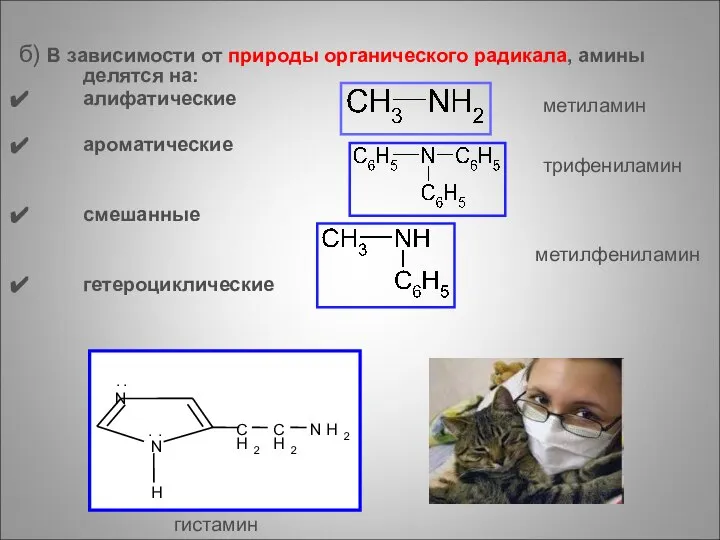
- 62. б) В зависимости от природы органического радикала, амины делятся на: алифатические ароматические смешанные гетероциклические N N
- 63. Анилин – простейший представитель первичных ароматических аминов бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде,
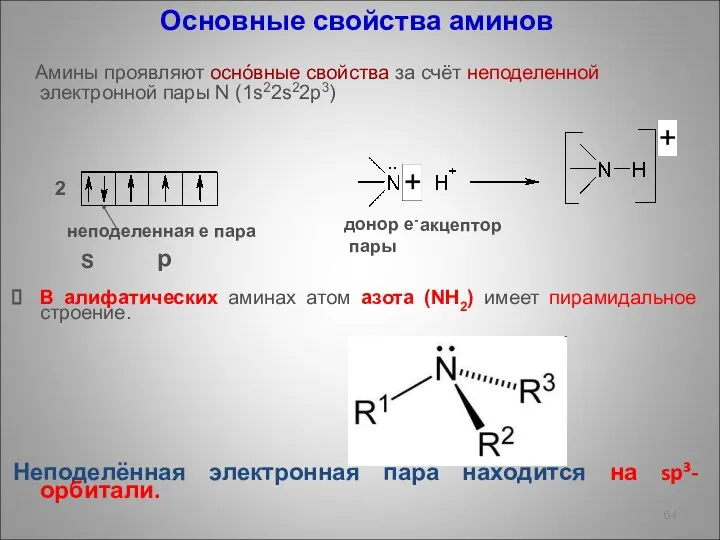
- 64. Основные свойства аминов Амины проявляют оснóвные свойства за счёт неподеленной электронной пары N (1s22s22p3) В алифатических
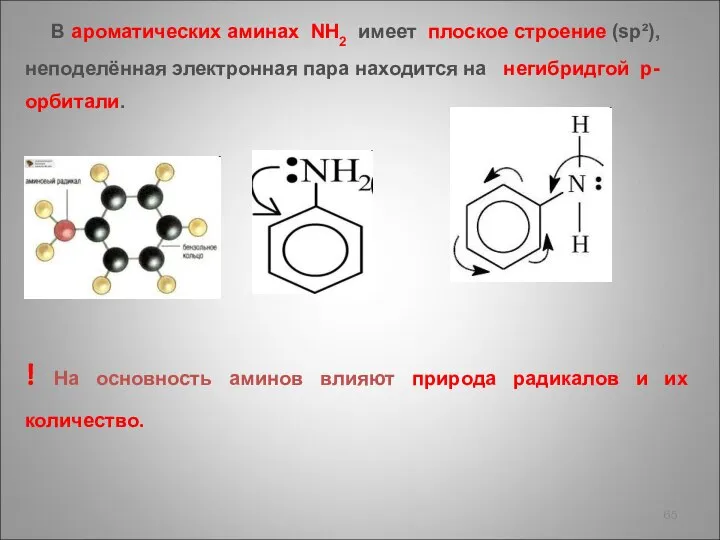
- 65. В ароматических аминах NH2 имеет плоское строение (sp²), неподелённая электронная пара находится на негибридгой p-орбитали. !
- 66. а) aлифатические амины R-NH2 Алкильный радикал R (CH3-, C2H5- и т.д.) обладает +I-эффектом, повышает электронную плотность
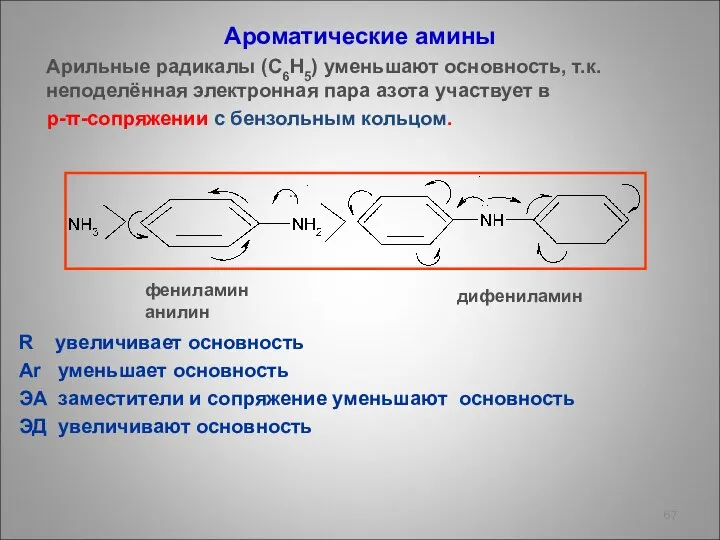
- 67. Ароматические амины Арильные радикалы (С6Н5) уменьшают основность, т.к. неподелённая электронная пара азота участвует в p-π-сопряжении с
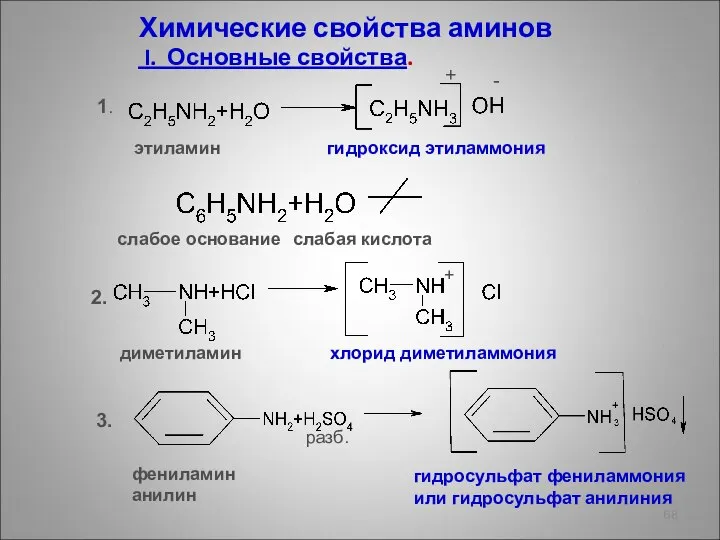
- 68. Химические свойства аминов I. Основные свойства. 1. 2. 3. этиламин гидроксид этиламмония + слабое основание слабая
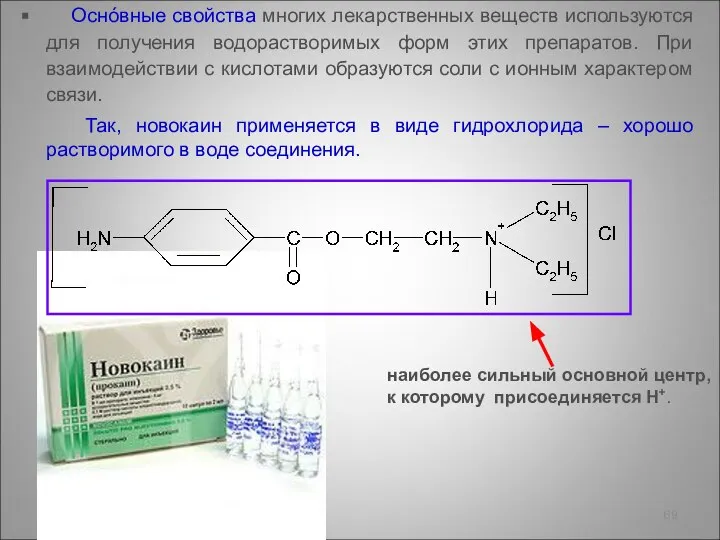
- 69. Оснóвные свойства многих лекарственных веществ используются для получения водорастворимых форм этих препаратов. При взаимодействии с кислотами
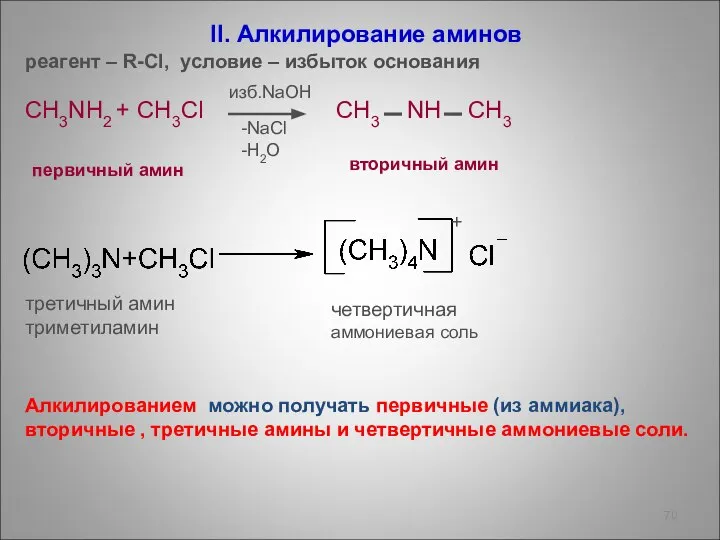
- 70. II. Алкилирование аминов реагент – R-Cl, условие – избыток основания CH3NH2 + CH3Cl CH3 NH CH3
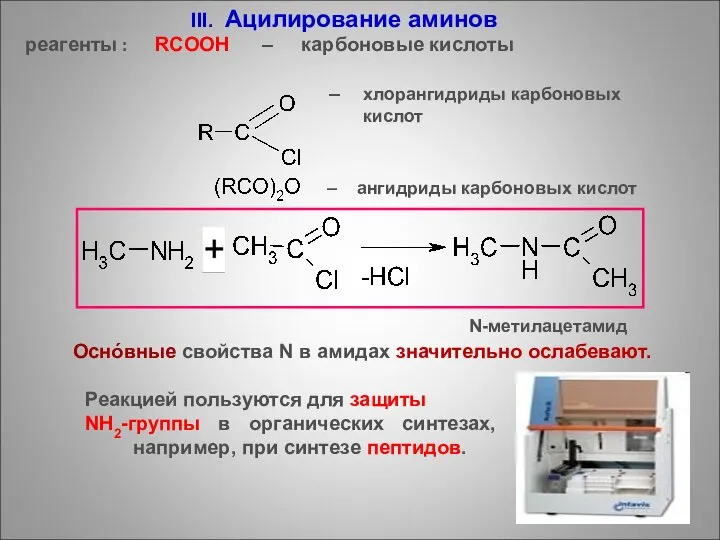
- 71. III. Ацилирование аминов реагенты : RCOOH – карбоновые кислоты – хлорангидриды карбоновых кислот – ангидриды карбоновых
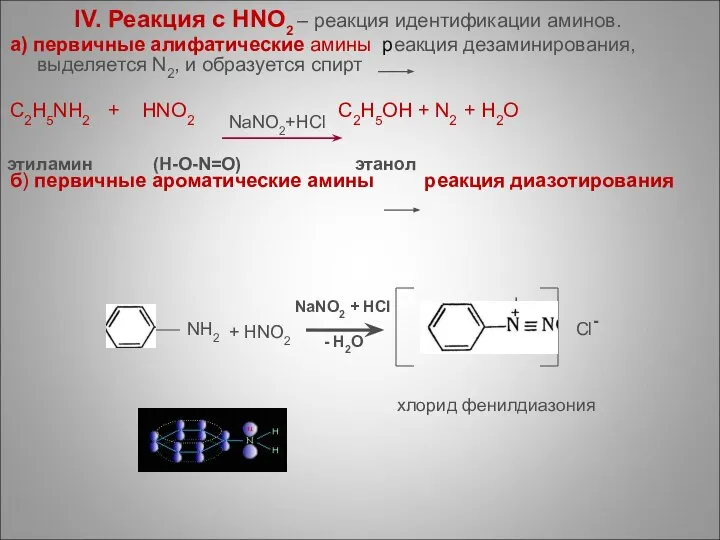
- 72. IV. Реакция с HNO2 – реакция идентификации аминов. а) первичные алифатические амины реакция дезаминирования, выделяется N2,
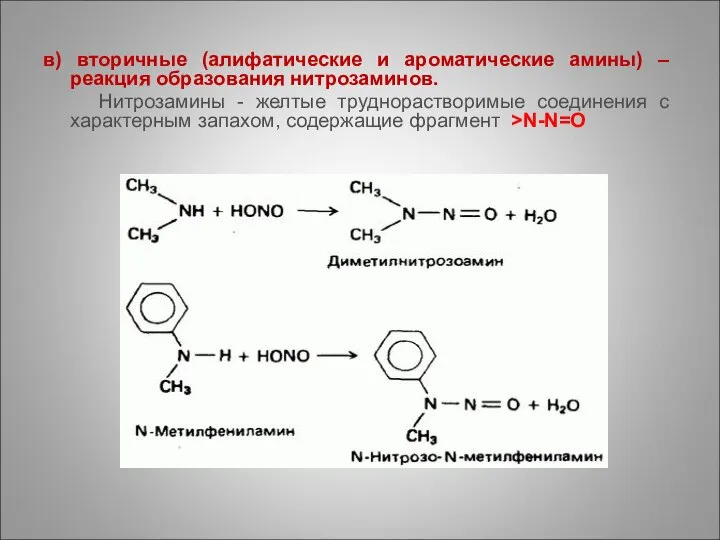
- 73. в) вторичные (алифатические и ароматические амины) – реакция образования нитрозаминов. Нитрозамины - желтые труднорастворимые соединения с
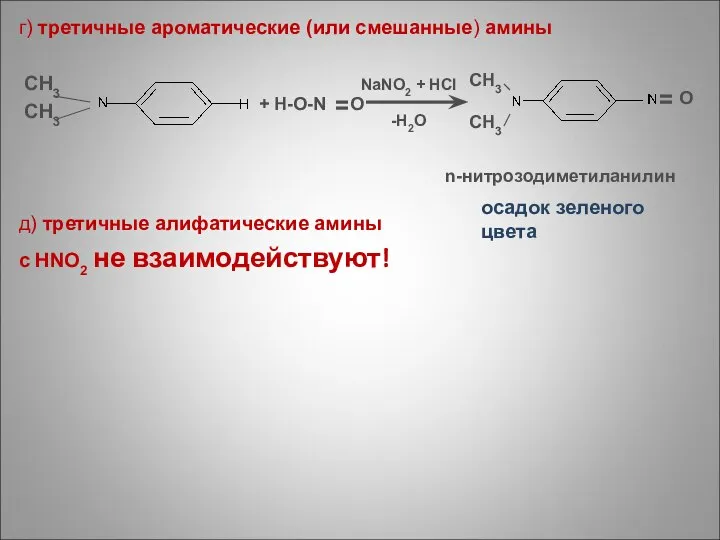
- 74. г) третичные ароматические (или смешанные) амины CH3 CH3 д) третичные алифатические амины с HNO2 не взаимодействуют!
- 75. Получение аминов образуется соль амина, из которой действием щелочи можно выделить первичный амин (этиламин): При взаимодействии
- 76. 2) Получение алифатических и ароматических вторичных аминов восстановлением нитросоединений. Восстановителем является водород «в момент выделения», который
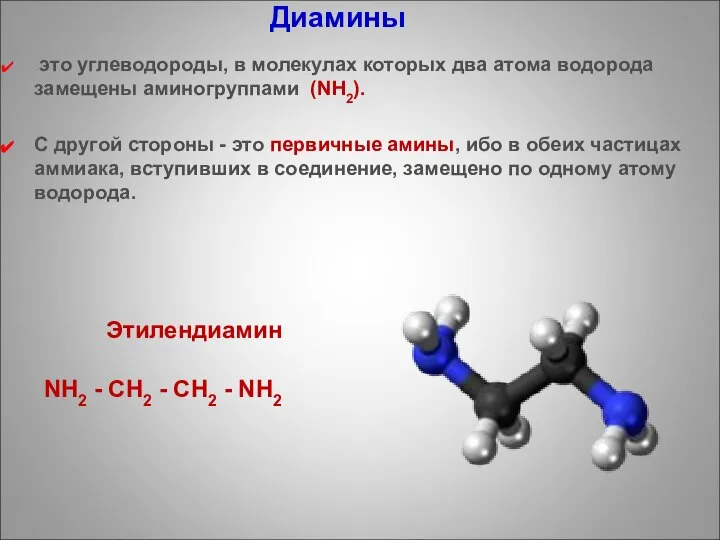
- 77. Диамины это углеводороды, в молекулах которых два атома водорода замещены аминогруппами (NН2). С другой стороны -
- 78. Путресцин H2N(CH2)4NH2 (1,4-диаминобутан или 1,4-тетраметилендиамин) Путресцин образуется при гниении белков из орнитина (диаминокарбоновая кислота): NH2-(CH2)3-CH(COOH)-NH2 →
- 79. Путресцин H2N(CH2)4NH2 Образуется в толстой кишке при ферментативном декарбоксилировании. Путресцин принимает активное участие в нормальном росте
- 80. Кадаверин (1,5-диаминопентан или α-,ε- пентаметилендиамин) от лат. cadaver — «труп». Содержится в продуктах гнилостного распада белков;
- 81. Алкалоиды Гетероциклические, азотсодержащие основания растительного происхождения. Как правило представляют собой третичные амины ! Содержатся в растениях
- 82. Эфедрин Алкалоид, содержащийся в различных видах растений рода эфедра, C6H5CH (OH) CH (NHCH3) CH3. Впервые выделен
- 83. Кониин Яд, выделенный из болиголова: этим веществом был отравлен Сократ.
- 84. Алкалоид, содержится, главным образом, в листьях и семенах различных видов табака и является жидкостью с неприятным
- 85. Впервые сульфаниламид был синтезирован в 1908 году. Все сульфаниламиды содержат сульфонамидную группу SO2NH2. Замена её на
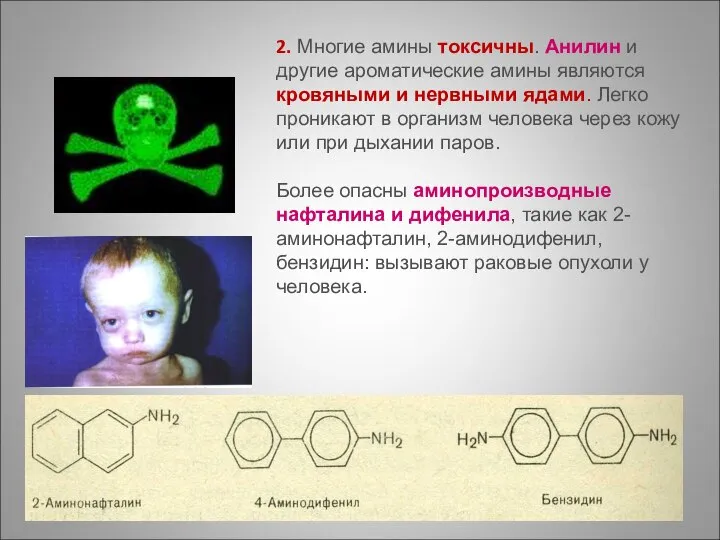
- 86. 2. Многие амины токсичны. Анилин и другие ароматические амины являются кровяными и нервными ядами. Легко проникают
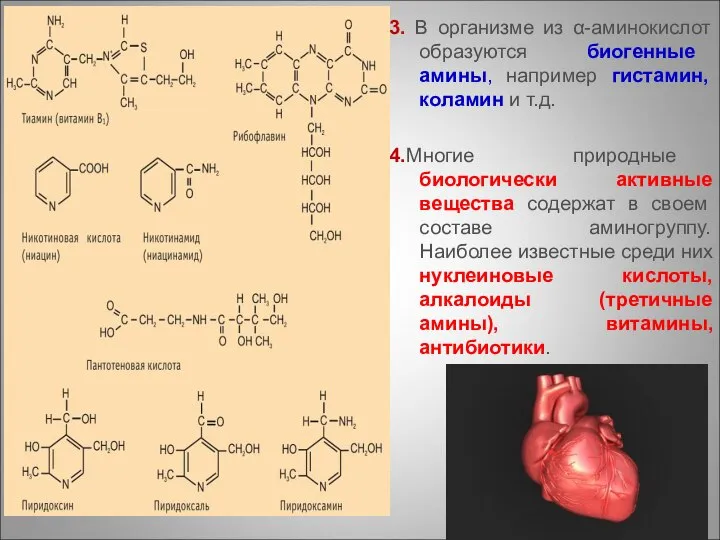
- 87. 3. В организме из α-аминокислот образуются биогенные амины, например гистамин, коламин и т.д. 4.Многие природные биологически
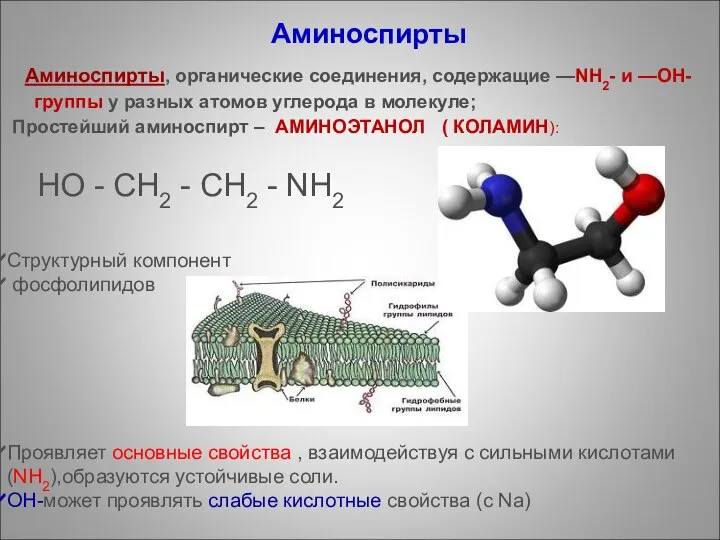
- 88. Аминоспирты и аминофенолы
- 89. Cтруктурный компонент фосфолипидов Проявляет основные свойства , взаимодействуя с сильными кислотами(NH2),образуются устойчивые соли. ОН-может проявлять слабые
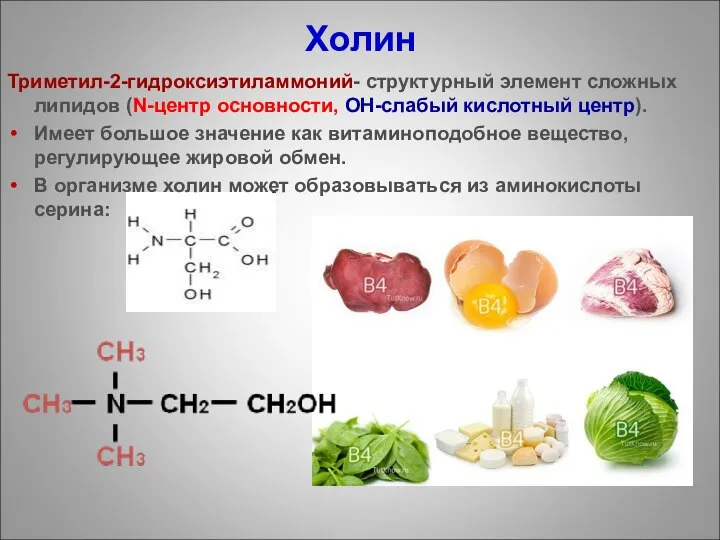
- 90. Холин Триметил-2-гидроксиэтиламмоний- структурный элемент сложных липидов (N-центр основности, ОН-слабый кислотный центр). Имеет большое значение как витаминоподобное
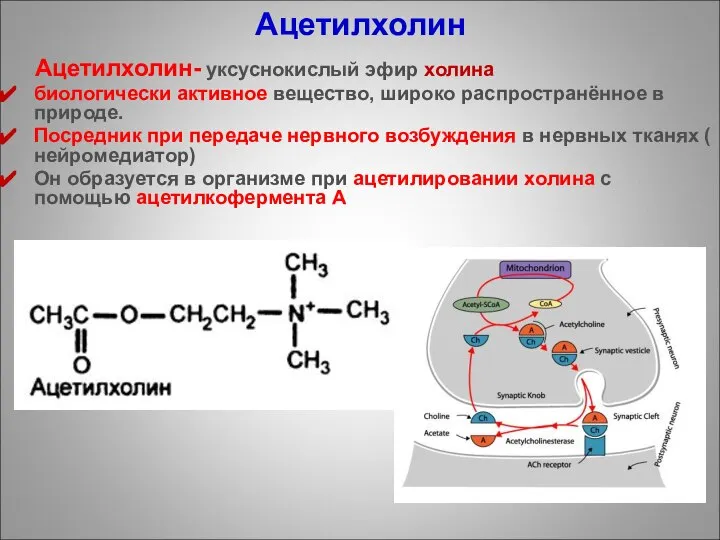
- 91. Ацетилхолин Ацетилхолин- уксуснокислый эфир холина биологически активное вещество, широко распространённое в природе. Посредник при передаче нервного
- 92. Аминофенолы, содержащие остаток пирокатехина, называются катехоламины и играют важную роль в организме (содержат основный центр NH2
- 93. Катехоламины Катехоламины, производные пирокатехина, активно участвуют в физиологических и биохимических процессах. Катехоламины – гормоны мозгового слоя
- 94. НОРАДРЕНАЛИН Главным образом важна его роль именно как нейромедиатора. Синоним: норэпинефрин. По действию на сердце, кровеносные
- 96. Скачать презентацию
















![Многоатомные спирты карбоновые кислоты или оксокислоты. Окисление фенолов [ O ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1405852/slide-53.jpg)



















 Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі
Қалдық мөлшерлер. Бромды метил буының концентрациясын анықтау тәсілдемесі Строение атома
Строение атома Срез знаний по химии
Срез знаний по химии Алкины
Алкины Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Использование технологии критического мышления на уроках химии
Использование технологии критического мышления на уроках химии Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар
Химиялық технологияның басқа ғылыммен байланысы. Негізгі технологиялық түсініктер және анықтамалар Эмульсии и эмульгаторы
Эмульсии и эмульгаторы Введение в биохимию. Значение биохимии для врача. Химия белка
Введение в биохимию. Значение биохимии для врача. Химия белка Важнейшие минералы
Важнейшие минералы Получение олефинов пиролизом углеводородов
Получение олефинов пиролизом углеводородов Получение фосфорной кислоты
Получение фосфорной кислоты Амфотерные оксиды и гидроксиды
Амфотерные оксиды и гидроксиды Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть
Презентация по Химии "Скорость химической реакции. Факторы влияющие на скорость химических реакций" - скачать смотреть  Азотные удобрения
Азотные удобрения Атом. Будова атома
Атом. Будова атома Химическая кинетика и катализ
Химическая кинетика и катализ Альдегиды
Альдегиды зубные пасты сравнительная характеристика
зубные пасты сравнительная характеристика Очистка белков (Разделение белков из гетерогенной белковой смеси)
Очистка белков (Разделение белков из гетерогенной белковой смеси) Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В.
Полимеры. Каучуки. Резина Материал к уроку подготовлен Ким Н.В. Классификация топлива. Показатели качества топлива (Лекция 1)
Классификация топлива. Показатели качества топлива (Лекция 1) Radiation dosimetry
Radiation dosimetry VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии
VII Межрегиональная метапредметная конференции «Удивительный мир научных книг». Ситуационные задания по химии Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Ионы. Проверочная работа
Ионы. Проверочная работа