Содержание
- 2. Энергетический (тепловой) баланс любого аппарата может быть представлен в виде уравнения, связывающего приход и расход энергии
- 3. Тепловой эффект реакции также равен сумме теплот образования исходных веществ за вычетом суммы теплот образования продуктов
- 4. Тепловой баланс подобно материальному выражают в виде таблиц, диаграмм, а для расчета используют следующее уравнение Qт
- 5. Qп – количество теплоты, подводимое в аппарат извне (в виде дымовых газов, нагретого воздуха, сжигания топлива,
- 6. Коэффициенты а0, а1,а2 – приведены в справочниках. Чаще всего приходится иметь дело со смесями веществ. Поэтому
- 7. Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и исходных веществ, умноженных на
- 8. Зависимость теплового эффекта от температуры определяется уравнениями Киргофа. Поскольку обычно известны табличные значения стандартных тепловых эффектов
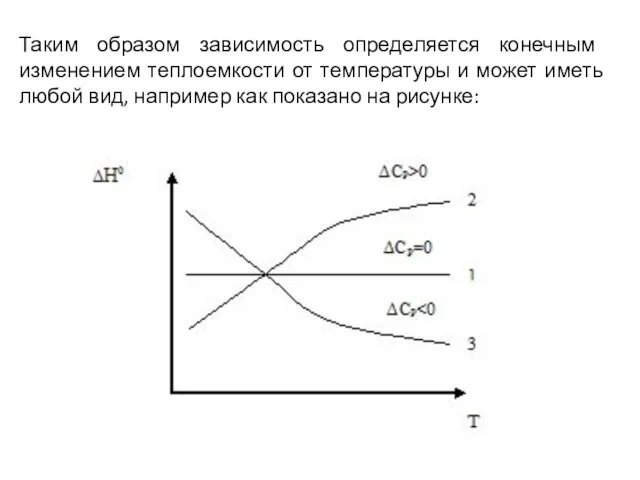
- 9. Таким образом зависимость определяется конечным изменением теплоемкости от температуры и может иметь любой вид, например как
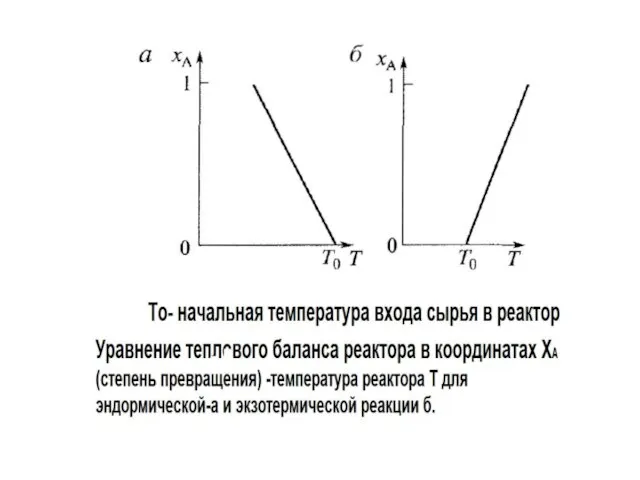
- 10. Особенности теплового баланса химического реактора Общая схема теплового баланса реактора характеризуется физическим теплом которое входит с
- 13. Скачать презентацию








 Хімія у створенні нових матеріалів та побуті
Хімія у створенні нових матеріалів та побуті Химия, как наука. Основные понятия и законы
Химия, как наука. Основные понятия и законы Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар
Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар Текстовые задачи в ЕГЭ Задачи на проценты В12
Текстовые задачи в ЕГЭ Задачи на проценты В12 Анодирование — процесс создания оксидной плёнки на поверхности некоторых металлов
Анодирование — процесс создания оксидной плёнки на поверхности некоторых металлов Секреты чая в пакетиках
Секреты чая в пакетиках 11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова
11 класс Урок по теме Почему протекают химические реакции Составитель презентации – учитель химии МОУ СОШ им. А.С. Попова Иванова  Презентация на тему: Выполнила: Елисеева Е. учащаяся 10 класса Сергиевской СОШ № 1
Презентация на тему: Выполнила: Елисеева Е. учащаяся 10 класса Сергиевской СОШ № 1 Дистилляция в химической промышленности
Дистилляция в химической промышленности Химия d -элементов
Химия d -элементов Вольфрам
Вольфрам Органічна хімія і здоров'я людини
Органічна хімія і здоров'я людини Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров
Синтез непредельных производных и сополимеров хитозана для разработки фоточувствительных композиций на основе биополимеров Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами
Набор № 3 ВС "Щелочи". Техника безопасности при работе со щелочами Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод)
Качественный химический анализ воды на определение металлов (железо, мышьяк, свинец) и микроэлементов (фтор, йод) Что такое нефть и как она появилась?
Что такое нефть и как она появилась? Микроэлементы и здоровье человека
Микроэлементы и здоровье человека Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі
Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі Технологии создания и обработки кристаллических материалов
Технологии создания и обработки кристаллических материалов Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород
Влияние нанокомпозитов платина/Нафион на электрокаталитическую активность реакции восстановления водорода и окисления кислород Закономерности управления простым обратимым гомогенным процессом
Закономерности управления простым обратимым гомогенным процессом Электронная конфигурация атома
Электронная конфигурация атома Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Hydrogen
Hydrogen Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Презентация по химии Аминокислоты и история их открытия
Презентация по химии Аминокислоты и история их открытия  Olbaltumvielas
Olbaltumvielas