Содержание
- 2. Закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно, а только переходит из
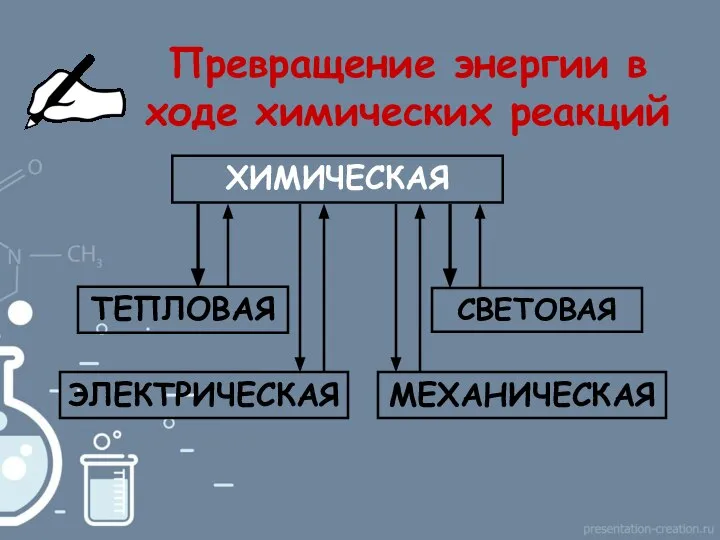
- 3. ХИМИЧЕСКАЯ Превращение энергии в ходе химических реакций ЭЛЕКТРИЧЕСКАЯ СВЕТОВАЯ ТЕПЛОВАЯ МЕХАНИЧЕСКАЯ
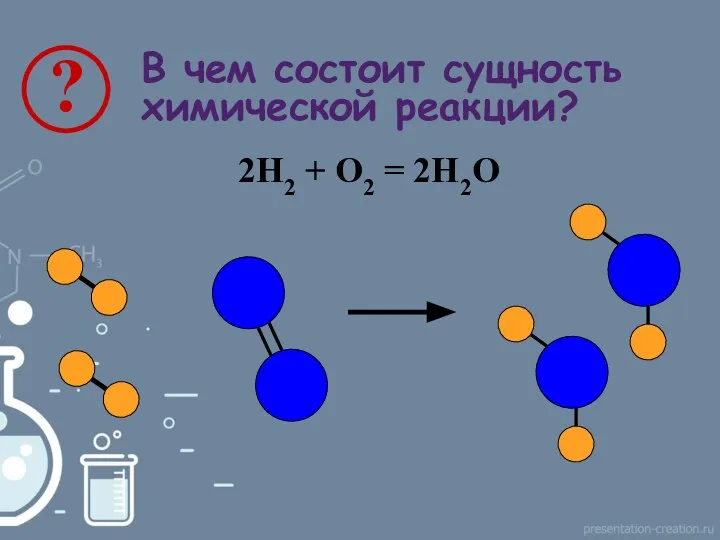
- 4. В чем состоит сущность химической реакции? 2Н2 + О2 = 2Н2О
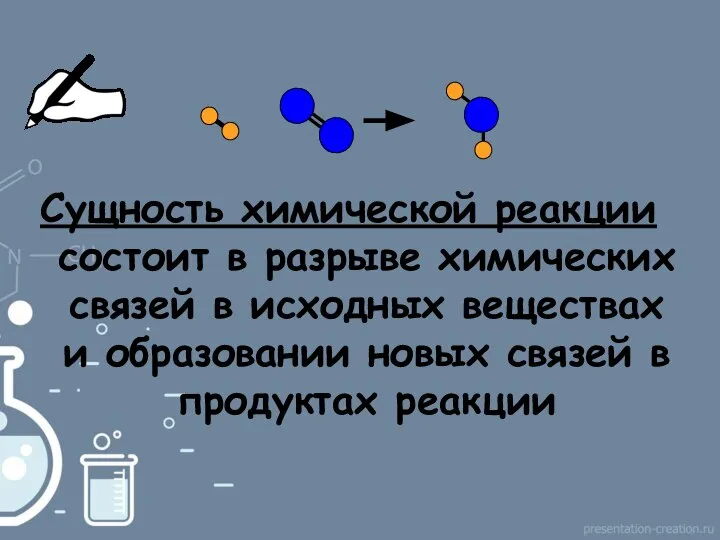
- 5. Сущность химической реакции состоит в разрыве химических связей в исходных веществах и образовании новых связей в
- 6. Связаны ли процессы разрыва и образования химических связей с процессами изменения энергии?
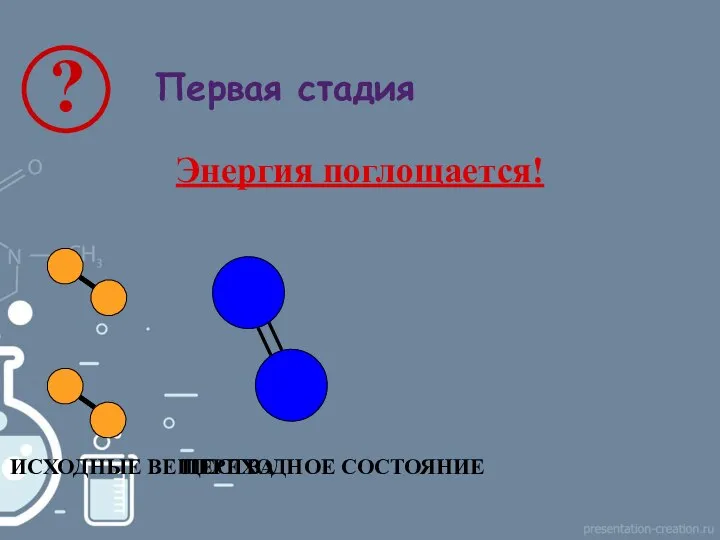
- 7. Первая стадия Энергия поглощается! ИСХОДНЫЕ ВЕЩЕСТВА ПЕРЕХОДНОЕ СОСТОЯНИЕ
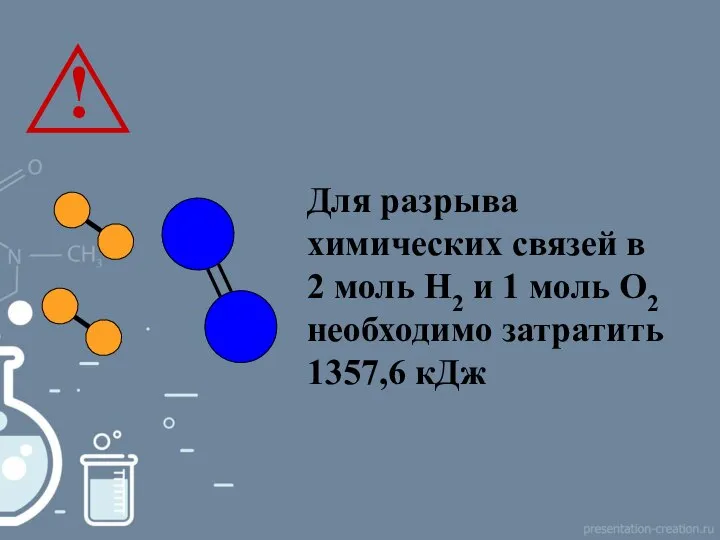
- 8. Для разрыва химических связей в 2 моль Н2 и 1 моль О2 необходимо затратить 1357,6 кДж
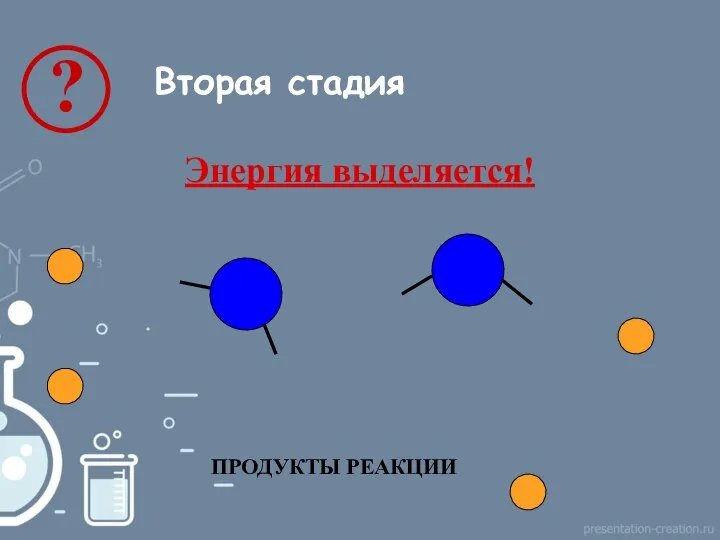
- 9. Вторая стадия ПРОДУКТЫ РЕАКЦИИ Энергия выделяется!
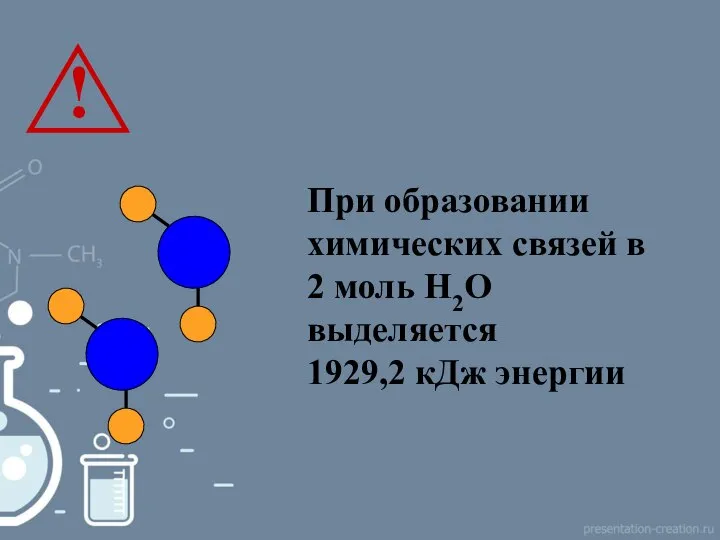
- 10. При образовании химических связей в 2 моль Н2О выделяется 1929,2 кДж энергии
- 11. Любая химическая реакция заключается в разрыве одних химических связей и образовании других!
- 12. Любая химическая реакция сопровождается выделением или поглощением ЭНЕРГИИ!
- 13. Все реакции сопровождаются тепловыми эффектами. ,
- 14. Тепловой эффект химической реакции Q- это количество теплоты, которое выделяется или поглощается при химических реакциях Дж;
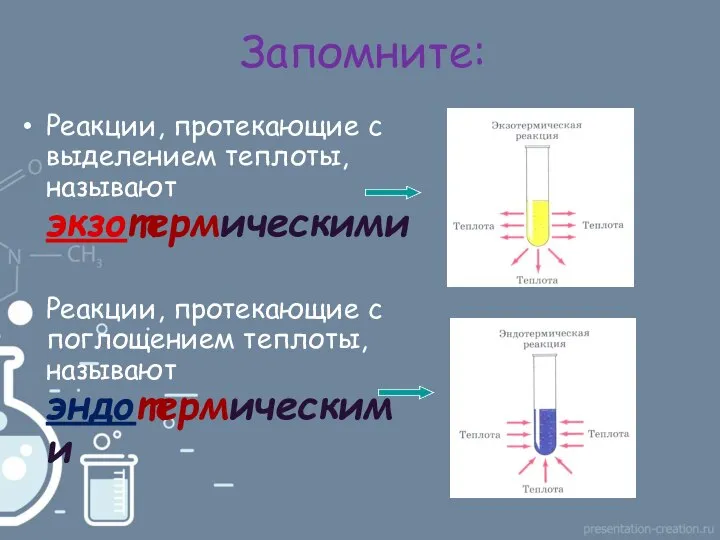
- 15. Запомните: Реакции, протекающие с выделением теплоты, называют экзотермическими Реакции, протекающие с поглощением теплоты, называют эндотермическими
- 16. ЭКЗОТЕРМИЧЕСКАЯ РЕАКЦИЯ
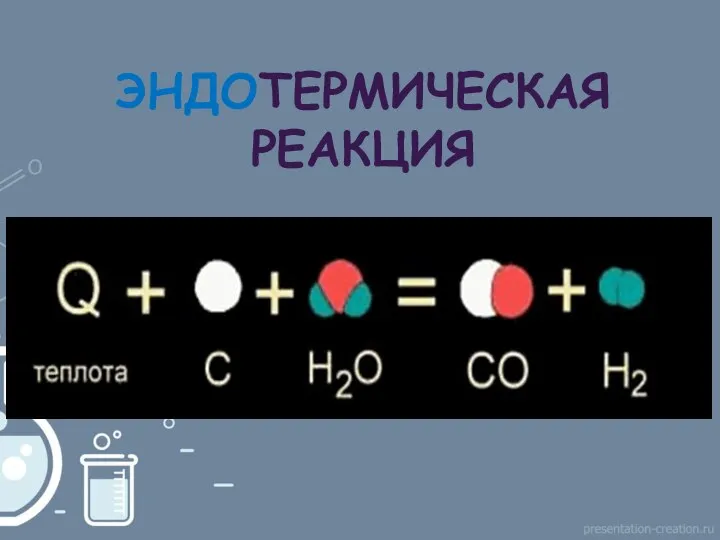
- 17. ЭНДОТЕРМИЧЕСКАЯ РЕАКЦИЯ
- 18. С(тв.) + О2(г.) ?СО2(г.) + 402,24кДж 2HgO(тв.)?2Hg(ж.)+O2(г.) - 180 кДж
- 19. Химические уравнения, в которых указывается тепловой эффект, называются ТЕРМОХИМИЧЕСКИМИ
- 21. Скачать презентацию









 Валентность
Валентность Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии
Методы снижения уровня учебного стресса у обучающихся 9-х классов на уроках химии Органикалық қосылыстардың жіктелуі
Органикалық қосылыстардың жіктелуі Сопряженное присоединение. Циклоприсоединениеie
Сопряженное присоединение. Циклоприсоединениеie Номенклатура органических соединений
Номенклатура органических соединений Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Применение солей
Применение солей  Классы неорганических соединений. Индивидуальные задания
Классы неорганических соединений. Индивидуальные задания Углеводороды. Свойства алканов
Углеводороды. Свойства алканов Ртуть. Нахождение в природе. Применение
Ртуть. Нахождение в природе. Применение Химические компоненты клетки. Неорганические компоненты
Химические компоненты клетки. Неорганические компоненты Презентация по Химии "Синтетические материалы" - скачать смотреть
Презентация по Химии "Синтетические материалы" - скачать смотреть  Мило. Мийні засоби
Мило. Мийні засоби  Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет
Презентация по Химии "Группа веществ, изолируемых из биологического материала дистилляцией («Летучие яды»)" - скачать смотрет Горные породы: гранит, базальт
Горные породы: гранит, базальт Хочу хорошо сдать ЕГЭ
Хочу хорошо сдать ЕГЭ Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей
Презентация по Химии "Особенности строения атома карбона в основном и возбужденном состояниях. Образование ковалентных связей  Подготовка к лабораторной работе
Подготовка к лабораторной работе Фосфор, фосфор оксидтері
Фосфор, фосфор оксидтері Биохимия печени
Биохимия печени Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард
Презентація на тему : Застосування Сполук Алюмінію Підготував : Учень 10 класу Кійко Едуард  Классификация минералов
Классификация минералов Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид
Конкурс проектных работ "Химия наука о чудесах!" Выполнила: ученица 8 класса МОУ гимназии № 91 имени М.В.Ломоносова Пожид Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина
Силикатная промышленность Подготовила ученица 9 А класса Семёнова Екатерина Сульфиды и им подобные соединения
Сульфиды и им подобные соединения Текстуры метаморфических пород
Текстуры метаморфических пород Превращения в нашей жизни: физические и химические
Превращения в нашей жизни: физические и химические