Содержание
- 2. Термодинамика фазовых превращений
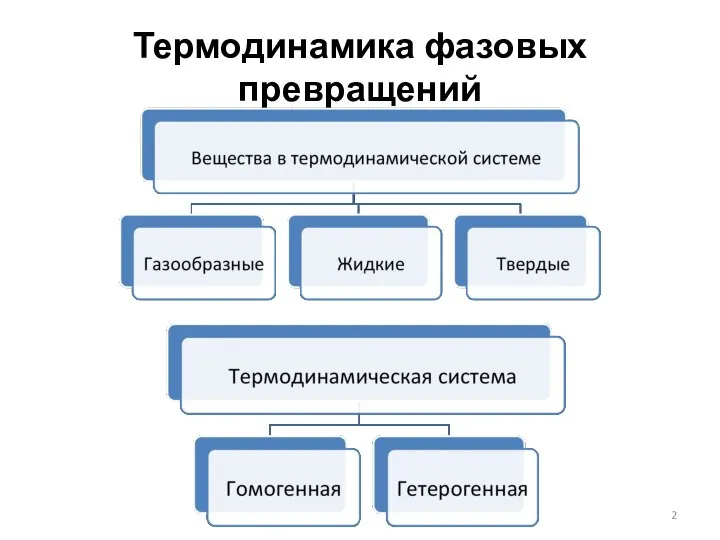
- 3. Термодинамика фазовых превращений Гетерогенная система – термодинамическая система, состоящая из различных по своим свойствам частей, разграниченных
- 4. Термодинамика фазовых превращений Классификация систем По фазам: однофазные, двухфазные, трехфазные и многофазные По числу компонентов: однокомпонентные,
- 5. Термодинамика фазовых превращений Термодинамические степени свободы (вариантность системы) – число независимых термодинамических параметров фаз системы, изменение
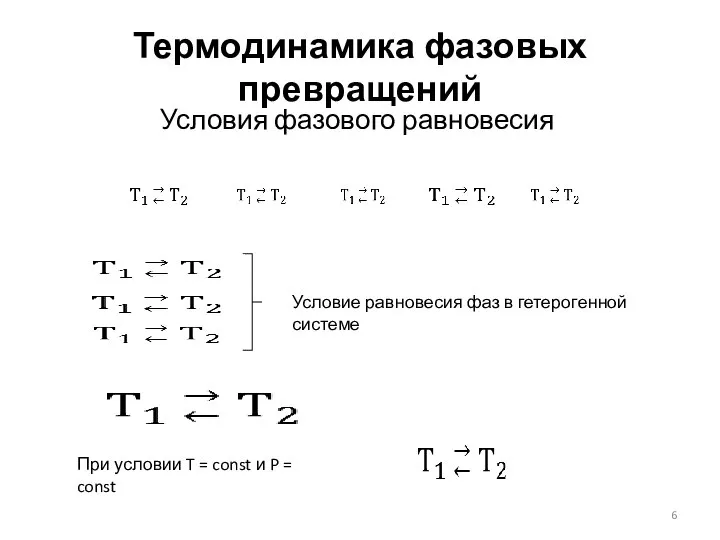
- 6. Термодинамика фазовых превращений Условия фазового равновесия Условие равновесия фаз в гетерогенной системе При условии T =
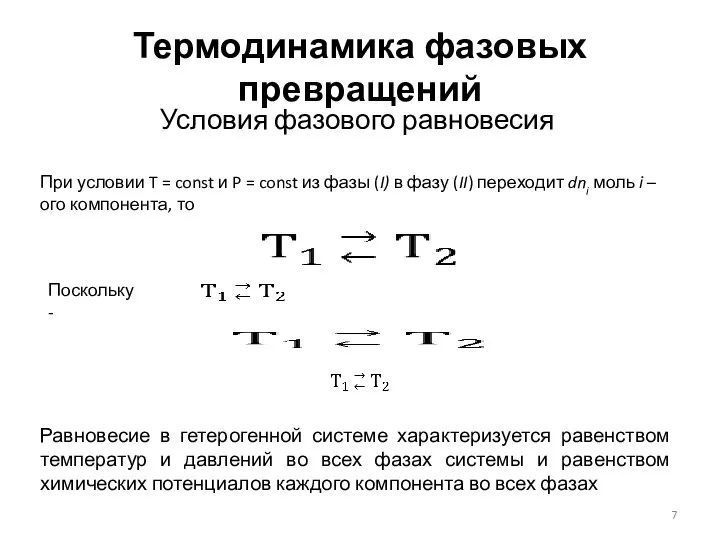
- 7. Термодинамика фазовых превращений Условия фазового равновесия При условии T = const и P = const из
- 8. Термодинамика фазовых превращений Правило фаз Гиббса Равновесная система, состоящая из Ф фаз, каждая из которых содержит
- 9. Термодинамика фазовых превращений Правило фаз Гиббса Число уравнений связывающих концентрации одного компонента равно (Ф-1), а для
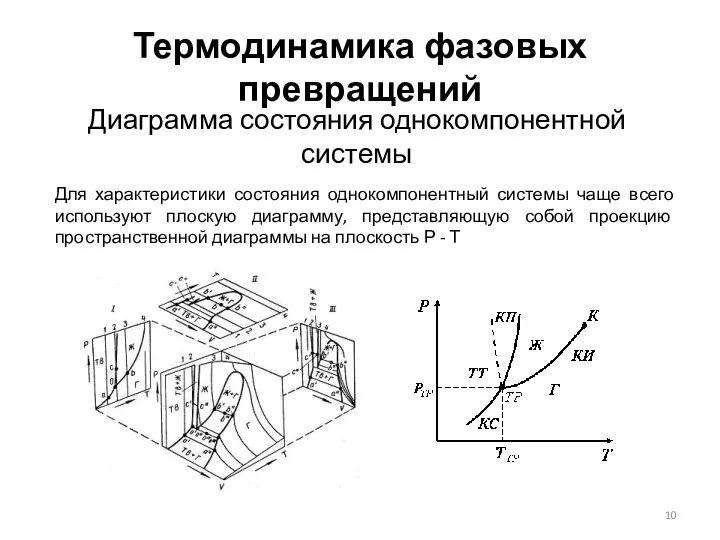
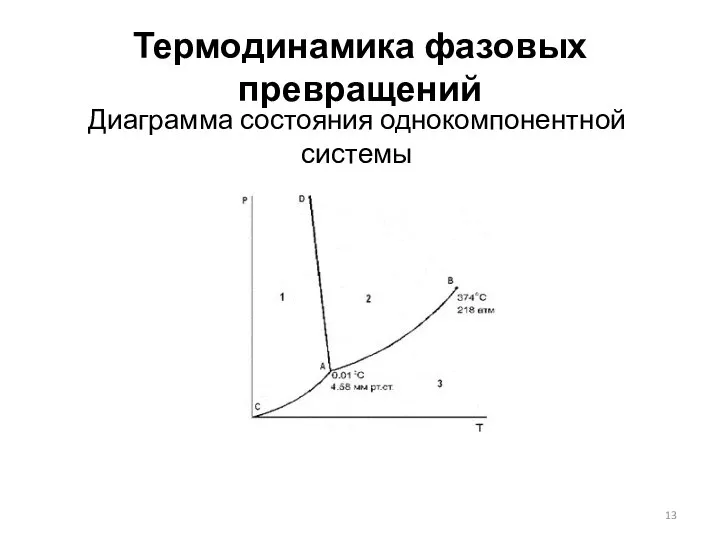
- 10. Термодинамика фазовых превращений Диаграмма состояния однокомпонентной системы Для характеристики состояния однокомпонентный системы чаще всего используют плоскую
- 11. Термодинамика фазовых превращений Диаграмма состояния однокомпонентной системы Н.С. Курнаков, в основе анализа диаграмм состояния лежат два
- 12. Термодинамика фазовых превращений Диаграмма состояния однокомпонентной системы Н.С. Курнаков, в основе анализа диаграмм состояния лежат два
- 13. Термодинамика фазовых превращений Диаграмма состояния однокомпонентной системы
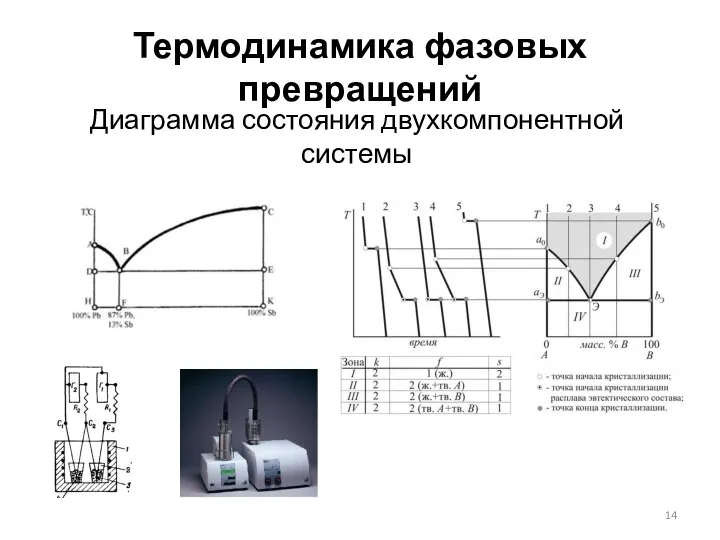
- 14. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
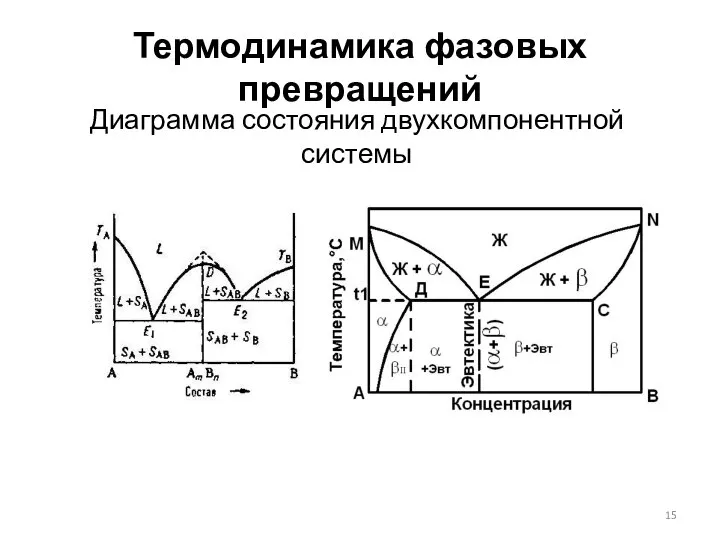
- 15. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
- 16. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
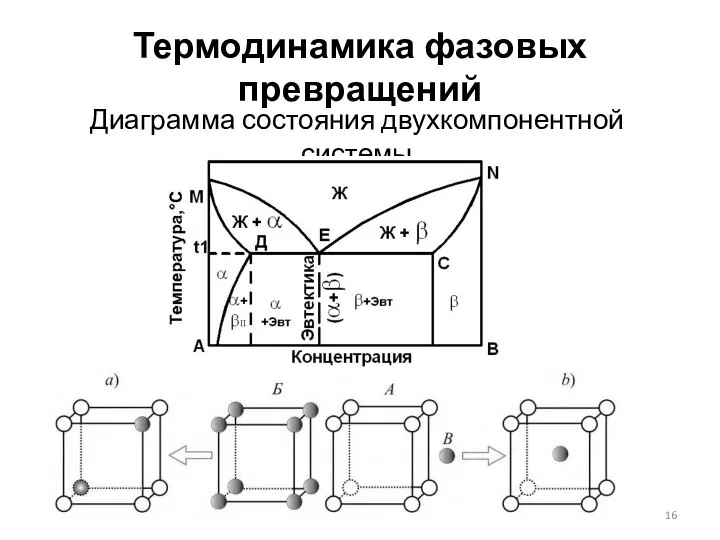
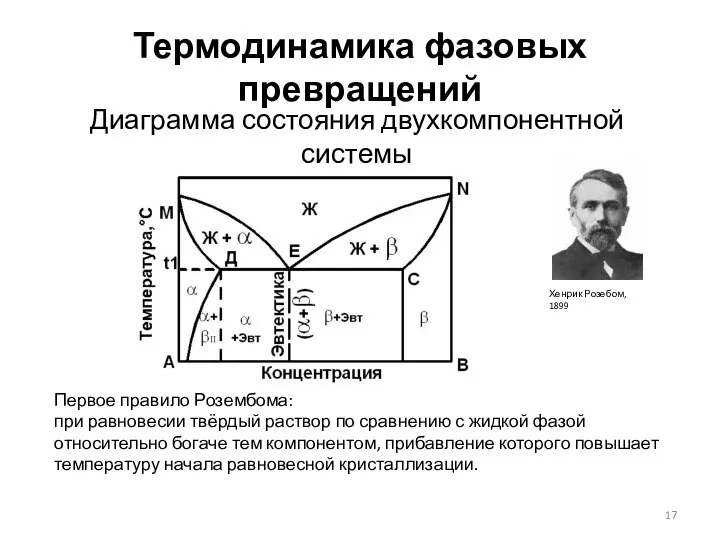
- 17. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы Первое правило Розембома: при равновесии твёрдый раствор по сравнению
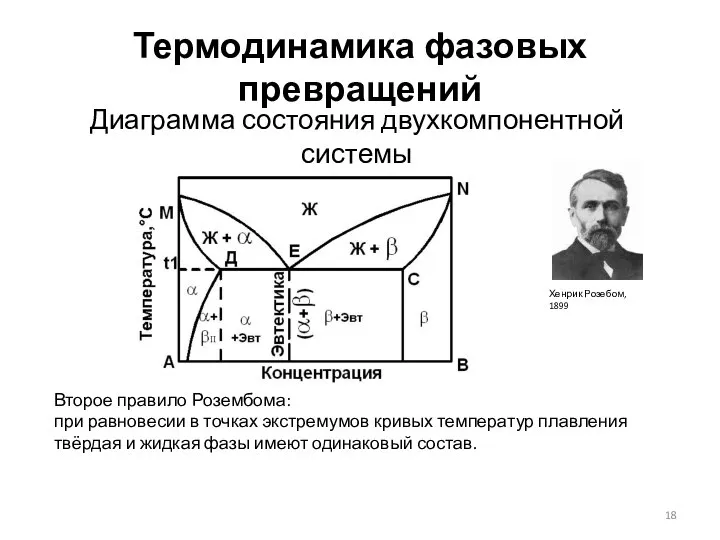
- 18. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы Второе правило Розембома: при равновесии в точках экстремумов кривых
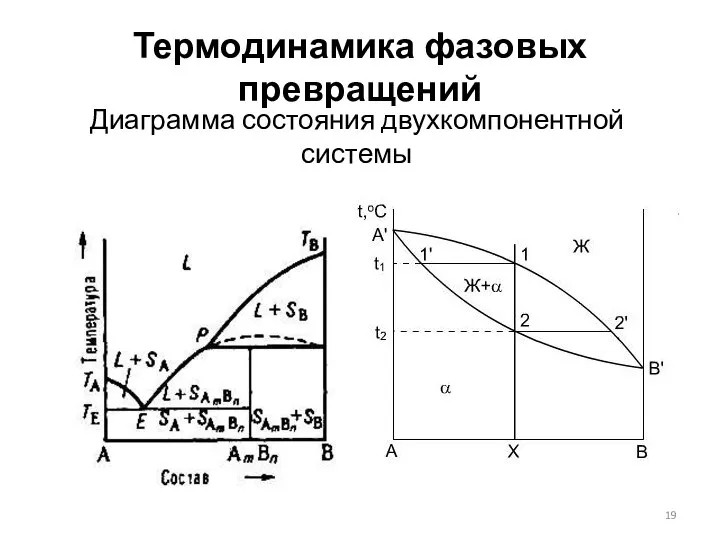
- 19. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
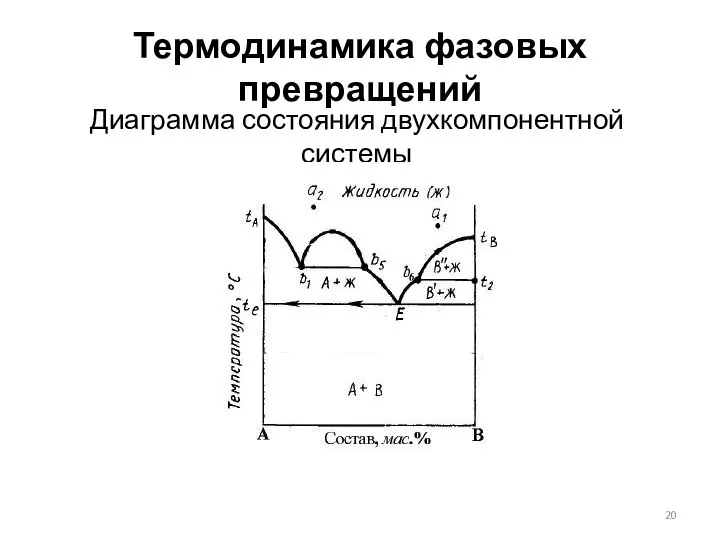
- 20. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
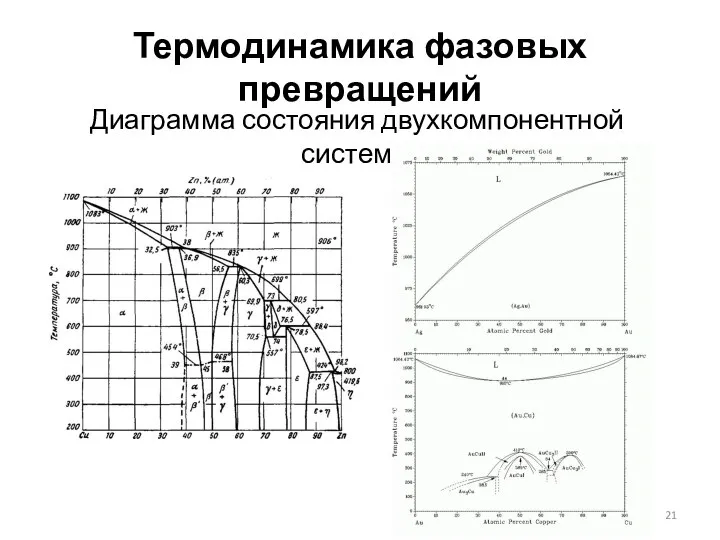
- 21. Термодинамика фазовых превращений Диаграмма состояния двухкомпонентной системы
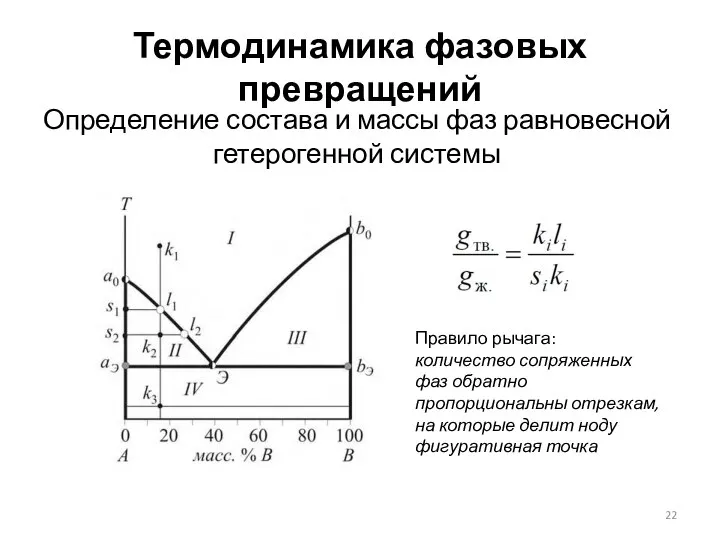
- 22. Термодинамика фазовых превращений Определение состава и массы фаз равновесной гетерогенной системы Правило рычага: количество сопряженных фаз
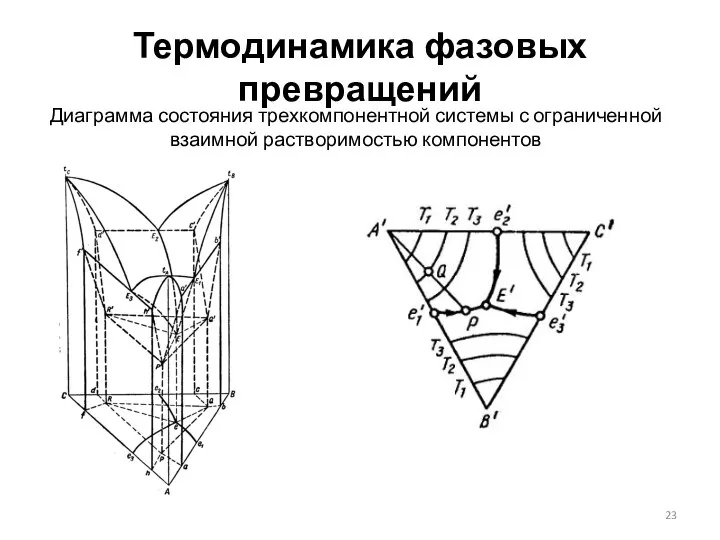
- 23. Термодинамика фазовых превращений Диаграмма состояния трехкомпонентной системы с ограниченной взаимной растворимостью компонентов
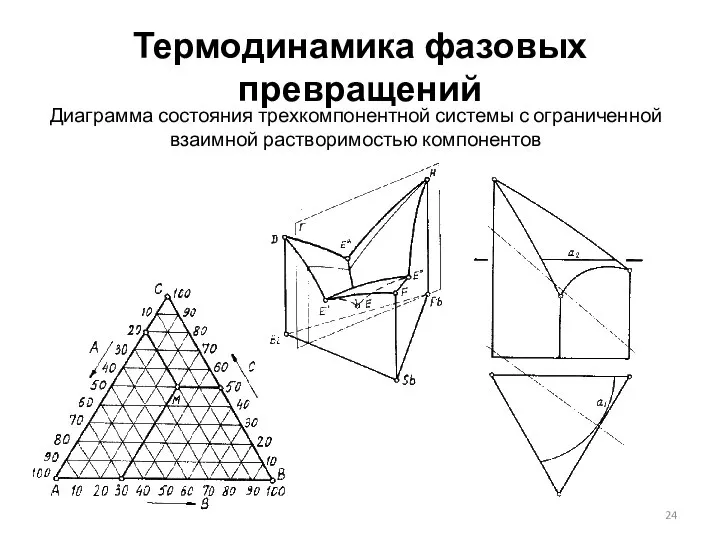
- 24. Термодинамика фазовых превращений Диаграмма состояния трехкомпонентной системы с ограниченной взаимной растворимостью компонентов
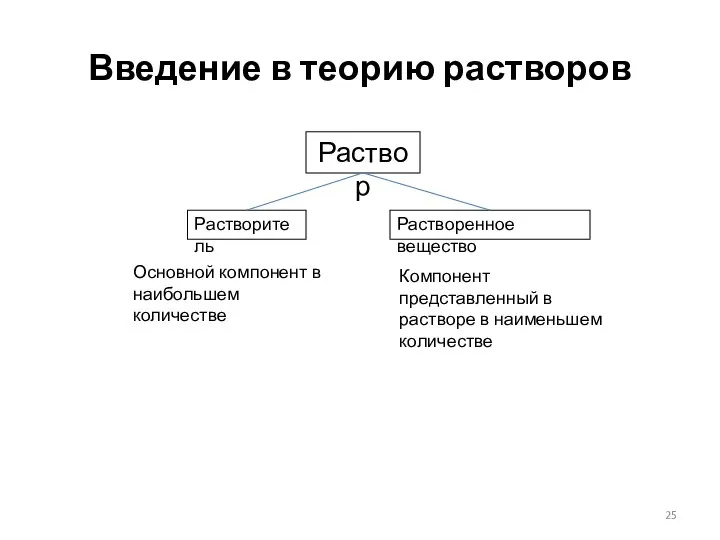
- 25. Введение в теорию растворов Раствор Растворитель Растворенное вещество Основной компонент в наибольшем количестве Компонент представленный в
- 26. Введение в теорию растворов Способы выражения концентрации компонентов Молярная доля Массовая доля Объемная доля Молярность Моляльность
- 27. Введение в теорию растворов Термодинамическое и молекулярно-кинетическое условия образования растворов Образование растворов – процесс самопроизвольный, протекает
- 28. Введение в теорию растворов Термодинамическое и молекулярно-кинетическое условия образования растворов С точки зрения кинетики растворение твердого
- 29. Введение в теорию растворов Термодинамическое и молекулярно-кинетическое условия образования растворов Молекулярно-кинетические условия образования раствора определяются: Диффузией
- 30. Введение в теорию растворов Термодинамическое и молекулярно-кинетическое условия образования растворов Молекулярно-кинетические условия образования раствора определяются: Диффузией
- 32. Скачать презентацию












 Электрическая проводимость растворов
Электрическая проводимость растворов Coordination compounds
Coordination compounds Periodic Table of the Elements
Periodic Table of the Elements Скандий
Скандий Липиды. Составные части липидов
Липиды. Составные части липидов Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста
Понятие электрохимии. Процессы на границе металл – раствор. Электродные потенциалы. Гальванические элементы. Уравнение Нернста Марганец и его свойства
Марганец и его свойства Строение, особенности химического поведения алкалоидов, обладающих биологической активностью
Строение, особенности химического поведения алкалоидов, обладающих биологической активностью Равновесие в растворах электролитов
Равновесие в растворах электролитов Типы химических реакций
Типы химических реакций Презентация по Химии "Кофеїн" - скачать смотреть бесплатно
Презентация по Химии "Кофеїн" - скачать смотреть бесплатно КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n
КРАХМАЛ и ЦЕЛЛЮЛОЗА (С6Н10О5)n  Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Электролитическая диссоциация
Электролитическая диссоциация Презентация по Химии "Моющие и чистящие средства" - скачать смотреть
Презентация по Химии "Моющие и чистящие средства" - скачать смотреть  Презентація уроку «Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія» Підготувала: учитель хімії вищої категорії Христин
Презентація уроку «Атоми і хімічні елементи. Молекули. Рух молекул. Дифузія» Підготувала: учитель хімії вищої категорії Христин Положение металлов в ПС, особенности строения их атомов, физические свойства
Положение металлов в ПС, особенности строения их атомов, физические свойства Контроль в процессе обучения химии на старшей ступени школы
Контроль в процессе обучения химии на старшей ступени школы Тепловой баланс котла
Тепловой баланс котла Электрохимия. Физико –химические свойства ионных систем. (Лекция 13)
Электрохимия. Физико –химические свойства ионных систем. (Лекция 13) Поліетилен
Поліетилен Алмаз
Алмаз Применение алкенов
Применение алкенов Алкены. Пропилен
Алкены. Пропилен Набухание наполненных полимеров
Набухание наполненных полимеров Тема: Липиды. Лекция № 2 для студентов 2 курса
Тема: Липиды. Лекция № 2 для студентов 2 курса Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Углеводы. Дисахариды и полисахариды
Углеводы. Дисахариды и полисахариды