Содержание
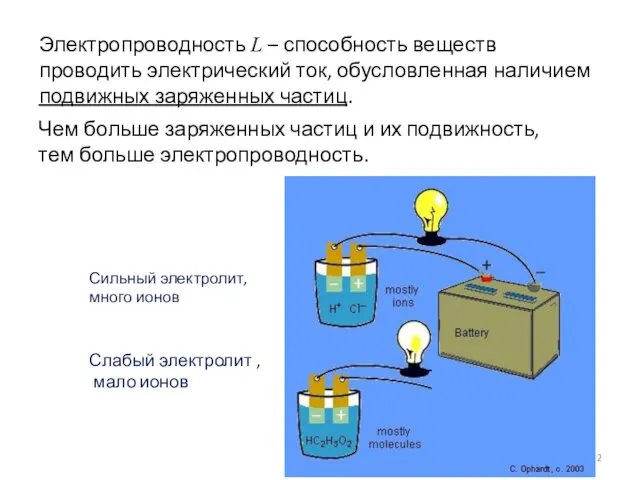
- 2. Электропроводность L – способность веществ проводить электрический ток, обусловленная наличием подвижных заряженных частиц. Чем больше заряженных
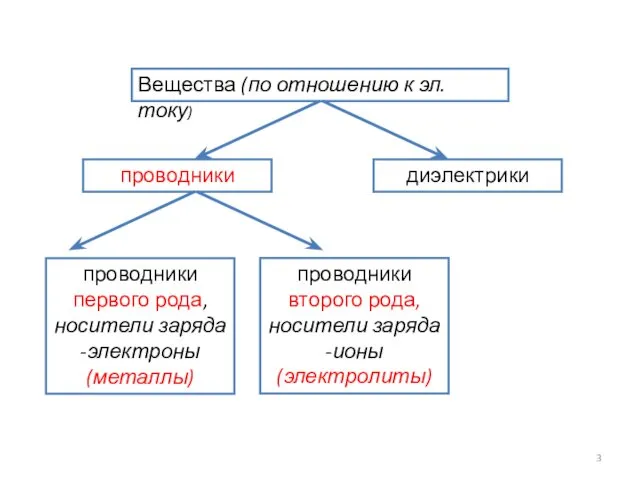
- 3. Вещества (по отношению к эл. току) проводники диэлектрики проводники первого рода, носители заряда -электроны (металлы) проводники
- 4. Растворы электролитов — проводники второго рода, носителями электричества в них служат анионы и катионы. Растворы электролитов
- 5. R – сопротивление [Ом] L – электропроводность [Ом–1] или [См] (Сименс) 1 Ом–1 = 1 См
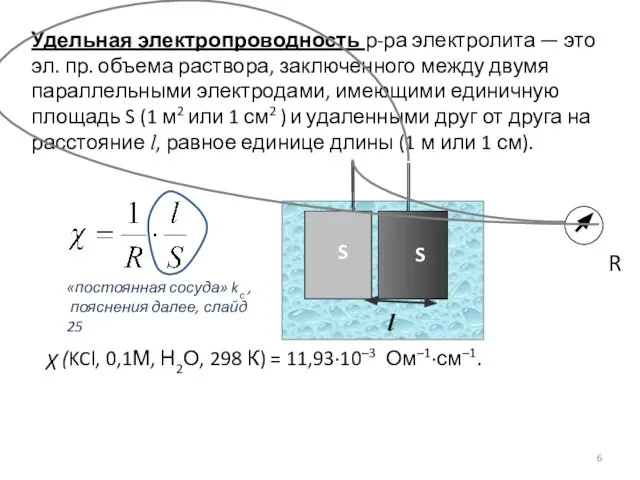
- 6. Удельная электропроводность р-ра электролита — это эл. пр. объема раствора, заключенного между двумя параллельными электродами, имеющими
- 7. Разное число носителей заряда – трудно сравнивать вещества по χ : χ (KCl, 0,1М) и χ
- 8. Указывать формульную единицу (единичный заряд) λ (1/2 MgCl2 , 0,1 М) = 98,1 Ом–1∙см2∙моль–1 Вид формулы
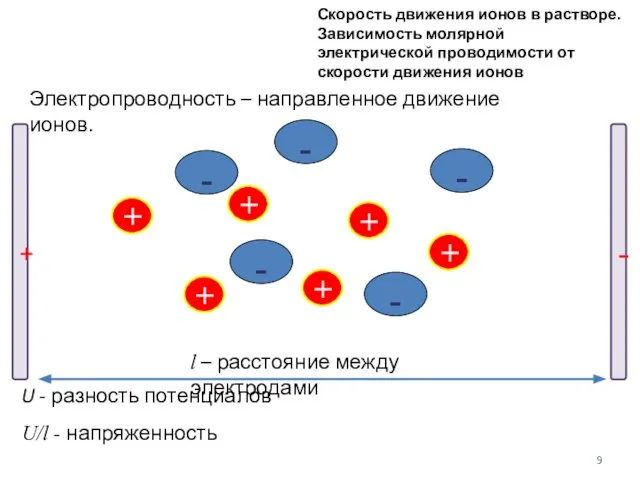
- 9. - - - - - + + + + + + + - Скорость движения ионов
- 10. Скорость движения иона м/с Если U/l = 1 В/м, то «абсолютная скорость» u м2В–1с–1 Абсолютные скорости
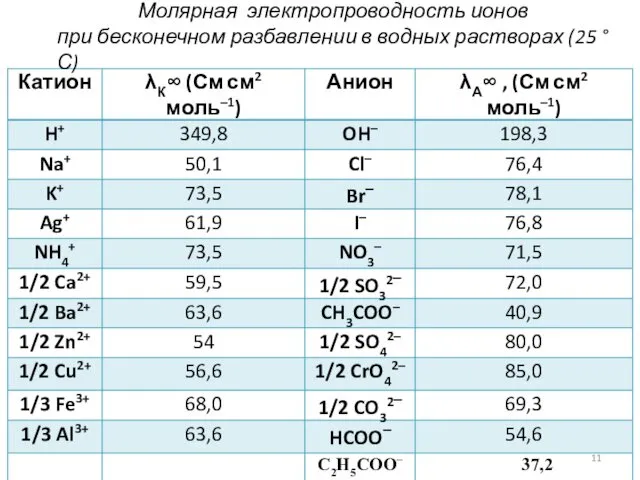
- 11. Молярная электропроводность ионов при бесконечном разбавлении в водных растворах (25 °С)
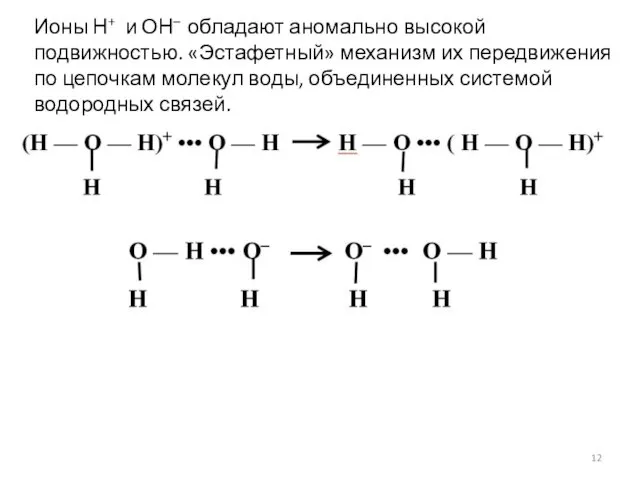
- 12. Ионы Н+ и ОН– обладают аномально высокой подвижностью. «Эстафетный» механизм их передвижения по цепочкам молекул воды,
- 13. Можно получить λ∞ раствора расчетным путем, используя справочные значенияλ∞ ионов. Например: λ∞ (ВаSO4) = 2 λ∞
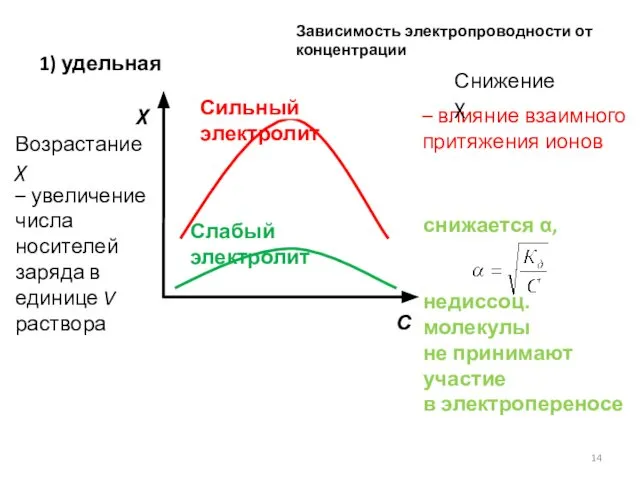
- 14. Зависимость электропроводности от концентрации Возрастание χ – увеличение числа носителей заряда в единице V раствора –
- 15. Фиксированное количество вещества (1 моль) влияние взаимного притяжения ионов снижается α λ∞ – отвечает электропроводимости идеального
- 16. Как определить λ∞ ? прямое измерение невозможно (нельзя приготовить «бесконечно разбавленный раствор»), из графической зависимости λ
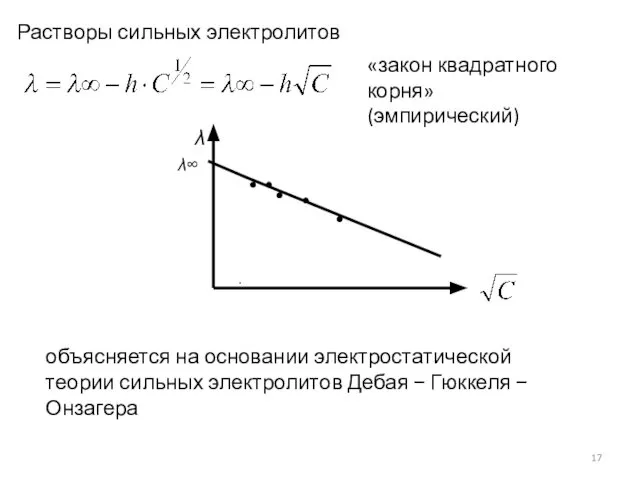
- 17. . «закон квадратного корня» (эмпирический) объясняется на основании электростатической теории сильных электролитов Дебая − Гюккеля −
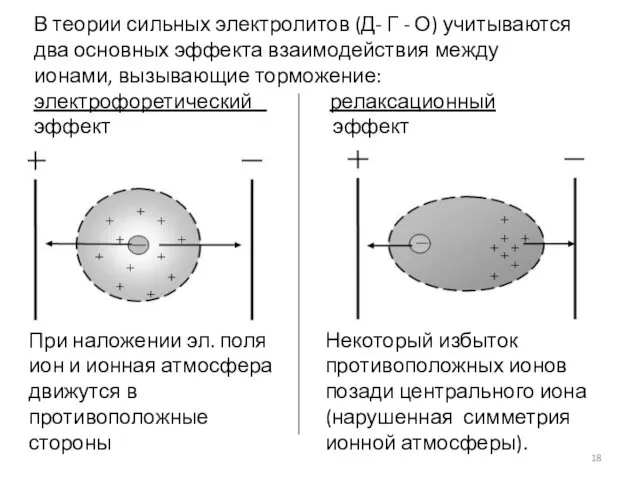
- 18. В теории сильных электролитов (Д- Г - О) учитываются два основных эффекта взаимодействия между ионами, вызывающие
- 19. Уравнение, полученное Дебаем, Гюккелем и Онзагером является теоретическим обоснованием эмпирического «закона квадратного корня» Для водных растворов
- 20. Экспериментальное определение λ∞ сильного электролита (используем на лаб. работе №3) Измеряем χ при разных С, пересчитываем
- 21. Растворы слабых электролитов концентрация ионов невелика, расстояния между ними большие, поэтому можно считать, что электростатические взаимодействия
- 22. А – из графика, λ∞ по справочным данным Определение Кд слабого электролита (используем в лаб. работе
- 23. Пример χ 0,135 М раствора пропионовой кислоты равна 4,79∙10–4 См∙см–1 Вычислите молярную электрическую проводимость, степень диссоциации,
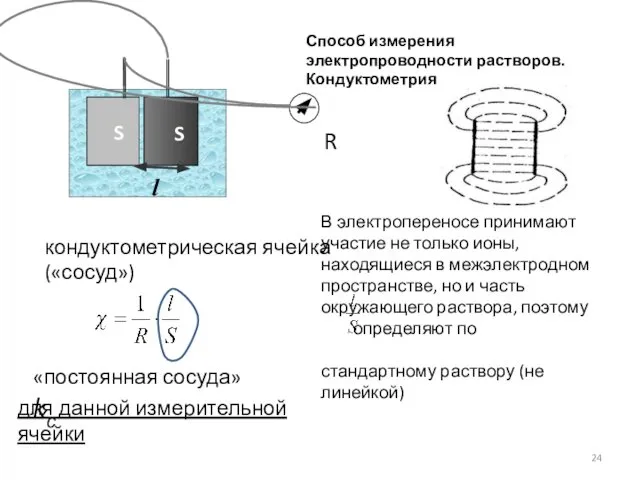
- 24. Способ измерения электропроводности растворов. Кондуктометрия кондуктометрическая ячейка («сосуд») «постоянная сосуда» kс для данной измерительной ячейки В
- 25. Стандартный раствор KCl Затем измеряют R изучаемого раствора (старые приборы) и вычисляют Определение kс и настройка
- 26. В современных кондуктометрах на дисплее прибора высвечивается значение χ уже с учетом kC (настраивают заранее)
- 27. внутриклеточная жидкость χ= 1 – 3∙10–5 См∙см-1 жидкие среды организма (кровь, лимфа, желчь, моча, спинно-мозговая жидкость)
- 28. ! Если измеряемая χ ≈10–4 –10–6 См∙см–1 – учитывать вклад χ воды. Пример χ насыщенного раствора
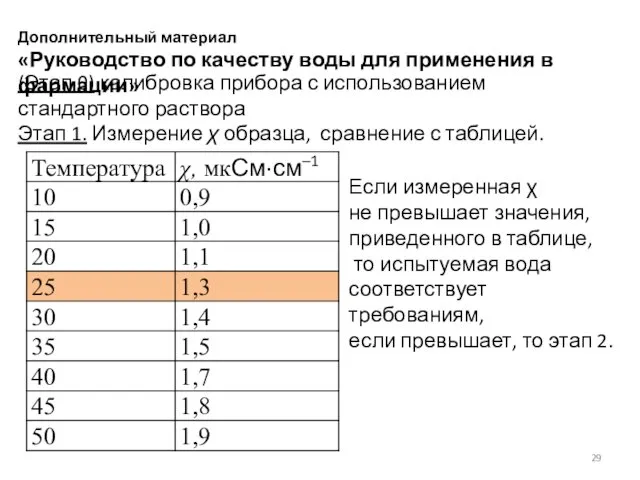
- 29. Дополнительный материал «Руководство по качеству воды для применения в фармации» (Этап 0) калибровка прибора с использованием
- 30. Этап 2. Термостатируют образец при 25 С и наблюдают изменение χ при поглощении СО2 воздуха. Если
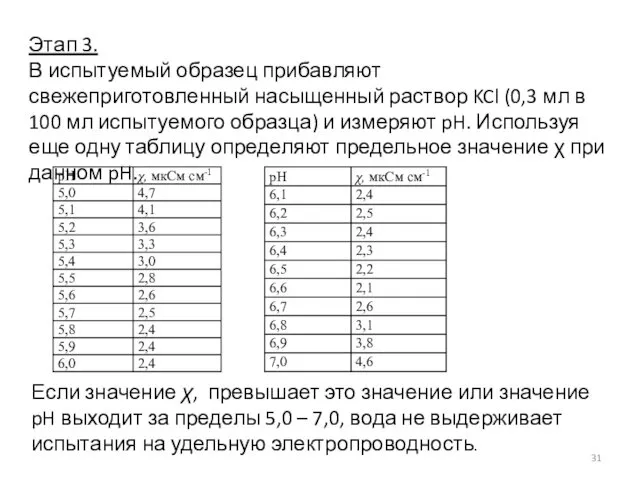
- 31. Этап 3. В испытуемый образец прибавляют свежеприготовленный насыщенный раствор KCl (0,3 мл в 100 мл испытуемого
- 32. Зависимость электрической проводимости разбавленных растворов от температуры где α – температурный коэффициент электропроводности. для сильных кислот
- 34. Скачать презентацию

![R – сопротивление [Ом] L – электропроводность [Ом–1] или [См] (Сименс)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/496591/slide-4.jpg)

















 Сложные эфиры
Сложные эфиры Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы
Лекция 6 Нарушения кислотнощелочного равновесия ацидозы, алкалозы Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Научные принципы химического производства. Производство аммиака
Научные принципы химического производства. Производство аммиака Углерод и 4 группа
Углерод и 4 группа Способы количественного определения белка
Способы количественного определения белка Поверхневі явища. Адсорбція
Поверхневі явища. Адсорбція Теория строения химических соединений А. М. Бутлерова
Теория строения химических соединений А. М. Бутлерова МИР ИНДИКАТОРОВ
МИР ИНДИКАТОРОВ Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно
Презентация по Химии "Органічні сполуки і здоров’я людини." - скачать смотреть бесплатно Ионная, металлическая, водородная связь
Ионная, металлическая, водородная связь Растворы
Растворы Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть
Презентация по Химии "Карбоновые кислоты 10 класс" - скачать смотреть  Скорость химической реакции. Порядок и молекулярность реакции. Катализ
Скорость химической реакции. Порядок и молекулярность реакции. Катализ Пиролиз углеводородного сырья
Пиролиз углеводородного сырья Свойства химических элементов
Свойства химических элементов ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»
ПРЕЗЕНТАЦИЯ «Химия и повседневная жизнь человека»  Химия, как наука. Основные понятия и законы
Химия, как наука. Основные понятия и законы Изотопы. Химические и физические свойства
Изотопы. Химические и физические свойства Фізичні методи дослідження хімічних сполук
Фізичні методи дослідження хімічних сполук Растворы электролитов
Растворы электролитов Классификация углеводов. Глюкоза
Классификация углеводов. Глюкоза Химический элемент водород
Химический элемент водород Химия гетероциклических соединений
Химия гетероциклических соединений Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Гидролиз солей
Гидролиз солей Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті”
Дослідження на тему: Історія назви міста За проектом “Екологічна ситуація у рідному місті” Сульфиды. Лекция 8
Сульфиды. Лекция 8