Содержание
- 6. Неорганическая химия по числу и составу исходных веществ и продуктов реакции реакция соединения реакция разложения реакция
- 7. Реакция соединения Реакция соединения – реакция, в ходе, которой из нескольких простых и сложных веществ образуется
- 8. Реакция разложения Реакция разложения – реакция, в которой из одного исходного вещества образуется несколько новых веществ.
- 9. Реакция замещения Реакция замещения – реакция между простым и сложным веществами, в результате которой атомы простого
- 10. Реакция обмена Реакция обмена – реакция, в результате которой два вещества обмениваются своими составными частями, образуя
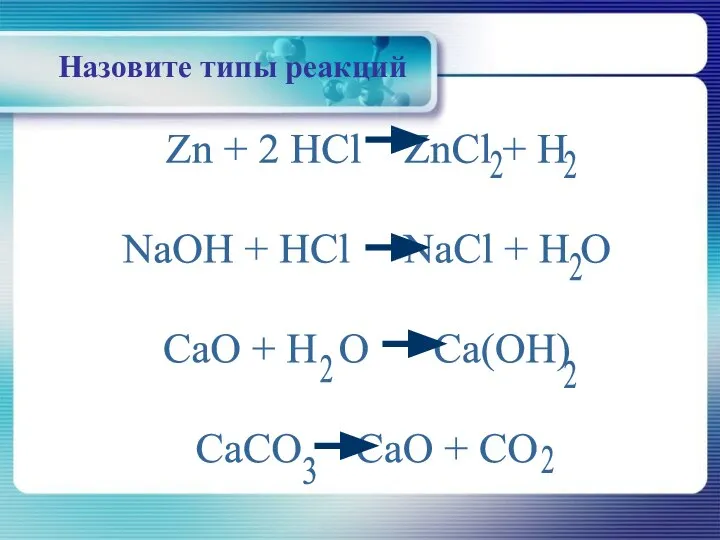
- 11. Назовите типы реакций Zn + 2 HCl ZnCl + H NaOH + HCl NaCl + H
- 12. по тепловому эффекту экзотермическая реакция эндотермическая реакция
- 13. Экзотермические реакции – реакции, протекающие с выделением энергии (тепла). Горение фосфора в кислороде 4P + 5O2
- 14. Эндотермические реакции – реакции, протекающие с поглощением энергии (тепла). Горение азота в атмосфере кислорода N2 +
- 16. Назовите типы реакций CaCO CaO + CO - Q 2 3 3 H2 + N2 NH3
- 17. По степени окисления элементов: Окислительно-восстановительные (ОВР) 4P0 + 5O20 = 2P2 +5O5-2 Без изменения степеней окисления
- 20. По равновесию между исходными веществами и продуктами: Обратимые 3 H2 + N2 NH3 + Q Необратимые
- 21. По наличию катализатора: Каталитические 2SO2+O2 2SO3 Некаталитические S+O2=SO2
- 22. По числу фаз: Гомогенные Гетерогенные
- 23. Типы реакций в органической химии
- 24. Типы реакций Все реакции можно формально разделить на: Замещение Присоединение Отщепление Окисление Обмен Полимеризация Изомеризация
- 25. Замещение реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (или
- 28. Присоединение реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну. В реакции
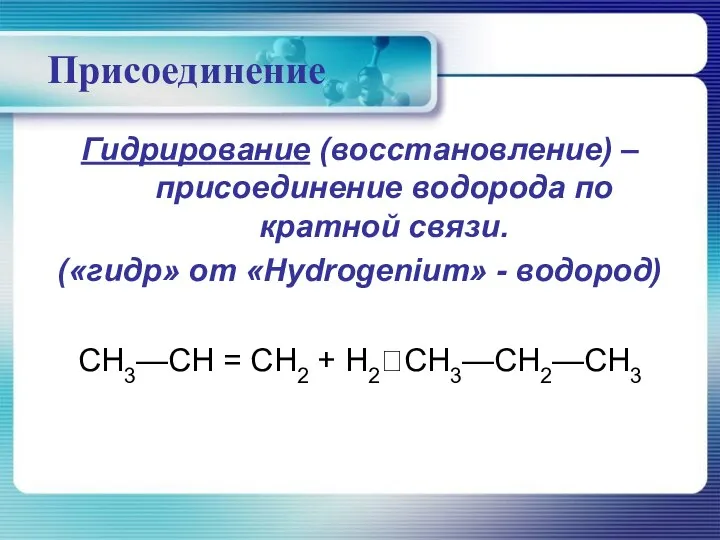
- 29. Присоединение Гидрирование (восстановление) – присоединение водорода по кратной связи. («гидр» от «Hydrogenium» - водород) СН3—СН =
- 30. Присоединение Гидрогалогенирование – присоединение галогеноводорода (например, гидрохлорирование). (от «гидр» - водород, «галоген» - галоген (представитель 7
- 31. Присоединение Галогенирование – присоединение галогена (например, бромирование). СН2=СН2 + Сl2 ?СН2Сl—СН2Сl Гидратация – присоединение воды («гидро»
- 33. Отщепление реакции, в результате которых из молекулы исходного соединения образуются молекулы нескольких новых веществ. Иное название
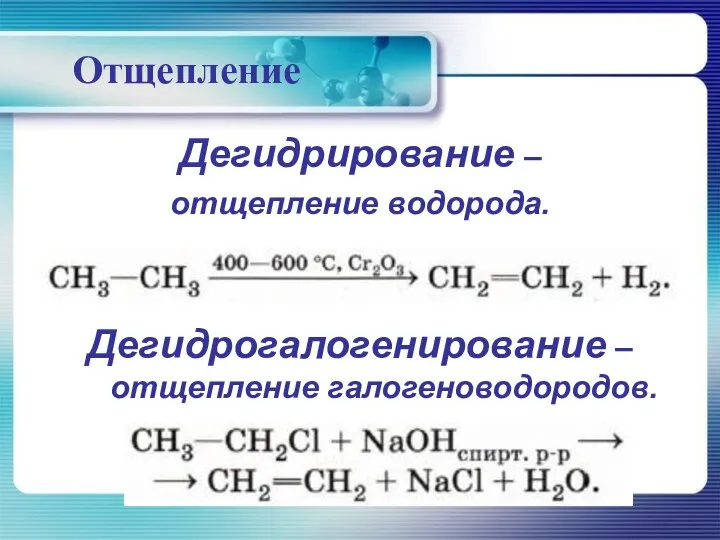
- 35. Отщепление Дегидрирование – отщепление водорода. Дегидрогалогенирование – отщепление галогеноводородов.
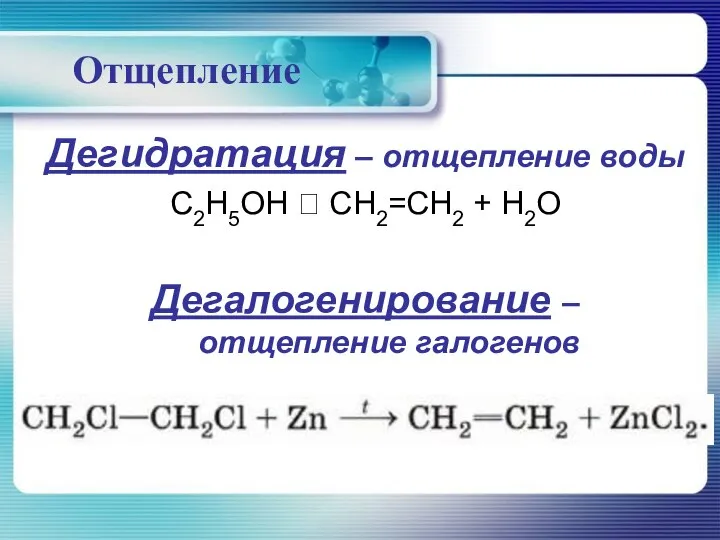
- 36. Отщепление Дегидратация – отщепление воды C2H5OH ? CH2=CH2 + H2O Дегалогенирование – отщепление галогенов
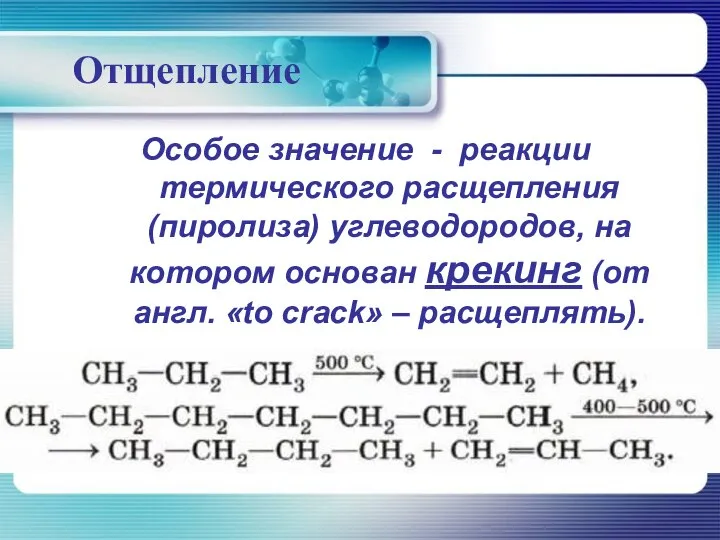
- 37. Отщепление Особое значение - реакции термического расщепления (пиролиза) углеводородов, на котором основан крекинг (от англ. «to
- 38. Окисление Горение – реакция полного окисления (сгорания). При горении углеводородов выделяется углекислый газ и вода. C5H12
- 39. Окисление Неполное окисление веществами-окислителями (перманганат калия, серная кислота, оксид меди, кислород (при наличии катализатора)) СН3-СН2-ОН +
- 40. Обмен Реакций обмена в органической химии не так много. Большинство - реакции «метатезиса» (двойного обмена) НО:
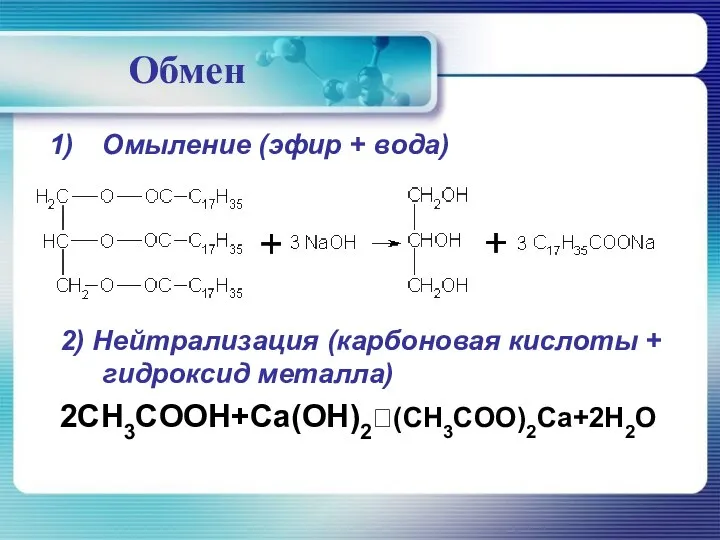
- 41. Обмен Омыление (эфир + вода) 2) Нейтрализация (карбоновая кислоты + гидроксид металла) 2CH3COOH+Ca(OH)2?(CH3COO)2Ca+2H2O
- 43. Обмен Этерификация – реакция образования сложных эфиров при взаимодействии кислот и спиртов. (от др. греч. «этер»
- 44. Полимеризация особый тип реакций присоединения, в ходе которых молекулы вещества с небольшой молекулярной массой соединяются друг
- 45. Изомеризация реакции, в результате которых из молекул одного вещества образуются молекулы других веществ того же качественного
- 46. ЗАДАНИЕ 1. Определите тип химической реакции.
- 48. Скачать презентацию







































 Синтетические каучуки, строение, свойства, применение.
Синтетические каучуки, строение, свойства, применение. Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов
Фотоэлектрические и информационные свойства фоточувствительных карбазолилсодержащих олигомерных пленочных композитов Химия и проблемы экологии. Кислотные дожди
Химия и проблемы экологии. Кислотные дожди Сероводород. Сернистый водород, сульфид водорода, дигидросульфид
Сероводород. Сернистый водород, сульфид водорода, дигидросульфид Кремний – бог неорганической природы
Кремний – бог неорганической природы Неметаллы: общая характеристика
Неметаллы: общая характеристика Новые катализаторы
Новые катализаторы Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть
Презентация по Химии "Пищевые добавки. Е - коды" - скачать смотреть  Инструментальные методы анализа
Инструментальные методы анализа Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В
Глюкоза Презентацію виконали учениці 11-Б класу Христинівської спеціалізованої школи І – ІІІ ступенів № 1 ім. О. Є. Корнійчука В Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Презентация по химии Фосфор
Презентация по химии Фосфор  Аллотропия углерода
Аллотропия углерода Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно
Презентация по Химии "Презентація на тему : «Фосфатні добрива у нашому житті»" - скачать смотреть бесплатно Строение атома. Периодический закон
Строение атома. Периодический закон Углеводы. Моносахариды. Дисахариды
Углеводы. Моносахариды. Дисахариды Аминокилоты. Получение и применение
Аминокилоты. Получение и применение Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин)
Производные дигидропиридина (нефидипин, амлодипин, форидон) и пиридина (супрастин) Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Етиловий спирт та його вплив на організм людини
Етиловий спирт та його вплив на організм людини Машиностроительные материалы
Машиностроительные материалы Типы химических реакций в органической химии. Типы реакций в органике
Типы химических реакций в органической химии. Типы реакций в органике Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15)
Нуклеозиды и нуклеотиды. Нуклеиновые кислоты. (Лекция 50.15) Структура периодической системы химических элементов
Структура периодической системы химических элементов Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат
Презентация по Химии "Оксиды. Состав. Классификация. Номенклатура. Свойства. Получение. Применение" - скачать смотреть бесплат