Содержание
- 2. Немного о планах Нам нужно пройти: Группу углерода ( 2 недели) Группу 3 (1.5 недели) Группу
- 3. Немного о планах на 4ю группу Сегодня посмотрим химию углерода – основные оксиды и вещества. Завтра
- 4. Немного о планах на 4ю группу Зачем вам всё это? Плюсов очень много: Развитие абстрактного мышления
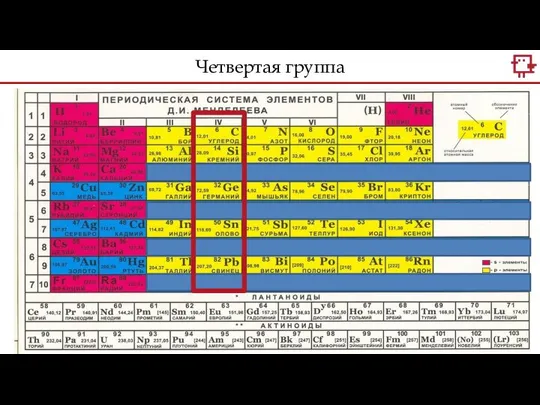
- 5. Четвертая группа
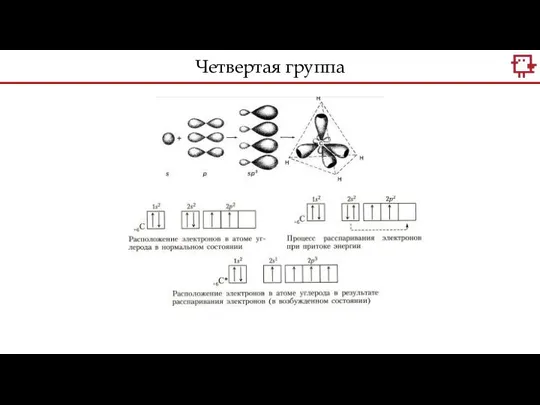
- 6. Какое распределение электронов характерно для С, а какое для Si? Четвертая группа
- 7. Четвертая группа
- 8. Четвертая группа Какие степени окисления и валентности у веществ: CO2, SiO2, CH4, SiH4 Метан Силан
- 9. Четвертая группа Какие степени окисления и валентности у веществ: CO2, SiO2, CH4, SiH4 Метан Силан
- 10. Четвертая группа
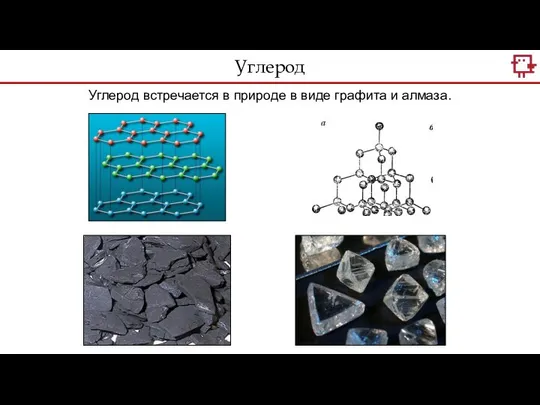
- 11. Углерод Углерод встречается в природе в виде графита и алмаза.
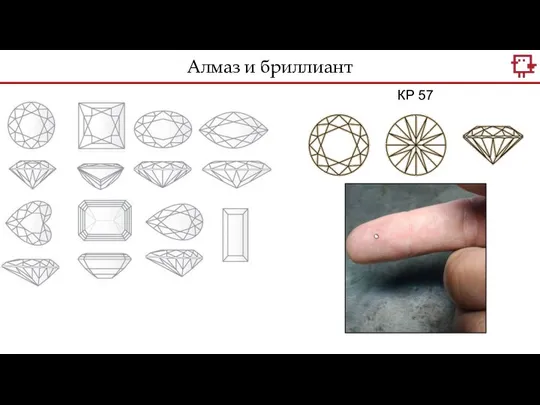
- 12. Алмаз и бриллиант КР 57
- 13. Алмаз и бриллиант
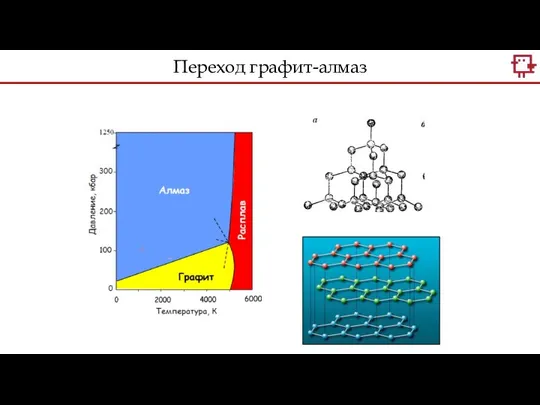
- 14. Переход графит-алмаз
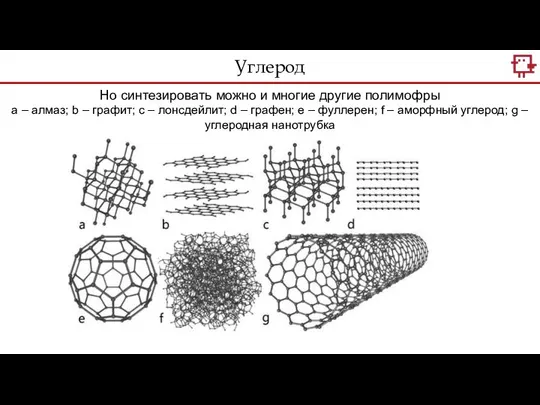
- 15. Углерод Но синтезировать можно и многие другие полимофры а – алмаз; b – графит; c –
- 16. Углерод «За новаторские эксперименты по исследованию двумерного материала графена» Андрей Гейм, Константин Новосёлов
- 17. Углерод Адсорбция – поглощение вещества из газообразной среды или раствора поверхностным слоем жидкости или твердого тела
- 18. Углерод. Химические свойства Графит – типичный восстановитель. При нагревании С + О2 = СО2 При недостатке
- 19. Углерод. Химические свойства Карборунд – вещество, схожее по твёрдости с алмазом: Si + C = SiC
- 20. Углерод. Химические свойства Углерод не реагирует с кислотами, кроме концентрированных азотной и серной, которые его окисляют:
- 21. Углерод. Химические свойства Графит часто используют для восстановления малоактивных металлов из их оксидов: CuO + C
- 22. Оксид углерода (II) Оксид углерода (II) – ядовитый газ бес цвета и запаха, горит голубоватым пламенем,
- 23. Оксид углерода (II) При обычных температурах СО не вступает в реакции с водой, щелочами, кислотами. При
- 24. Оксид углерода (II) При обычных температурах СО не вступает в реакции с водой, щелочами, кислотами. При
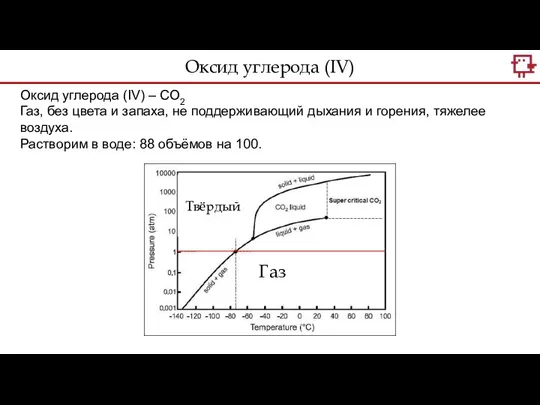
- 25. Оксид углерода (IV) Оксид углерода (IV) – CO2 Газ, без цвета и запаха, не поддерживающий дыхания
- 26. Оксид углерода (IV) При больших концентрациях оксид углерода (IV) – яд! При концентрациях около 3% в
- 27. Оксид углерода (IV) СО2 – ангидрид угольной кислоты Н2СО3. При растворении СО2 в воде частично образуется
- 28. Оксид углерода (IV) Соли угольно кислоты – карбонаты и гидрокарбонаты. Качественная реакция на соли действие сильных
- 29. Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na2CO3*10H2O; Na2CO3*7H2O; Na2CO3*H2O. Cоду получают методом
- 31. Скачать презентацию





















 Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД)
Электролитическая диссоциация(ЭД). Теория электролитической диссоциации (ТЭД) Физические свойства природного газа. Фазовое состояние
Физические свойства природного газа. Фазовое состояние Biochemistry of thyroid hormones
Biochemistry of thyroid hormones Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров
Химия и физика полимеров. Молекулярная структура полимера. Надмолекулярная структура полимеров Окислительный стресс
Окислительный стресс Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Химическая картина мира
Химическая картина мира Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно
Презентация по Химии "8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА" - скачать смотреть бесплатно Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов
Термодинамическая оценка использования гидрометаллургических методов для извлечения ценных компонентов Харчові добавки
Харчові добавки  Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно
Презентация по Химии "ХЛОР - ФИЗИОЛОГИЧЕСКАЯ И ПАТОЛОГИЧЕСКАЯ РОЛЬ В ОРГАНИЗМЕ ЧЕЛОВЕКА" - скачать смотреть бесплатно Введение. Классификация минеральных удобрений
Введение. Классификация минеральных удобрений Химические методы анализа
Химические методы анализа Ферменти. Історія вчення про ферменти
Ферменти. Історія вчення про ферменти Презентация по химии Хлороводород. Соляная кислота.
Презентация по химии Хлороводород. Соляная кислота.  Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Получение витаминов
Получение витаминов Русская живопись 17 века
Русская живопись 17 века  Карбоновые кислоты. Модели молекул
Карбоновые кислоты. Модели молекул Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф
Установка гидрокрекинга в составе завода глубокой переработки нефти ООО Кинеф Химические уравнения
Химические уравнения Запобігання виникнення горіння засобами, що розбавлюють та інгібують
Запобігання виникнення горіння засобами, що розбавлюють та інгібують Синтетические полимеры. Искусственные полимерные материалы
Синтетические полимеры. Искусственные полимерные материалы  Презентация по Химии "Нитраты в овощах" - скачать смотреть
Презентация по Химии "Нитраты в овощах" - скачать смотреть  Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля
Растворы. Термодинамика процесса растворения. Способы выражения концентрации. Идеальные растворы. Законы Рауля Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства.