Содержание
- 2. Урок 9 класса Углерод Можно прийти в четверг после 16:30
- 3. Подготовка к ОГЭ: По четвергам (начиная с 19.10) в 410 в 17:00 до 18:30
- 4. Оксид углерода (IV) СО2 – ангидрид угольной кислоты Н2СО3. При растворении СО2 в воде частично образуется
- 5. Оксид углерода (IV) Соли угольно кислоты – карбонаты и гидрокарбонаты. Качественная реакция на соли действие сильных
- 6. Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na2CO3*10H2O; Na2CO3*7H2O; Na2CO3*H2O. Cоду получают методом
- 7. Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na2CO3*10H2O; Na2CO3*7H2O; Na2CO3*H2O. Cоду получают методом
- 8. Кремний Кремний – типичный восстановитель. Si + O2 = SiO2 SiO2 + Si = 2SiO 2Si
- 9. Кремний Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: 3Si + 4HNO3 + 12HF =
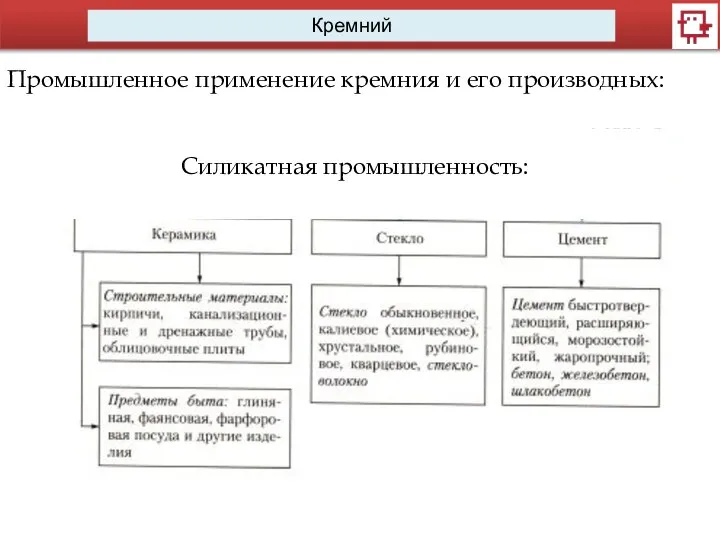
- 10. Кремний Промышленное применение кремния и его производных: Силикатная промышленность:
- 11. Металлы Металлы
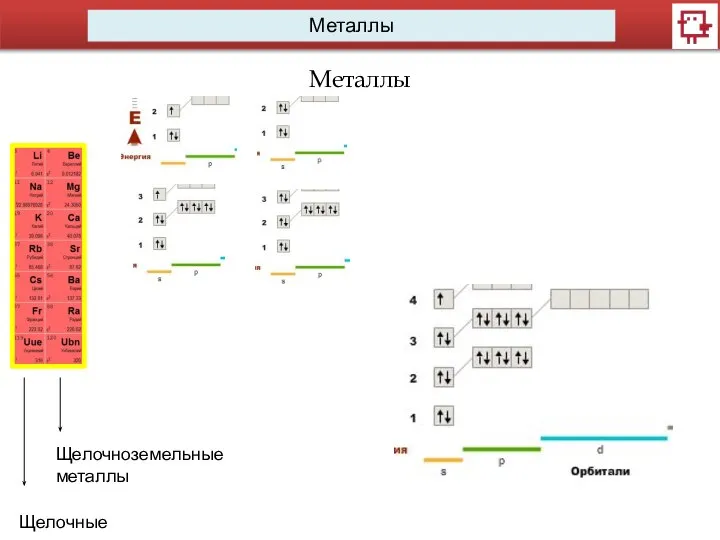
- 12. Металлы Металлы Щелочные металлы Щелочноземельные металлы
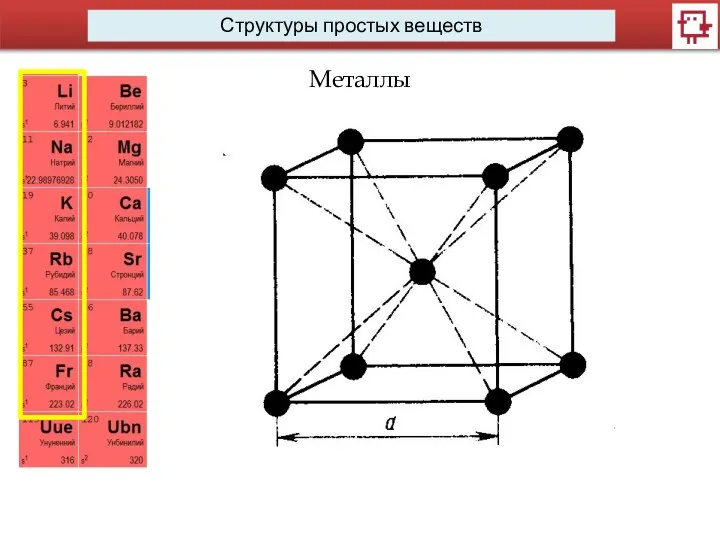
- 13. Структуры простых веществ Металлы
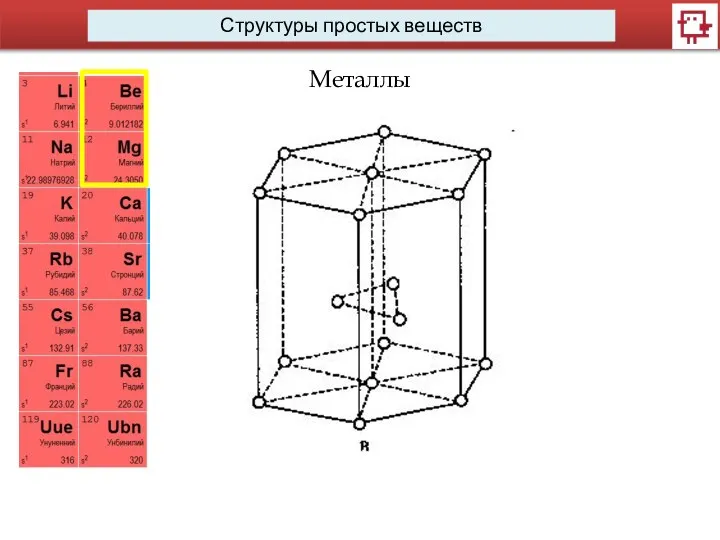
- 14. Структуры простых веществ Металлы
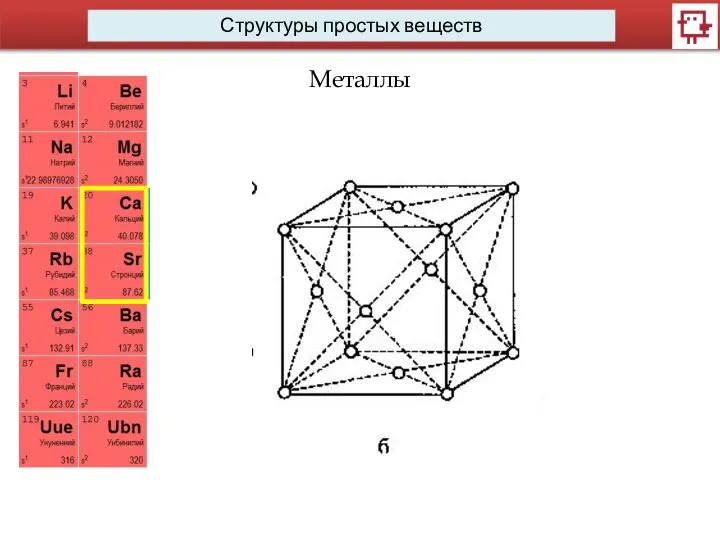
- 15. Структуры простых веществ Металлы
- 17. Скачать презентацию







 Натрій. Знаходження в періодичній системі і основні характеристики
Натрій. Знаходження в періодичній системі і основні характеристики Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.
Степень окисления. Бинарные соединения металлов и не металлов: оксиды, хлориды, сульфиды и др.  Кальций
Кальций Вода - Н2О
Вода - Н2О ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы
ZnS и ZnSe как оптические материалы,люминофоры, лазерные матрицы Многообразие органических веществ
Многообразие органических веществ Личностно-ориентированный подход в обучении химии
Личностно-ориентированный подход в обучении химии Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Иерархия классов методов моделирования. Атомистические и микроскопические методы
Иерархия классов методов моделирования. Атомистические и микроскопические методы Задачи на смеси (задание № 33)
Задачи на смеси (задание № 33) Характеристика галогенів. Їх біологічне значення Виконали учениці 10-Б класу Халімон Заріна Петрова Оксана Борисенко Юлія Ми
Характеристика галогенів. Їх біологічне значення Виконали учениці 10-Б класу Халімон Заріна Петрова Оксана Борисенко Юлія Ми Температура точки росы газа
Температура точки росы газа ОГЭ химия 2021 задание 13
ОГЭ химия 2021 задание 13 Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов
Химическая природа и состав нефти и газа. Физико-химические свойства нефтей и нефтепродуктов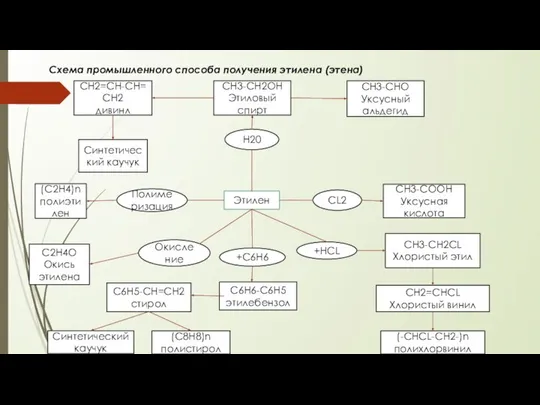 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена)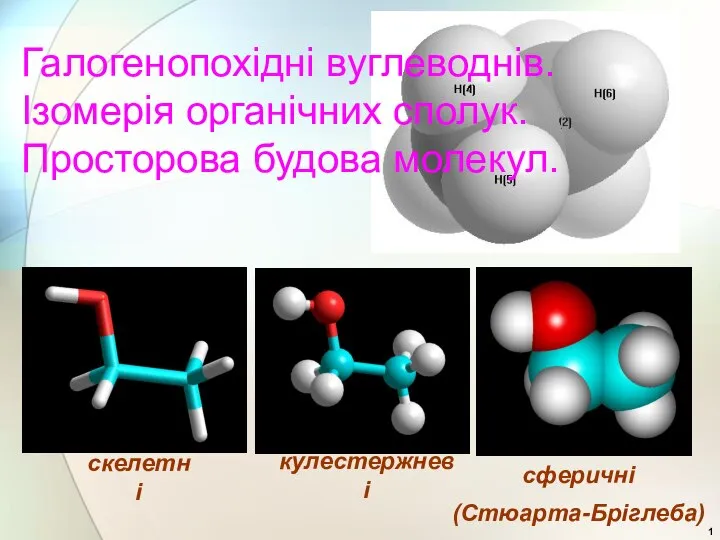 Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул
Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул Производные пиррозилидина. (Лекция 6)
Производные пиррозилидина. (Лекция 6) Диагностика магматических горных пород
Диагностика магматических горных пород Хлороводород и соляная кислота
Хлороводород и соляная кислота Презентация по Химии "Техника безопасности на уроках химии" - скачать смотреть
Презентация по Химии "Техника безопасности на уроках химии" - скачать смотреть  Циклоалканы и их применение
Циклоалканы и их применение Хімічні явища в побуті
Хімічні явища в побуті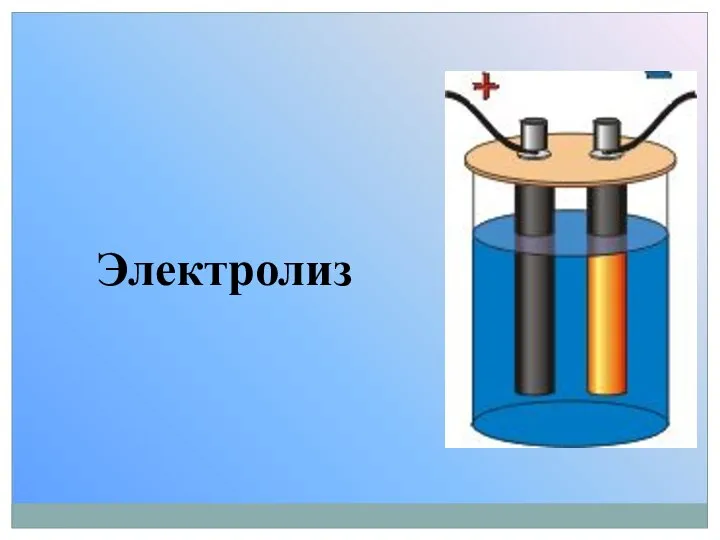 Электролиз
Электролиз Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері
Химиялық тепе-теңдік және оның ығысуына әсер етуші жағдайлар. Ле Шателье-Браун принциптері Вода. Состав и строение молекулы
Вода. Состав и строение молекулы Кислород
Кислород Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5)
Геохимия природных процессов. Редкие элементы, как индикаторы геодинамических обстановок формирования комплексов. (Лекция 5) Закономерности управления каталитическими процессами. Упрощенный вариант
Закономерности управления каталитическими процессами. Упрощенный вариант